- •Лекция 9. Неорганическая химия: Химия элементов I и II групп
- •Неорганическая химия: химия переходных элементов
- •Раздел 1. Комплексные соединения
- •Раздел 2. Химия переходных элементов
- •Неорганическая химия: галогены
- •Неорганическая химия: химия элементов VI группы. Халькогены
- •Неорганическая химия: химия элементов V группы
- •Неорганическая химия: химия элементов IV группы
- •Неорганическая химия: химия элементов III группы
Неорганическая химия: химия элементов IV группы
ns2np2®nsnp3
Четыре валентных электрона - возможность образования трехмерных ковалентных структур. Большая энергия сублимации.
Углерод - много аллотропных модификаций, сильно отличающихся по свойствам.
1) графит - считается простым веществом. sp2-гибридизация, образуются сетки из плоских шестиугольников, pz-орбитали, как в случае бензола, образуют делокализованные p-связи. Слои удерживаются между собой Ван-дер-Ваальсовыми силами.

В результате графит - мягкий, легко сшелушивается (карандаши), проводит электрический ток.
Сграфит® Салмаз DНо=+2.1 кДж/моль DS<0
Этот процесс становится возможным только при t >2000oC и Р=105атм.
Алмаз - ковалентная решетка, каждый атом связан с четырьмя другими. Высокая твердость (но хрупкость), изолятор, драгоценный камень.
Карбин - черный порошок, составлен из цепочек =С=С=С=…
Аморфный уголь - мягкий, не обладает кристаллической структурой, зато обладает развитой поверхностью, что делает его хорошим адсорбентом.
Сравнительно недавно получены фуллерены - модификация углерода, состоящая из полых шарообразных частиц по 60 атомов углерода в каждой.
Кремний и германий - структура алмаза, но менее твердая, полупроводники. Олово - обычно мягкий белый металл, но при низких температурах происходит переход b-Sn(мет) ®a-Sn(алмаз) - серое олово, очень хрупкое - порошок (оловянная чума). Свинец - металл с соответствующей кубической металлической решеткой.
Как обычно, вниз по группе растет металлический характер. Справа налево - тоже: фосфор - изолятор, кремний - полупроводник, алюминий - металл.
Степени окисления - +2, +4. Насчет -4 - вопрос, поскольку водородные соединения сугубо ковалентные, и кто там + а кто - можно поспорить.
Склонность к образованию цепей (уменьшается вниз по группе)
Э-Э |
C-C |
Si-Si |
Ge-Ge |
Sn-Sn |
Pb-Pb |
DНоат,кДж |
348 |
176 |
188 |
150 |
? |
Это свойство углерода - основа всей органической химии. Однако кремний и германий тоже образуют силаны и германы - аналоги углеводородов.
Углерод и кремний образуют соединения с ковалентной связью, олово и свинец в низшей степени окисления образуют соли (в известной степени ионные соединения).
С - координационное число 4, для кремния тоже, но существует H2SiF6 - гексафторкремниевая кислота. Вниз по группе координационное число 6 становится все более доминирующим.
С водой и кислотами углерод и кремний не реагируют,
Ge |
Eo(Ge2+/Ge) = 0 |
Si+2NaOH + H2O ® Na2SiO3+2H2 |
Sn |
Eo(Sn2+/Sn) = -0.136 |
Sn+2KOH +2H2O ® K2[Sn(OH)4]+H2 |
Pb |
Eo(Pb2+/Pb) = -0.126 |
Pb+2KOH +2H2O ® K2[Pb(OH)4]+H2 |
Однако, как видно из правого столбца, элементы IV группы и даже кремний растворяются в щелочах. В то же время активность металлов возрастает справа налево - Sb и Bi в кислотах не растворялись, а олово и свинец растворяются, хотя и плохо. В кислотах окислителях Ge, Sn окисляются до +4, свинец - до +2 (аналогия с V группой).
Все элементы - восстановители. С - сильный, остальные слабее.
2CuO + C = 2Cu + CO2
Водородные соединения
C - CH4 - CnH2n+2. Образование цепей.
Si - силаны, Ge - германы. Водородные соединения Sn и Pb очень нестабильны, разлагают воду.
Получение C + H2 ® CH4
Mg2Э + HCl ® ЭН4 + MgCl2
Mg2Э - силициды, германиды, станниды.
Кислотно-основные свойства у соединений элементов IV группы с водородом отсутствуют.
Соединения с галогенами
C - CCl4 (степень окисления +2 не проявляется) - вообще говоря, галогенангидрид, но по кинетическим соображениям инертен, хороший неполярный растворитель (растворяет галогены).
SiCl4 (ЭCl4 - галогенангидриды, SnCl4 - жидкость). PbГ4 неустойчивы, т.к Pb(IV) - сильный окислитель, а Г- - восстановители, кроме F.
ЭГ4 + H2O ® ЭО2×nH2O + НГ
ЭГ4 + 2КГ ® К2ЭГ6 - кислоты Льюиса.
Sn, Pb(II) образуют ЭГ2 - соли, хотя SnCl2 сильно гидролизован и в растворе может существовать только в кислой среде.
Кислородные соединения
СО |
(SiO) |
GeO |
SnO |
PbO |
Несолеобразующие |
Ge(OH)2 |
Sn(OH)2 |
Pb(OH)2 |
|
|
амфотерные |
основной |
||
Вниз по группе растет стабильность низших оксидов и их основность.
СO2 |
SiO2 |
GeO2 |
SnO2 |
PbO2 |
H2CO3 |
H2SiO3 |
Ge(OH)4 |
Sn(OH)4 |
Pb(OH)4 - ЭО2×nH2O |
Стабильность падает, увеличивается амфотерный характер.
У свинца есть еще один смешанный оксид - Pb3O4 - свинцовый сурик.
Начнем с оксидов углерода.
СО
|
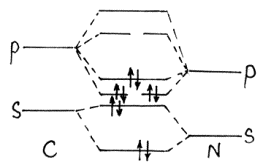
Его считают иногда ангидридом муравьиной кислоты, поскольку его можно получить HCOOH ® CO + H2O путем дегидратации последней при 100оС с H2SO4. Очень прочный оксид. DНат=1067 кДж. Причина такой прочности слева на рисунке. Эта молекула изоэлектронна молекуле азота -тройная связь. |
СО - донор электронной пары и акцептор электронов с d-элементов, образует комплексные соединения с переходными металлами, карбонилы. При этом по правилу Сиджвика каждый атом металла стремится образовать электронную оболочку ближайшего инертного газа (18е). Отсюда и количество групп СО, координированных вокруг металла: Fe: 3d64s2 (не хватает 10 е) - Fe(CO)5, у никеля 10е - Ni(CO)4, а марганцу: d5s2 приходится образовывать димеры: [Mn(CO)5]2. Способ очистки металлов.
СО + 1/2O2 = CO2 DН=-283 кДж, но идет с трудом.
СO + H2O « CO2 + H2 DН=-41 кДж, DS<0. DGo=0 при 830оС - водяной газ, очень часто используется в технике в качестве восстановителя.
О стабильности оксидов говорит следующая схема:
Ge + GeO2 = 2GeO |
DGo=+83 кДж |
Sn + SnO2 = 2SnO |
DGo=+8 кДж |
Pb + PbO2 = 2PbO |
DGo=-159 кДж |
Двуокись свинца - сильный окислитель, эффект инертной пары. Стабильность низших оксидов растет вниз по группе.
Гидроксоформы.
СО2 - тяжелый газ. H2CO3 - слабая кислота K1=4.2×10-7; K2=4.8×10-11.
Карбонаты и гидрокарбонаты.
SiO2×nH2O - H2SiO3 - H4SiO4 слабая кислота , в воде не растворима. Соли - силикаты, кроме щелочных металлов, не растворимы. Силикат натрия в воде образует коллоидный раствор (клей).
HClO4 - H2SO4 - H3PO4 - H4SiO4
Убывает электроотрицательность центрального атома, уменьшается полярность связи О-Н, уменьшается сила кислот.
GeO2×nH2O и SnO2×nH2O - амфотерные гидроксиды. Гидроксоформы Pb(IV) нестабильны.
Сульфиды. SnS и PbS нерастворимы. SnS2 растворим в (NH4)2S (GeS2 - тоже) SnS2 + (NH4)2S ® (NH4)2SnS3 - тиосоль, разлагается в кислой среде.
СS2 - тяжелая жидкость. СS2 + Na2S ® Na2CS3 - соль тиоугольной кислоты.
Еще о соединениях углерода (неорганических).
Соединения интеркаляции графита - внедрение элементов между слоями. Оксид графита.
|
Соединения с металлами – карбиды |
|
|
а) солеобразные: |
I - метаниды Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 |
|
|
II-ацетилениды CaC2 + 2H2O ®Ca(OH)2 + C2H2 |
б) карбиды внедрения - сталь, соединения интеркаляции графита металлами.
в) ковалентные SiC - карборунд
Соединение углерода с азотом - циан (CN)2 - аналог галогенов, т. к. имеет неспаренный электрон и образует такую молекулу и циановую кислоту (синильную) HCN , правда, в отличие от НГ, она очень слабая. Образует комплексные соединения (лиганд CN-), также как и галогены.