
- •Лекция 9. Неорганическая химия: Химия элементов I и II групп
- •Неорганическая химия: химия переходных элементов
- •Раздел 1. Комплексные соединения
- •Раздел 2. Химия переходных элементов
- •Неорганическая химия: галогены
- •Неорганическая химия: химия элементов VI группы. Халькогены
- •Неорганическая химия: химия элементов V группы
- •Неорганическая химия: химия элементов IV группы
- •Неорганическая химия: химия элементов III группы
Раздел 2. Химия переходных элементов
Все переходные элементы - металлы - твердые, теплопроводные, электропроводные. Почему мы до сих пор рассматривали химию элементов по группам, а d-элементы - по периодам? Причина в схожести их свойств.
Рассмотрим изменение первого потенциала ионизации в 3 периоде и у 3d-элементов.
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
I1, эВ |
5.14 |
7.64 |
5.99 |
8.15 |
10.49 |
10.36 |
13.0 |
но
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
6.56 |
6.82 |
6.74 |
6.77 |
7.44 |
7.89 |
7.86 |
7.63 |
7.73 |
9.39 |
Свойства: а) степени окисления, нестехиометрия;
б) образование комплексных ионов;
в) образование окрашенных соединений;
г) образование кластерных соединений
Пункты б) и в) мы уже подробно рассмотрели.
Остановимся на степенях окисления переходных элементов, их устойчивости, и на тех соединениях, которые они образуют.
Основное отличие от р-элементов - не действует правило четности. Сначала на связь уходят s -электроны, потом d-электроны по одному. У 3d-элементов низшие степени окисления более стабильны, чем высшие, у 4d- и 5d- наоборот, высшие степени окисления более стабильны. 3d-элементы - кайносимметрики - первый раз заполняется d-оболочка. Их свойства отличаются от остальных.
Сравним стабильность высших степеней окисления по группе у р-элементов и у d-элементов:
ClO4- + 2H+ + 2e ® ClO3- + H2O Eo= 1.19
H5IO6 + H+ + 2e ® IO3- + 3H2O Eo=1.601
MnO4- + 4H++ 3e ®MnO2+ 2H2O Eo=1.692
ReO4- + 4H++ 3e ® ReO2 + 2H2O Eo=0.510
У непереходных вниз по группе стабильность высших степеней окисления понижается, у переходных - повышается.
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
|
|
|
|
|
|
|
+1 |
|
|
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
+2 |
+3 |
+3 |
+3 |
+3 |
+3 |
+3 |
+3 |
+3 |
+3 |
|
|
+4 |
+4 |
+4 |
+4 |
+4 |
+4 |
+4 |
|
|
|
|
+5 |
+5 |
+5 |
|
|
|
|
|
|
|
|
+6 |
+6 |
+6 |
|
|
|
|
|
|
|
|
+7 |
|
|
|
|
|
Получилось нечто вроде треугольной косынки. Вплоть до Mn высшая степень окисления соответствует номеру группы, дальше она понижается - некуда распаривать спаренные электроны. Отметим, что скандий проявляет валентность только 3, один остающийся электрон не удерживается на атоме, когда s-электроны ушли. У хрома нестабильны степени окисления +5 (очень редко встречается) и +2 (см. таблицу восстановительных потенциалов), +4 - только в твердых веществах. У Mn существуют все степени окисления от +2 до +7, но +5 очень неустойчива и получается только в холодной щелочи. У кобальта и никеля степени окисления +4 - экзотика. У меди даже +3 очень неустойчива.
Оксиды. Низшие всегда основные (Только у цинка амфотерный). С повышением степени окисления уменьшается ионность связи и увеличивается кислотность оксидов: MnO - основной оксид, Mn2O3 - амфотерный, MnO2 - несолеобразующий, остальные кислотные.
В воде :
pH=0 MnO4- 0.56 MnO42- 2.26 MnO2 0.95 Mn3+ 1.51 Mn2+ -1.18 Mn
pH=14 MnO4- 0.56 MnO42- -0.63 MnO2(-0.7)Mn2O3-0.25Mn(OH)2-1.55 Mn
Легко убедиться, что MnO42- стабилен только в щелочном растворе. Все остальные элементы нужно рассматривать аналогичным образом - какие формы стабильны в растворе, какие нет, что делает комплексообразование со стабильностью.
Кстати. Кобальт(III) нестабилен в кислом растворе, с прибавлением аммиака оба состояния окисления кобальта стабильны, а в растворе синильной кислоты оказывается нестабильным именно кобальт(II):
[Co(CN)6]3- + e ® [Co(CN)6]4- Eo=-0/83
H+ + e ® 1/2H2 0
[Co(NH3)6]3+ + e®[Co(NH3)]2+ +0.108
O2 + 4H+ + 4e ® 2H2O +1.229
Co3+ + e ® Co2+ +1.808
Галогениды 3d-элементов. Низшие - соли, высшие - галогенангидриды. Высшие галогениды, как правило, неустойчивы - нет MnCl7 - просто некуда разместить так много атомов хлора.
Образование нестехиометрических соединений. В твердых телах не действует закон Пруста. Они могут иметь переменный состав в зависимости от способа получения. Дело в том. что в решетках твердых тел образуются дефекты, которые в соединениях переходных металлов могут приводить к частичному окислению металла, что сделать легко. Так, например оксид титана(I) обладает т.н. областью гомогенности от TiO0.60 до TiO1.2. Структура типа каменной соли существует во всем интервале области гомогенности, но растет параметр решетки. В случае же железа, область гомогенности оксида FeO1+x вообще не включает стехиометрический состав. 0.04<x<1.12. На самом деле подрешетка кислорода полностью заполнена атомами, а атомов железа не хватает, тогда рядом с вакансией два атома железа окисляются до +3 и электронейтральность решетки сохраняется, да еще и происходит ее стабилизация.
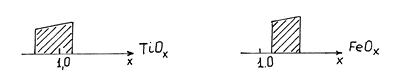
Как отражается на свойствах соединений переходных металлов энергия экстрастабилизации кристаллическим полем?
Рассмотрим теплоты образования галогенидов MCl2.
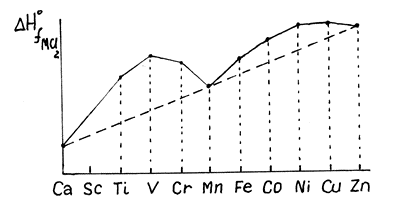
Сравнение свойств 3d-элементов с 4d- и 5d-элементами.
Прежде всего, почему все вместе - 4d- и 5d? Дело в том, что за счет лантаноидного сжатия (14 f-элементов между 4d и 5d) радиусы ионов оказываются практически одинаковыми, а следовательно, и степень ионности связей и прочие свойства.
Ti4+ R=0.605 A, Zr4+ R=0.72 A, Hf4+ R=0.71 A.
1) Неустойчивы низшие степени окисления. Cr Cr2O3 - самый устойчивый оксид. Мо - МoO3 , W - WO3. У рутения и осмия появляются вполне стабильные оксиды RuO4, OsO4.
2) Образование металл-металл связей в ненасыщенных соединениях, и кластерных соединений. Химия кластерных соединений - одно из приоритетных направлений развития неорганической химии сегодня.
(W2Cl9)3- W(III)? Расстояние W-W 2.4 А (В металле 2.8 А). диамагнитный комплекс. Аналогичный комплекс хрома (Cr2Cl9)3- парамагнитен и расстояние Cr-Cr 3.01 А. Между атомами вольфрама тройная связь. Такие соединения могут служить катализаторами - присоединение по металл-металл связи.

|
Переходные металлы в биологии |
Fe - |
гемэритрин, гемоглобин, миоглобин - запасание и перенос кислорода цитохром С (ткани), цитохром В - перенос электрона при дыхании митохондрий каталаза - окисление перекиси водорода |
Со - |
метионинсинтетаза (микроорганизмы) - биосинтез |
Сu - |
цитохромоксидаза (ткани) - перенос электрона. |
Mn - |
пируваткарбоксилаза (печень) - образование пировиноградной кислоты. |
Mo - |
нитрогеназа (бактерии, клубеньки овощей) - фиксация азота нитроредуктаза - восстановление нитрата в нитрит и далее в аммиак. Ксантиноксидаза - окисление пуриновых оснований в мочевую кислоту. |
Иными словами, переходные металлы везде, в природе, в живых организмах. Следовательно, их химию нужно знать досконально, и все инструменты у вас для этого есть.
Еще раз о том , как нужно рассматривать свойства любых химических элементов и их соединений (не только на экзамене, но и в будущей научной работе).
1)Все, что можно извлечь из положения элементов в Периодической системе. 2) Справочные данные о строении и термодинамике соединений.
3)Отсюда следуют способы получения.
4) Поведение в растворах - растворимость в кислотах и щелочах, гидроксоформы, кислотно-основные характеристики, стабильность в растворе и окислительно-восстановительные свойства. Остальные детали можно всегда найти в учебниках.
