- •Лекция 9. Неорганическая химия: Химия элементов I и II групп
- •Неорганическая химия: химия переходных элементов
- •Раздел 1. Комплексные соединения
- •Раздел 2. Химия переходных элементов
- •Неорганическая химия: галогены
- •Неорганическая химия: химия элементов VI группы. Халькогены
- •Неорганическая химия: химия элементов V группы
- •Неорганическая химия: химия элементов IV группы
- •Неорганическая химия: химия элементов III группы
Лекция 9. Неорганическая химия: Химия элементов I и II групп
ns1 и ns2 - блестящие, электропроводные, теплопроводные металлы.
|
I1, эВ |
Ео(М+/M) |
|
|
I1, эВ |
Ео(М2+/M) |
Li |
5.32 |
-3.05 |
|
Be |
9.32 |
-1.85 |
Na |
5.14 |
-2.71 |
|
Mg |
7.64 |
-2.37 |
K |
4.34 |
-2.93 |
|
Ca |
6.13 |
-2.87 |
Rb |
4.18 |
-2.92 |
|
Sr |
5.69 |
-2.89 |
Cs |
3.89 |
-2.92 |
|
Ba |
5.22 |
-2.91 |
Элементы I группы - мягкие, легкие, низкие Тпл, Ткип. Li, Na, K - легче воды.
Сильные восстановители - все. Следовательно, в свободном виде их нет. Получают электролизом. Не подлежат хранению на воздухе (кроме Be и Mg - окисная пленка). Называются соответственно щелочными и щелочно-земельными металлами. Имеем дело с их соединениями. Только чистый натрий используется в органическом синтезе.
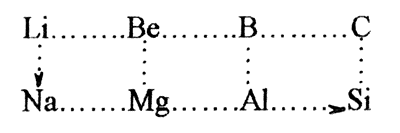
Опять возникает проблема диагонального сходства. Уже видели, что бор больше похож на кремний, чем на алюминий. Оказывается, что литий больше похож на магний, чем на элементы своей группы, а бериллий на алюминий. В чем дело? Дело в степени ионности связей, образуемых элементами, в степени поляризации ими электронов контрагентов.
Правила Фаянса
1) Ионная связь образуется катионами с малым зарядом.
2) Ионная связь требует малого радиуса аниона и большого радиуса катиона.
В Периодической таблице самые ионные соединения CsF, CsCl, NaCl - иными словами, контрагенты лежат на концах диагонали, соединяющей нижний левый и верхний правый углы.
Уменьшение поляризующей способности |
увеличение поляризующей способности |
Li и Mg - близкая поляризующая способность, почти одинаковая степень ионности связей. То же у Be и Al, B и Si .
Докажем. Li и Mg. Отличие от остальных элементов I группы.
1) Кислородные соединения.
2Na + O2 = Na2O2 K(Rb,Cs)+O2=KO2 4Li +O2®2Li2O; Mg +1/2O2®MgO
Все MOH хорошо растворимы в воде, кроме LiOH [ и Mg(OH)2]
Sic!!! Все щелочи поглощают СО2 и Н2О; при плавлении разрушают стекло и фарфор; растворы нельзя хранить в шлифованной посуде; разрушают живые ткани.
3) Элементы I группы с N2 не реагируют, но
Li + N2 ® Li3N Mg + N2 ® Mg3N2
4) карбонаты и гидроксиды элементов I группы не разлагаются при нагревании, но
Li2CO3®Li2O + CO2 MgCO3® MgO + CO2
LiOH ® Li2O + H2O Mg(OH)2®MgO + H2O
4) Нитраты элементов I группы разлагаются до нитритов, Li и Mg - до оксидов.
5) Соли элементов I группы растворимы в воде . У Li и Mg нерастворимы фториды, карбонаты, фосфаты.
Бериллий и алюминий.
1) q/r Be2+ - 66 ед.заряда/нм; Al3+ - 60 ед.заряда/нм.
2) Оксиды, гидроксиды элементов II группы - основания, Be, Al - амфотерны.
3) Галогениды II группы - соли. Be, Al в безводном состоянии димеры Be2Cl4, Al2Cl6.
4) Со щелочью Be, Al дают комплексы [Be(OH)4]2-, [Al(OH)4]- и [Al(OH)6]3-/
Соединения с водородом элементов I и II группы - ионные гидриды, Н-, кроме Be и Mg - ковалентные.
Соли не гидролизуются по катиону, кроме Li, Be, Mg.
Карбонаты гидролизуются по аниону. Жесткость воды. Временная - карбонатная, обусловлена гидрокарбонатами. Постоянная - сульфат магния.
BaSO4 - нерастворим в кислотах - контрастное вещество при рентгеновских обследованиях.