
Наглядная химия. Алкены (pdf)
.pdf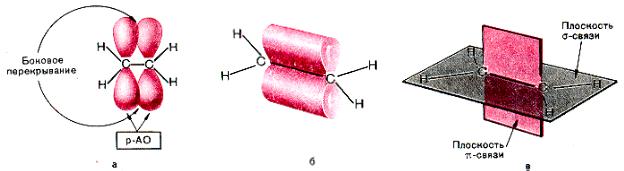
1
Особенности строения, реакционной способности и методы синтеза алкенов
• Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь.
СnН2n
1. Электронное строение
Рис. Строение двойной связи в молекуле этилена
2
2.Номенклатура
1)в алкенах с неразветвленной цепью нумерацию производят с того конца, ближе к которому находится двойная связь. В названии алкана, соответствующего этой родоначальной структуре, суффикс - ан заменяется на -ен
CH |
|
CH |
CH2 |
|
CH |
|
CH3 CH3CH |
|
CHCH2CH2CH3 |
|
|
|
|
||||||
|
|
|
|
||||||
2 |
2 |
|
|
|
|
|
|
|
|
этилен |
пропилен |
гексен-2 |
|||||||
2) в случае разветвление главной считается цепь, включающая двойную связь, даже если эта цепь и не является самой длинной. Нумерация производится таким образом, чтобы атом углерода, от которого начинается двойная связь, получил наименьший номер
1
5 |
4 |
3 |
2 |
|
CH2 |
|
|
|||||
|
|
|
||||||||||
CH3 |
|
CH2 |
|
CH2 |
|
C |
|
CH2 |
|
CH3 |
||
|
|
|
|
|
||||||||
2-этилпентен-1
3) углеводородные заместители обозначаются префиксом. Положение их указывается цифрой, соответствующей номеру того атома углерода, у которого находится заместитель. Заместители перечисляются в алфавитном порядке. В случае нескольких одинаковых углеводородные заместителей перед их названием ставится умножительная приставка ди-, три- и т. д.
3
1 |
|
2 |
|
3 |
4 |
1 |
2 |
3 |
4 |
5 |
|
6 |
|||||||||
CH |
|
|
C |
|
CH |
|
CH |
CH3 |
|
C |
|
CH |
|
CH2 |
|
CH |
|
CH3 |
|||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH |
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2-метилбутен-2 |
|
|
|
|
2,5-диметилгексен-2 |
|
||||||||||||||
CH2 |
|
CH |
|
CH2 |
|
CH |
|
CH2 |
|
|
|||||||
|
|
|
||||||
|
|
|||||||
этенил |
|
|
2-пропенил |
|||||
(винил) |
|
|
|
(аллил) |
||||
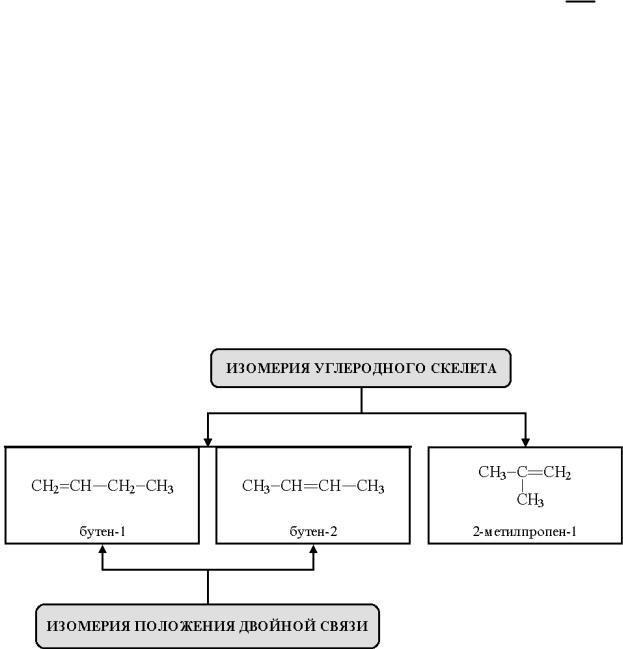
3. Изомерия
Структурная изомерия

4
Пространственная изомерия (цис- и транс-изомерия)
Рис. Цис- и транс-изомеры бутена-2
H3C |
CH3 |
H3C |
H |
C |
C |
C |
C |
H |
H |
H |
CH3 |
цис-бутен-2 |
транс-бутен-2 |
||
Ткип=4° С |
Ткип=1° С |
||
CH3
CH2 C
CH2CH3
2-метилбутен-1
5
Номенклатура цис-, транс-изомеров
H3C |
CH3 |
H3C |
CH2CH3 |
C |
C |
C |
C |
H |
CH2CH3 |
H |
CH3 |
транс-3-метил-2-пентен |
цис-3-метил-2-пентен |
||
H |
H |
H |
Cl |
C |
C |
C |
C |
Cl |
Cl |
Cl |
H |
цис-1,2-дихлорэтен транс-1,2-дихлорэтен
H |
H |
H |
Cl |
C |
C |
C |
C |
O2N |
Cl |
O2N |
H |
цис-1-нитро-2-хлорэтен |
транс-1-нитро-2-хлорэтен |
||
Br |
CH3 |
Br |
Cl |
C |
C |
C |
C |
O2N |
Cl |
O2N |
CH3 |
1. Используя систему Кана–Ингольда–Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью, и дают им номера по старшинству 1 или 2.

6
2. Если две наиболее старшие группы расположены по одну сторону от плоскости π -связи, то конфигурация заместителей обозначается символом Z, если же эти группы находятся по разные стороны от плоскости π -связи, то конфигурация обозначается символом Е.
(1) H C |
H (2) |
(1) H C |
CH (1) |
3 |
|
3 |
3 |
C |
C |
C |
C |
(2) H |
CH3 (1) |
(2) H |
H (2) |
(Е)-2-бутен |
(Z)-2-бутен |
||
Br |
CH3 |
Br |
Cl |
C |
C |
C |
C |
O2N |
Cl |
O2N |
CH3 |
(Е)-1-бром-1-нитро-2-хлорпропен |
(Z)-1-бром-1-нитро-2-хлорпропен |
||
4.Физические свойства
5.Способы получения
Пиролиз алканов
|
|
|
|
|
CH CH |
-H |
CH2 CH2 |
||
|
|
|
|
|
3 |
2 |
|
этилен |
|
CH |
CH |
CH |
CH |
CH ∆ |
этил |
|
|
|
|
|
|
|
|
||||||
3 |
2 |
2 |
2 |
3 |
|
|
|
+H |
|
|
|
|
|
|
CH CH CH |
CH3CH2CH3 |
|||
|
|
|
|
|
3 |
2 |
2 |
|
|
|
|
|
|
|
пропил |
|
|
пропан |
|

7
Реакции элиминирования
• Элиминирование—это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними
π -связи.
C C
 C C + XY
C C + XY
X Y
Дегидрогалогенирование
|
|
|
CH3 |
|
|
CH |
|
CH3 |
+ KOH |
|
|
CH3CH |
|
|
CH2 + KBr + H2O |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
2-бромпропан |
|
|
|
|
пропен |
||||||||||||||||||||
CH3 |
|
|
CH |
|
|
CH |
|
CH2CH3 |
+ KOH |
|
CH3 |
|
C |
|
CH |
|
CH2CH3 + KBr + H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
CH3 Br |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
CH3 |
||||||||||||||||||||
3-бром-2-метилпентан |
|
|
|
2-метилпентен-2 |
||||||||||||||||||||||||
8
Дегидратация
CH2 |
CH2 |
H2SO4, 170°C |
CH |
|
CH + |
H O |
||||
|
||||||||||
|
|
|||||||||
|
|
|
2 |
|
2 |
|
|
2 |
||
H |
OH |
|
этилен |
|
||||||
этанол |
|
|
||||||||
CH3 CH CH2 |
H2SO4, 180°C |
CH3 |
|
|
|
CH |
|
CH2 + H2O |
||
|
|
|
|
|
||||||
H |
OH |
|
|
|
|
пропен |
|
|||
пропанол-1 |
|
|
|
|
|
|||||
Дегалогенирование
|
|
|
CH3 |
|
|
|
CH3 |
|||||||||
CH3 |
|
C |
|
|
CH |
|
CH3 + Zn |
|
CH3 |
|
C |
|
CH |
|
CH3 + ZnBr2 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
Br |
Br |
|
2-метилбутен-2 |
|||||||||||
2,3-дибром-2-метилбутан |
|
|||||||||||||||
Дегидрирование |
|
|
|
|
|
|
|
|
||||||||
Cr2O3, 500°C |
CH3CH |
|
CHCH3 + H2 |
||
|
|||||
|
|||||
|
|
бутен-2 |
|||
CH3CH2CH2CH3 |
|
|
|
|
|
бутан |
CH2 |
|
CHCH2CH3 + H2 |
||
|
|||||
|
|||||
|
|
|
бутен-1 |
||
6. Химические свойства
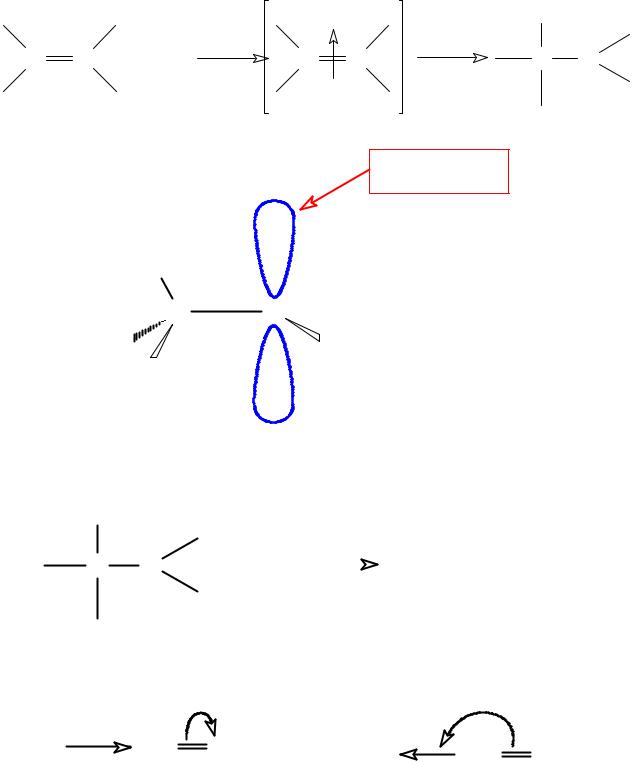
Реакции электрофильного присоединения
Механизму электрофильного присоединения – АE (от англ. addition electrophilic).
9
|
H+ |
H |
C C + H+ |
C C |
+ |
C C |
pz-орбиталь
H
C +C












|
sp3 |
sp2 |
|
|
|
|
|
|
|
|
|
|
H |
+ |
|
|
|
|
H |
|
X |
||||
|
+ X- |
|
|
|
|
|
|
|
|
|
|
|
C |
C |
|
|
|
C |
|
|
C |
|
|||
|
|
|
|
|
||||||||
sp3 |
sp2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3 |
sp3 |
||||||||
|
δ + |
δ− |
δ− |
δ + |
|
R |
CH |
CH2 |
|||
X CH |
CH2 |
+I–эффект |
–I–эффект |

10
Гидрогалогенирование
CH3 |
|
CH |
|
CH |
|
CH3 + HCl |
|
CH3 |
|
|
CH |
|
|
CH |
|
CH3 |
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Cl H |
||||||
|
|
бутен-2 |
|
|
2-хлорбутан |
|||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
CH3 |
|
CH |
|
CH2 + HBr |
|
|
|
|
Br |
|
|||
|
|
|
|
2-бромпропан |
|||||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
|
пропен |
|
|
CH3 |
|
CH |
|
CH2 |
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
H |
|
Br |
||
|
|
|
|
|
|
|
1-бромпропан |
||||||
|
|
|
|
|
|
|
(не образуется) |
||||||
Правило Марковникова: при присоединении молекул типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
δ -
CH3 CH CH2
CH CH2
|
|
|
CH3 |
+ |
CH3 |
|
|
+ |
CH |
||
CH |
δ - |
вторичный карбкатион |
|||
CH CH |
H |
|
|
|
|
3 |
2 |
|
|
|
+ |
|
|
|
CH3 |
CH2 |
|
|
|
|
CH2 |
||
первичный карбкатион
