
- •Розділ IV загальні відомості про метали
- •§ 22. Місце металів у періодичній системі елементів. Металічний зв'язок.
- •§ 23. Хімічні властивості металів
- •§ 24. Метали в природі. Загальні способи добування металів
- •§ 25. Електроліз
- •§ 26. Корозія металів
- •§ 27. Сплави
- •§ 28. Доменне виробництво чавуну
- •§ 29. Способи виробництва сталі
- •§ З0. Проблема безвідхідних виробництв у металургії й охорона довкілля.
- •§ 31. Застосування металів і сплавів у сучасній техніці
- •§ 32. З історії розвитку чорної металургії в україні
- •§ 33. Натрій і калій –лужні метали
- •§ 34. Кальцій та його сполуки
- •§ 35. Алюміній
- •§ 36. Сполуки алюмінію
- •§ 37. Ферум
- •§ 38. Сполуки феруму
- •Хімічні властивості металів
- •Розв'язування експериментальних задач з теми «Метали»
- •Тема 4. «Хімія і життя»
- •Органічні речовини як основа сучасних матеріалів
- •Тема 4. Хімія і життя
- •Органічні речовини як основа сучасних матеріалів Природні органічні сполуки
- •§ 28. Вуглеводи. Глюкоза і фруктоза
- •§ 29. Дисахариди
- •§ 30. Полісахариди
- •§ 31. Нуклеїнові кислоти
- •§ 32. Жири
- •§ 34. Алкалоїди. Антибіотики
- •Високомолекулярні органічні сполуки
- •§35. Загальна характеристика полімерів
- •§36. Добування високомолекулярних сполук
- •§ 37. Пластмаси
- •§38. Каучуки і волокна
- •Класифікація волокон
- •Хімія та здоров’я
- •Хімія та побут Класифікація товарів побутової хімії
- •Абразивні товари.
- •Засоби для прання та миття
- •Засоби для очищення
- •Лакофарбові товари
- •Інструменти для малярних робіт
- •Засоби по догляду за житлом, предметами домашнього побуту, садом і городом
Розділ IV загальні відомості про метали
Ви вже вивчили основні поняття, закони й теорії хімії. Спираючись на них як на теоретичну основу, тепер ви ознайомитесь з хімічними елементами та їх сполуками. Вивчатимемо спочатку елементи-метали та відповідні їм прості речовини – метали.
§ 22. Місце металів у періодичній системі елементів. Металічний зв'язок.
ФІЗИЧНІ ВЛАСТИВОСТІ МЕТАЛІВ.
Ви знаєте, що всі хімічні елементи умовно (чому?) поділяють на метали і неметали. Переважна більшість хімічних елементів – це елементи-метали. До них належать усі елементи побічних підгруп, включаючи лантаноїди та актиноїди; елементи головних підгруп І (за винятком Гідрогену), II і III груп (крім Бору) та деякі елементи головних підгруп IV–VI груп, а саме: Германій, Станум, Плюмбум, Стибій, Бісмут, Полоній. Виходить, що всі елементи-метали розміщені в лівій частині періодичної системи під діагоналлю Бор В –Астат At (див. таблицю елементів).
Особливість будови атомів металів. На зовнішньому електронному шарі атомів більшості металів невелике число електронів – від 1 до 3. Атоми металів легко віддають електрони і набувають конфігурації попереднього інертного газу.
Легкість віддавання електронів зростає: а) із зменшенням їхньої кількості на зовнішньому електронному шарі і б) з віддаленням зовнішнього електронного шару від ядра атома. В обох випадках це зв'язано із збільшенням розмірів атома. Як правило, атоми металів мають великі атомні радіуси. У періодах найбільші радіуси мають атоми лужних металів (чому?).
Металічний зв'язок. Це особливий тип хімічного зв'язку, властивий лише металам та їхнім сплавам. Суть його полягає в тому, що атоми металів постійно віддають електрони, які переміщуються по всій масі шматка металу (мал. 9).
Мал
9.
утворення металічного зв'язку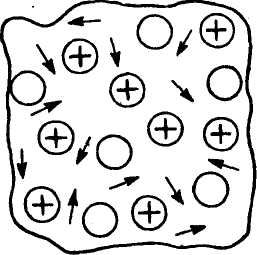
Металічний зв'язок характерний ще і для інтерметалідів–хімічних сполук двох або кількох металів.
Фізичні властивості. Метали мають подібні фізичні властивості, за якими їх відрізняють від неметалів, і однаковий агрегатний стан. Так, за звичайних умов всі метали (за винятком ртуті) –тверді кристалічні речовини.
Блиск. Для більшості металів характерним є металічний блиск. У вигляді порошку метали тьмяніють, за винятком магнію та алюмінію. Саме тому алюмінієвий порошок використовують для виготовлення «срібної» фарби.
Забарвлення. Більшість металів мають сріблясто-біле забарвлення (алюміній, срібло, нікель) або сріблясто-сіре (залізо, свинець). Винятком є золото –метал жовтого кольору і мідь –рожево-червоного. За забарвленням метали умовно поділяють на чорні й кольорові. До чорних металів найчастіше відносять залізо та його сплави (чавун, сталь). Усі інші метали називають кольоровими.
Електрична провідність. Це найважливіша властивість металів. Вона зумовлена наявністю рухливих електронів у кристалічній решітці металів. За звичайних умов найкращу електричну провідність має срібло, на другому місці – мідь, далі –алюміній. З усіх металів лише германій Ge є напівпровідником. За електричною провідністю він посідає проміжне місце між провідниками і діелектриками (ізоляторами). Метали з високою електричною провідністю мають і високу теплопровідність, яка також пояснюється можливістю переміщення електронів.
Температура плавлення. У металів вона змінюється у великих інтервалах: найвища –у вольфраму (3380 °С) найнижча –у ртуті (-30 °С). Температура плавлення інших металів лежить у цих межах. Звичайно метали з температурою плавлення нижче 1000 °С (ртуть, натрій, магній, алюміній) називають легкоплавкими, понад 1000 °С (мідь, залізо, хром, титан, молібден) – тугоплавкими.
Твердість. Метали мають різну твердість, її порівнюють із твердістю алмазу. Найтвердішими з металів є хром і вольфрам. М'якими є лужні метали. Натрій, калій, наприклад, легко ріжуться ножем.
Пластичність. Метали більшою або меншою мірою пластичні, їх можна кувати. Найпластичнішим металом є золото. З нього можна викувати фольгу (тонкий лист) завтовшки 0,0001 мм, що у 500 разів тонше людської волосини! А от стибій Sb –дуже крихкий метал, його можна розтерти на порошок у порцеляновій ступці.
Пластичність (від грец. plastikos – придатний для ліплення, податливий) –здатність металів необоротно деформуватись під дією механічних навантажень.
Пластична деформація пояснюється розривом деяких міжатомних зв'язків і утворенням нових. Вона залежить, в основному, від міцності металічного зв'язку. Цю властивість металів використовують, коли їх прокатують, пресують, штампують, кують.
Розчинність. Усі метали не розчинні у воді, але розчиняються один в одному у розплавах. Твердий розчин одного металу в іншому називають сплавом.
Густина. За густиною метали поділяють на легкі (густина менша 5 г/см3) і важкі (густина понад 5 г/см3). Типові легкі метали – літій, натрій, магній, алюміній. До важких металів належить цинк, залізо, мідь, свинець, ртуть, золото. Найважчим із металів є осмій Os (22,6 г/см3), його густина найбільша.
Завдання для самоконтролю
Яке місце у періодичній системі посідають метали? Чому?
Як виникає металічний зв'язок? У чому полягає його суть?
Що спільного у металічного зв'язку з ковалентним та йонним і чим він від них відрізняється?
Чим можна пояснити невелику електронегативність металів?
До металів не належить послідовність елементів
Са, Zn, Cd; (3) В, As, Те;
Ga, In, ТІ; (4) W, Bi, Os.
137. Назвіть метали:
найважчий ... і найлегший ...;
найбільш легкоплавкий ... і найбільш тугоплавкий ...;
найм'якший ... і найтвердіший ... .
138*. Чому з підвищенням температури електрична провідність металів знижується?
