
- •Гомологічний ряд, номенклатура і фізичні властивості насичених альдегідів
- •Альдегіди CnH2nO
- •Хімічні властивості альдегідів
- •Гомологічний ряд, номенклатура і фізичні властивості насичених кетонів
- •Кетони (CnH2nO)
- •Хімічні властивості кетонів
- •Насичені одноосновні карбонові кислоти
- •Складні естери
- •Аміди карбонових кислот r–co–nh2
- •Нітрили карбонових кислот r–c≡n
- •Сульфокислоти r–so3h
- •Нітросполуки r–no2
- •Якісні реакції на окремі класи органічних сполук
Насичені одноосновні карбонові кислоти
Загальна формула – CnH2n+1COOH
Окремі представники
|
Фізіологічна дія Пари мурашиної кислоти подразнюють слизову оболонку. ГДК = 1мг/м3. Оцтова килота при с2% небезпечна для очей. Деревний оцет може викликати екземи. ГДК = 5мг/м3. Концентровані кислоти викликають болючі опіки на шкірі. |
Способи одержання (на прикладі оцтової кислоти)
а) окиснення спирту під дією біологічних ферментів: CH3–CH2–OH + O2 →CH3COOH + H2O б) пряме окиснення бутану: 2C4H10 + 5O2 → 4CH3COOH + H2O в) з ацетилену по реакції Кучерова добувають оцтовий альдегід, який окиснюють до кислоти г) реакція оксосинтезу: суха перегонка деревини (нагрівання без доступу повітря) |
Фізичні властивості В ряду насичених одноосновних карбонових кислот немає газоподібних речовин. Інші члени ряду (С1–С15) – рідини з гострим запахом, вищі кислоти – тверді речовини без запаху. Зі збільшенням молекулярної маси розчинність кислот і воді зменшується. |
ІІ. Лабораторні методи: а) З хлор метану за допомогою ціаніду калію: CH3Cl + KCN → CH3–CN + KCl; CH3–CN + 2H2O → CH3COOH +NH3↑ б) З металоорганічних сполук: CH3Li + CO2 → CH3COOLi; CH3COOLi + HCl → CH3COOH + LiCl в) За допомогою реактивів Гріньяра: R–MgBr + CO2 → R–COOMgBr; R–COOMgBr + H2O → R–COOH + Mg(OH)Br г) Гідроліз нітрилів: R–C≡N + 2H2O → R–COOH + NH3↑ |
|
Якісні реакції
а) під дією KmnO4 окислюється до вугільної кислоти б) Взаємодіє з аміачним розчином оксиду срібла (реакція срібного дзеркала): НСООН + 2[Ag(NH3)2)OH → HCOONH4 + 2Ag↓ + 3NH3↑ + H2O
|
||
Хімічні властивості насичених одноосновних карбонових кислот |
|
Загальні 1. Утворення солей: 2CH3COOH + 2Na → 2CH3COONa + H2↑; 2CH3COOH + CaO → (CH3COO)2Ca + H2O; CH3COOH +NaOH → CH3COONa + H2O; 2. Утворення ефірів: CH3COOH + R–OH → CH3COOR + H2O 3. Утворення ангідридів та хлорангідридів: CH3COOH + PCl5 → CH3COOCl + POCl + HCl; CH3COONa + CH3–(C=O)–Cl → (CH3–(C=O)–)2O 4. Взаємодія з галогенами: CH3COOH + Cl2 → CH2ClCOOH + HCl 5. Взаємодія з аміаком: CH3COOH + NH3 → CH3COONH4; CH3COONH4 + t oC → CH3–(C=O)–NH2 6. Відновлення: CH3COOH + LiAlH4 → CH3–CH2–OH |
Специфічні Мурашина кислота містить в своєму складі і альдегідну і карбоксильну групу. Тому вона має деякі специфічні властивості, зокрема є добрим відновником: HCOOH + Cu(OH)2 → HO–(C=O)–OH + Cu2O + H2O; HO–(C=O)–OH ↔ CO2↑ + H2O; HCOOH + 2[Ag(NH3)2]OH → H–CO–O–NH4 + 2Ag + 3NH3↑ + H2O; HCOOH + t oC + H2SO4 → CO + H2O
|
Двохосновні карбонові кислоти.
Радикали Загальна формула CnH2n(COOH)2 – це формула насичених двохосновних карбонових кислот. Найпростішим представником цього ряду є щавелева кислота НООС–СООН, найближчий її гомолог малонова кислота HOOC–CH2–COOH, в якої карбоксильні групи розділені групою –CH2–. Продовжуючи послідовно ланцюг на групу –CH2– можна отримати ряд двохосновних кислот, наприклад: HOCO–(CH2)2–COOH – янтарна (бутадіонова) кислота HOCO–(CH2)3–COOH – глутарова (пентадіонова) кислота HOCO–(CH2)4–COOH – адипінова (гексадіонова) кислота HOCO–(CH2)5–COOH – пімелінова (гептадіонова) кислота HOCO–(CH2)6–COOH – пробкова (октадіонова) кислота HOCO–(CH2)7–COOH – селезіанова (нонадіонова) кислота HOCO–(CH2)8–COOH – себацинова (декандіонова) кислота |
Дія на організм людини. Карбонові кислоти діють на організм людини тим сильніше, чим вища константа їхньої дисоціації. Токсичність ангідридів, галоген ангідридів органічних кислот також пов'язана з утворенням на вологих слизових оболонках кислот, які сильно подразнюють тканин. Щавелева кислота викликає тяжкі отруєння при вдиханні або ковтанні пороху. В тяжких випадках може викликати послаблення серцевої діяльності і судороги. ГДК = 1мг/м3 |
Способи одержання. Загальні методи одержання двохосновних кислот, аналогічні способам одержання одноосновних карбонових кислот. Наприклад:
|
Фізичні властивості Двохосновні кислоти – це безбарвні кристалічні речовини, розчинні у воді. В змінах температур їх плавлення в гомологічному ряді, як і в випадку одноосновних спостерігається певна періодична закономірність. Температура плавлення кислот з парним числом вуглецевих атомів вища температур плавлення сусідніх кислот з непарним числом вуглецевих атомів. Наприклад: адипінова кислота (СН2)4(СООН)2 має Тпл = 153 оС, а глутарова (СН2)3(СООН)2 має Тпл = 97,5 оС. |
||
Якісні реакції
2. AgNO3 утворює білий осад погано розчинної срібної солі: Ag–OOC–COO–Ag↓ + 2HNO3 |
||
Хімічні властивості двохосновних карбонових кислот
HOOC–COOH → HCOOH + CO2↑ HOOC–CH2–COOH → CH3–COOH + CO2↑ HOOC–CRR'–COOH → (R–)(R'–)CH–COOH +CO2↑ 2. Утворення складних етерів: HOOC–COOH + 2ROH → ROOC–COOR + 2H2O 3. Утворення циклічних ангідридів: HOOC–(CH2)2–COOH → OOC–(CH2)2– COO
O
|
4. Піроліз кальцієвих або барієвих солей адипінової, пілемінової і пробкової кислот: O // H2C–CH2–C–O H2C–CH2 | Ca → CaCO3 + | C=O H2C–CH2–C–O H3C–CH2 \\
Сіль адипінової кислоти Циклопентенон O //
CH2–CH2–C–O CH2–CH2
O Сіль пімелінової кислоти Циклогексанон |
Похідні карбонових кислот. Ангідриди.
Ангідриди карбонових кислот Можна роглядати як продукт міжмолекулярного відщеплення води від двох молекул карбонових кислот за рахунок гідроксилів їх карбоксильних груп |
Способи добування 1 При взаємодії солей карбонових кислот з галоген ангідридами: R–(C=O)–Na + R–(C=O)–Cl → R–(C=O)–O–(C=O)–R + NaCl 2. Прямою дегідратацією (в кислому середовищі): R–(C=O)–OH → R–(C=O)–O–(C=O)–R + H2O |
Загальна формула R–(C=O)–O–(C=O)–R, або (R–(C=O)–)2O |
Хімічні властивості 1. Реакція гідролізу: (R–(C=O)–)2O + H2O + H+ → 2R–(C=O)–OH 2. Реакція алкоголізу: (R–(C=O)–)2O + R'OH +H+ → R–(C=O)–O–R' + R–(C=O)–OH 3. Реакція амонолізу: (R–(C=O)–)2O + 2NH3 → R–(C=O)–NH2 + R–(C=O)–O–NH4 |
Фізичні властивості Ангідриди нижчих карбонових кислот мають гострий запах. Ангідриди вищих карбонових кислот – кристалічні речовини без запаху. |
|
Застосування За хімічними властивостями ангідриди виступають як гарні ациліруючі реагенти. |
Похідні карбонових кислот. Галогенангідриди.
Представники – Хлорангідрид мурашиної кислоти (хлористий форміл) – Хлорангідрид оцтової кислоти (хлористий ацетил) – Хлорангідрид пропіонової кислоти (хлористий пропіоніл) |
Дія на організм людини Галоген заміщені аліфатичні кислоти проявляють значно більшу токсичність і припікаючи дію, а також подразнюючу дію. Так наприклад трифтороцтова кислота викликає дистрофічні зміни в легенях, печінці, мозку тварин.
Має подразнюючу і припікаючи дію. ГДК = 2мг/м3. Для хлороцтової кислоти ГДК = 1мг/м3 |
Способи одержання 1. Взаємодія карбонових кислот з фосфор галогені дами: RCOOH + PCl5 → RCOCl + POCl3 + HCl 2. Взаємодія карбонових кислот з SOCl2: RCOOH + SOCl2 → RCOCl +SO2 + HCl |
Фізичні властивості Із галоген ангідридів важливе значення мають хлорангідриди. Нижчі хлорангідриди являють собою безбарвні леткі рідини з різким запахом, подразнюють слизові оболонки; вищі хлорангідриди – безбарні кристалічні речовини. Наприклад хлористий ацетил – легко кипляча рідина з Ткип= 52оС |
Хімічні властивості 1. Реакція гідролізу: RCOCl + HOH → RCOOH + HCl 2. Реакція алкоголізу: RCOCl + R'–OH → R–(C=O)–O–R' + HCl 3. Реакція амоналізу: RCOCl + NH3 → RCONH2 + HCl |











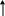 1.
Реакції декарбоксилювання:
1.
Реакції декарбоксилювання:
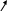 O
O
 CH2–CH2–C–O
CH2–CH2
CH2–CH2–C–O
CH2–CH2 H2C
Ca → CaCO3
+ CH2
C=O
H2C
Ca → CaCO3
+ CH2
C=O
 \\
\\