
- •Б2.В.2 аналитическая химия
- •Б2.В.3 аналитическая химия
- •1. Анализ сухой соли
- •2. Гравиметрический анализ
- •Контрольные задания
- •3. Динамическое равновесие в гетерогенных системах. Произведение растворимости
- •Контрольные задания
- •4. Приготовление растворов заданной концентрации
- •Контрольные задания
- •5. Расчеты в титриметрических методах анализа. Закон эквивалентов
- •Способы выполнения титриметрического анализа
- •Контрольные задания
- •6. Жесткость воды
- •Контрольные задания
- •7. Вычисление рН в водных растворах электролитов
- •Контрольные задания
- •8. Построение кривых титрования в методе нейтрализации
- •Контрольные задания
- •9. Окислительно-восстановительные реакции.
- •Приложения
Контрольные задания
Вычислите рН растворов для построения кривой титрования без учета разбавления при следующих объемах рабочего раствора:
0,0; 50,00; 99,00; 99,90; 100,00; 100,10; 101,00; 110,00 см3. Объем аликвотной части раствора определяемого вещества примите равным 100см3. Постройте кривую титрования и подберите три индикатора.
№ задания |
Определяемое вещество |
Рабочее вещество |
Концентрация растворов С(ОВ)=С(РВ) моль/дм3 |
1. |
HCl |
NaOH |
0,0100 |
2. |
NH4OH |
HNO3 |
0,0500 |
3. |
CH3COOH |
NaOH |
0,1000 |
4. |
C6H5COOH |
KOH |
0,0200 |
5. |
NH4OH |
CH3COOH |
0,1000 |
6. |
HNO2 |
KOH |
0,0100 |
7. |
LiOH |
HCl |
0,0100 |
8. |
HCl |
NH4OH |
0,1000 |
9. |
NaOH |
HNO3 |
0,0500 |
10. |
KOH |
HI |
0,0100 |
11. |
НСООН |
КОН |
0,1000 |
12. |
С6Н5СООН |
NaOH |
0,3000 |
13. |
HF |
NaOH |
0,1000 |
14. |
NH4OH |
HCl |
0,0500 |
15. |
KOH |
CH3COOH |
0,1000 |
16. |
NH4OH |
HBr |
0,3000 |
17. |
HNO2 |
NaOH |
0,0100 |
18. |
LiOH |
C6H5COOH |
0,0500 |
19. |
HCl |
КОН |
0,1000 |
20. |
NaOH |
НСООН |
0,0100 |
9. Окислительно-восстановительные реакции.
В редоксометрии используются реакции окисления – восстановления, связанные с переходом электронов от одного иона (молекулы) к другому.
Окислитель – вещество, атомы которого принимают электроны, превращается в ионы с более низкой степенью окисления (процесс восстановления).
Восстановитель – вещество, атомы которого отдают электроны, превращается в ионы с более высокой степенью окисления (процесс окисления). Следует говорить не об отдельном окислителе или восстановителе, а об окислительно-восстановительных системах:
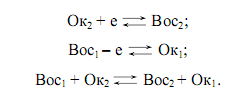
Для того чтобы в приведенных схемах реакция протекала слева направо, необходимо, чтобы Boc1 был более сильным восстановителем, чем образованная из Ок2 его сопряженная форма Вос2. Согласно всему сказанному Oк1/Boc1, Ок2/Вoc2, являются соответственно окислительно-восстановительными системами.
Представить направление окислительно-восстановительной реакции можно, только зная количественную характеристику относительной силы окислительно-восстановительной системы. Такой характеристикой является величина окислительно-восстановительного потенциала.
Значение окислительно-восстановительного потенциала зависит от величины стандартного окислительно-восстановительного потенциала Е° концентрации и реакции среды. Эта зависимость выражается уравнением Нернста:
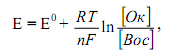
где Е0 – стандартный окислительно-восстановительный потенциал; R – газовая постоянная (8,313 дж/(моль· К); Т – абсолютная температура, К; F – число Фарадея (96 500 кулон/г-экв); n – число электронов (теряемых или получаемых).
Если подставить числовые значения констант и от натурального перейти к десятичному, то для комнатной температуры (20 ºС) получим:
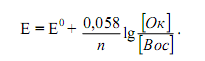
Пример 1. Составить уравнение реакции между перманганат-ионом и пероксидом водорода в кислой среде электронно-ионным методом.
Решени.
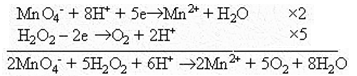
Пример 2. Можно ли в кислой среде действием дихромата калия окислить: а) Fe2+ до Fe3+; б) Mn2+ до MnO4-?
Решение. Для решения вопроса необходимо сравнить стандартные окислительно-восстановительные потенциалы окислительно-восстановительных систем. Более сильным окислителем будет окисленная форма той системы стандартный окислительно-восстановительный потенциал, которой больше.
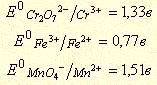
Потенциал системы Cr2O72-/Cr3+, больше, чем потенциал системы Fe3+/Fe2+ и меньше, чем потенциал системы MnO4-/Mn2+, следовательно, Fe2+ можно окислить до Fe3+ действием дихромата калия, а Mn2+ до MnO4- не окисляется.
Контрольные задания.
Задание 1. Расставить коэффициенты в уравнениях окислительно-восстановительных реакций методом полуреакций. Определить молярную массу эквивалента окислителя и восстановителя в реакциях:
1. КМnО4 + HNO2 + H2SO4 →
2. Na2SO3 + Na2Cr2О7 +Н2SO4 →
3. КМnО4 + HNO2 + КОН →
4. KIO3 + KI + HCl → I2 + ….
5. K2S + K2MnO4 + H2O → S +
6. Zn + HNO3 → NH4NO3 + …
7. K2Cr2O7 + Na2SO3 + H2SO4 → ….
8. KMnO4 + Cr2(SO4)3 + KOH → CrO4 2-+ MnO2 + …
9. K2Cr2O7 + H2SO4 + NaNO2 →
10. K2CrO4 +HCl = Cl2 + Cr3 ++ …
11. MnO2 + KClO3 + KOH
12. CrCl3 + KMnO4 + H2O
13. Mn(NO3)2 + NaBiO3 + HNO3
14. KMnO4 + KJ + H2SO4
15. KBrO3 + KBr + HCl
16. KMnO4 + FeCl2 + HCl
17. K2Cr2O7 + H2S + H2SO4 S +
18. K2Cr2O7 + KJ + H2SO4
19. FeSO4 + K2Cr2O7 + H2SO4
20. MnSO4 + PbO2 + HNO3 HMnO4 +
Задание 2.
1. На окисление 25 мл 0,02н раствора соли Мора требуется 40 мл раствора перманганата калия. Определите эквивалентную концентрацию и титр раствора перманганата калия.
2. Какой объем 0,02н раствора перманганата калия требуется для окисления 0,1 моль-экв соли Мора? Составьте уравнение реакции, протекающей при данном случае титрования.
3. Рассчитайте молярную концентрацию эквивалентов раствора перманганата калия и титр перманганата калия по железу, если на титрование навески 0,1228 г химически чистой щавелевой кислоты H2C2O4∙ 2H2O расходуется 30,0 мл раствора перманганата калия.
4. Рассчитайте молярную концентрацию эквивалентов рабочего раствора перманганата калия и его титр, если на титрование 10 мл этого раствора израсходовано 9,5 мл 0,1514н раствора щавелевой кислоты.
5. Навеска 2,440 г технического сульфита натрия растворена в мерной колбе емкостью 250 мл. К 25 мл этого раствора добавили 50 мл 0,1н раствора йода, избыток которого оттитровали 30 мл 0,1н раствора тиосульфата натрия. Найдите массовую долю сульфита натрия в образце.
6. Определите молярную концентрацию эквивалентов раствора йода и его титр, если на титрование 23 мл йода пошло 10,67 мл 0,056н раствора тиосульфата натрия.
7. Определите молярную концентрацию эквивалентов и титр раствора перманганата калия, если 38,5 г перманганата калия растворили в колбе и довели объем до 250 мл (среда кислая).
8. Какой объем 0,02 н раствора перманганата калия достаточен для окисления 0,112 г железа, содержащегося в соли Мора?
9. Рассчитайте молярную концентрацию эквивалентов перекиси водорода, если на титрование 9.5 мл раствора израсходовано 15 мл 0,13н раствора KMnO4. Составьте соответствующее уравнение реакции.
10. Рассчитайте молярную концентрацию эквивалентов и титр перманганата калия, если на титрование 0,1 моль-экв раствора щавелевой кислоты израсходовано 15 мл раствора KMnO4. Составьте уравнение соответствующей реакции.
11. 2,5 г пероксида водород разбавили водой до 200 мл. На титрование 5,0 мл полученного раствора в кислой среде пошло 20 мл 0,05 н. раствора калия перманганата. Какова массовая доля Н2О2 в исходном концентрированном растворе?
12. На титрование 25 мл 0,05 н. раствора KМnO4 в кислой среде пошло 10,2 мл раствора натрия нитрита. Вычислите массу натрия нитрита, содержащегося в 100 мл раствора.
13. Определить массовую долю олова (II) в бронзе, если на титрование раствора, полученного из 0,8245 г бронзы, израсходовано 12,75 мл 0,05 н раствора иода.
14. К 25,0 мл бромной воды прибавили избыток раствора иодида калия. На титрование выделившегося йода израсходовано 20,00 мл 0,1 н раствора Na2S2O3 . Определить содержание Br2 в 1 литре бромной воды.
15. Вычислить содержание С12 в 1 литре хлорной воды, если к 25,0 мл хлорной воды прибавили раствор иодида калия и на титрование выделившегося иода израсходовали 20,00 мл 0,05 н раствора Na2S2O3.
16. Вычислить %-ное содержание воды в кристаллогидрате H2C2O4·хH2O, если известно, что на титрование навески щавелевой кислоты массой 0,0342 г израсходовано 15,40 мл 0,035 н раствора КМnO4.
17. Навеску сплава растворили без доступа воздуха в серной кислоте. Образовавшуюся соль FeSO4 оттитровали 13,40 мл раствора KBrO3 с титром 0,002783 г/мл. Сколько граммов железа (II) содержалось в навеске сплава?
18. Вычислить молярную концентрацию эквивалента раствора KMnO4, если на титрование навески соли FeSO4 массой 0,1000 г, содержащей 0,1% индифферентных примесей, израсходовано 14,50 мл раствора KMnO4. Титрование вели в сернокислой среде.
19. Определить %-ное содержание воды в кристаллогидрате соли Мора (NH4)2Fe(SO4)2·хH2O, если на титрование навески массой 0,4250 г затрачено 25,50 мл 0,05 н раствора KMnO4?
20. Вычислить массовую долю (%) серы в стали, если сера из навески образца в 3,1640 г после соответствующей обработки превращена в H2S, который окислили 5,0 мл 0,0352 н раствора J2, а избыток последнего оттитровали 3,84 мл 0,05 н раствора Na2S2O3.
