
- •Розділ VIII Основи молекулярно-кінетичної теорії газів
- •Предмет та методи молекулярної фізики
- •Вимірювання швидкостей молекул
- •Температура. Термодинамічна рівновага.
- •Основні положення молекулярно-кінетичної теорії газів
- •Розподіл Максвелла.
- •Розподіл Больцмана. Барометрична формула
- •Ідеальний газ. Основне рівняння кінетичної теорії газів
- •Основні газові закони. Ізопроцеси
- •1. Закон Дальтона.
- •2. Об’єднаний газовий закон.
- •3. Ізотермічний процес. Закон Бойля-Маріотта.
- •4. Ізобарний процес. Закон Гей-Люссака.
- •5. Ізохорний процес. Закон Шарля.
- •6. Закон Авогадро.
- •§48. Рівняння Клапейрона
- •Середня квадратична швидкість молекул. Стала Больцмана та кінетична енергія однієї молекули
Основні газові закони. Ізопроцеси
Із основного рівняння молекулярно-кінетичної теорії газів можна одержати всі газові закони, які було встановлено експериментально ще у XVIII столітті.
1. Закон Дальтона.
Згідно з основним рівнянням молекулярно-кінетичної теорії (46.10),
P
=
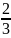 n
n . (47.1)
. (47.1)
Концентрація молекул суміші газів
дорівнює сумі концентрацій молекул
газів, що входять до даної суміші
(загальна концентрація молекул дорівнює
сумі концентрацій молекул кожного
газу): n
=
 +
+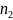 +
+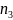 +
+
 +
+
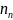 (47.2)
(47.2)
де
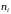 – концентрація молекул і-того газу.
– концентрація молекул і-того газу.
Якщо температура всіх газів суміші однакова, то середні кінетичні енергії всіх молекул однакові:
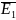 =
= =
=
 =
=
 =
=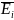 =
=
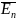 .
(47.3)
.
(47.3)
Підставивши у (18.1) замість n його значення (47.2) і врахувавши (47.3), одержимо:
P =
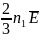 +
+
 +
+
+
+
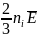 +
+

 = P1
+ P2
+ P3
+
+ Pn
(47.4)
= P1
+ P2
+ P3
+
+ Pn
(47.4)
Отже, тиск суміші газів дорівнює сумі парціальних тисків. Парціальним тиском називається тиск, який би створив кожний газ, що входить в суміш, окремо за умови, що він сам займає той об’єм, який займає суміш газів.
Формула (48.4) є математичною формою запису закону Дальтона.
2. Об’єднаний газовий закон.
Запишемо основне рівняння м.к.т. газів у вигляді:
PV
=
 N
N =
N
=
N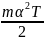 (47.5)
(47.5)
Тут квадрат середньої квадратичної
швидкості
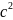 замінено виразом
замінено виразом
 ,
де a – коефіцієнт
пропорційності. Така заміна правомірна,
бо, згідно з основними положеннями
м.к.т., середні швидкості теплового руху
молекул пропорційні кореню квадратному
із абсолютної температури: c
=
,
де a – коефіцієнт
пропорційності. Така заміна правомірна,
бо, згідно з основними положеннями
м.к.т., середні швидкості теплового руху
молекул пропорційні кореню квадратному
із абсолютної температури: c
=
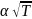 ,
,
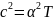 .
Отже,
.
Отже,
PV = N . (47.6)
Якщо маса газу залишається сталою, то і кількість молекул N = const. Таким чином, у правій частині рівняння (47.6) всі величини є сталими, крім температури. Тому рівняння (47.6) можна записати у вигляді:
PV=const , або
, або
 . (47.7).
. (47.7).
Рівняння (47.7) виражає об’єднаний газовий закон: для даної маси газу добуток тиску газу на його об’єм, поділений на абсолютну температуру, є величина стала.
Рівняння (47.7) можна записати і в такому вигляді:
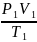 =
= (47.8).
(47.8).
3. Ізотермічний процес. Закон Бойля-Маріотта.
Рис
47.4
 роцес
зміни стану газу, який відбувається за
сталої температури (T
= const),
називається ізотермічним процесом.
Якщо під час термодинамічного процесу
температура залишається сталою, то
рівняння (47.7)
роцес
зміни стану газу, який відбувається за
сталої температури (T
= const),
називається ізотермічним процесом.
Якщо під час термодинамічного процесу
температура залишається сталою, то
рівняння (47.7)
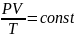 можна записати у вигляді:
можна записати у вигляді:
PV = const. (47.9).
Рівняння (47.9) є математичним виразом закону Бойля-Маріотта: для даної маси газу добуток тиску на його об’єм є величина стала, якщо температура газу залишається сталою.
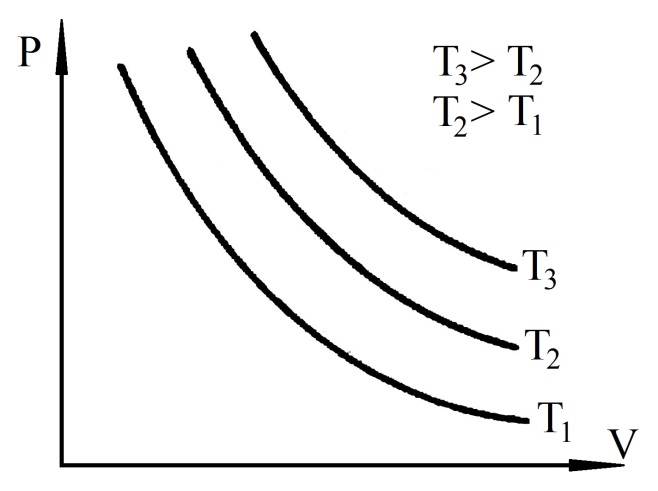
Графічно залежність між тиском і об’ємом показана на рис.47.1. Із (47.9) видно,
що тиск обернено пропорційний об’єму :
P
= .
.
Крива, яка виражає залежність тиску від об’єму за сталої температури, називається ізотермою. На рис. (47.1) зображено три ізотерми даної маси газу, що знаходиться за різних температур Т1, Т2 і Т3. Як видно із рис. 47.1, положення ізотерми в системі координат PV залежить від температури: чим вища температура, тим вище проходить ізотерма.
