
- •Катан Наталія Валеріївна
- •Молекулярні механізми індукції пухлинного росту вітаміном а
- •Завідувач кафедри біохімії
- •Розділ 1. Огляд літератури
- •Цитохром р-450 та метаболізм вітаміну а
- •Вплив вітаміну а на пухлинний ріст
- •Використання ліпосом як транспортних агентів
- •Розділ 2. Матеріали та методи
- •Розділ 3. Результати та їх обговорення Відновлення вітамінних а ресурсів авітамінозного організму із пухлиною дозозалежно модулює темпи росту пухлини
- •Морфологічні параметри пухлинного росту позитивно корелюють з гідроксилазною та деметилазною активностями системи цитохрому
- •Ретиноєва кислота індукує активацію гідроксилазної та деметилазної активностей цитохрому р-450 мікросомальної фракції карциноми Герена
- •Висновки
- •Список використаної літератури
Розділ 3. Результати та їх обговорення Відновлення вітамінних а ресурсів авітамінозного організму із пухлиною дозозалежно модулює темпи росту пухлини
Ретиноїди залучені практично в усі біологічні процеси тваринних організмів, беручи участь в ембріогенезі, репродукції та розвитку тканин, а також в метаболізмі та підтримці гомеостазу [7 30, 31]. Вітамін А та його природні і синтетичні аналоги є необхідними для нормального росту та диференціації клітин [1, 2, 15], виконуючи роль в контролі проліферації та апоптозу нормальних клітин протягом їх росту та розвитку [4]. Водночас по відношенню до пухлинних клітин в низці робіт показана протипухлинна активність ретиноїдів [1, 2, 3, 4, 6, 7, 31]. Однак на сьогоднішній день все частіше знаходить своє експериментальне підтвердження контроверсійна роль ретиноїдів в аспекті їх впливу на проліферацію пухлинних клітин, започаткована результатами дослідження пухлиностимулюючої активності попередників вітаміну А – β-каротину в осіб із раком легенів [8]. Поряд з цим, результатом in vitro досліджень клітинних популяцій різних типів епітелію в умовах супрафізіологічних доз вітаміну А, стало встановлене зниження тривалості латентного періоду трансформації, підвищення частоти виникнення і ступеня злоякісності трансформованих клітин [2].
Враховуючи складний механізм реалізації ретиноїдами своїх біологічних функцій, який включає можливу взаємодію більш ніж 500 генів, які можуть бути мішенями ретиноїдів, різний рівень їх експресії в різних типах клітин [10], то однозначної відповіді щодо молекулярних аспектів їх протипухлинної дії встановити на сьогодні не вдається.
Останнім часом моделями дослідження протипухлинної дії ретиноїдів є використання культур клітин (як нормальних, так і трансформованих ліній) in vitro [31, 51, 52], трансгенних тварин, позбавлених специфічних генів метаболізму кретиноїдів [19, 20, 21], а також імплантація трансформованих клітин і дослідження їх поведінки in vivo [20, 53]. Останній тип моделі дозволяє дослідити особливості росту вже сформованих пухлин в організмі, що експериментально відповідає умовам росту діагностованих на початкових етапах злоякісних новоутворень.
Враховуючи провідну роль ретиноїдів у ключових процесах клітинного метаболізму, ми припустили, що в умовах in vivo пухлина, яка росте в організмі потребує надходження ретиноїдів. Основним місцем локалізації ретиноїдів в організмі є печінка [2, 38], яка екскретує їх (переважно у формі ретинолу) в комплексі із ретиноїдзв’язуючими білками [2, 32], що можна розглядати як метаболічну ланку взаємодії пухлини і організму, яка визначатиме залежність трансформованих клітин від вітамінних А ресурсів організму. Для перевірки висловленого припущення нами було змодельовано авітаміноз в дослідних тварин, яким в подальшому трансплантували пухлинні клітини. Авітаміноз тварин характеризується як морфологічними так і біохімічними ознаками (див. матеріали і методи).
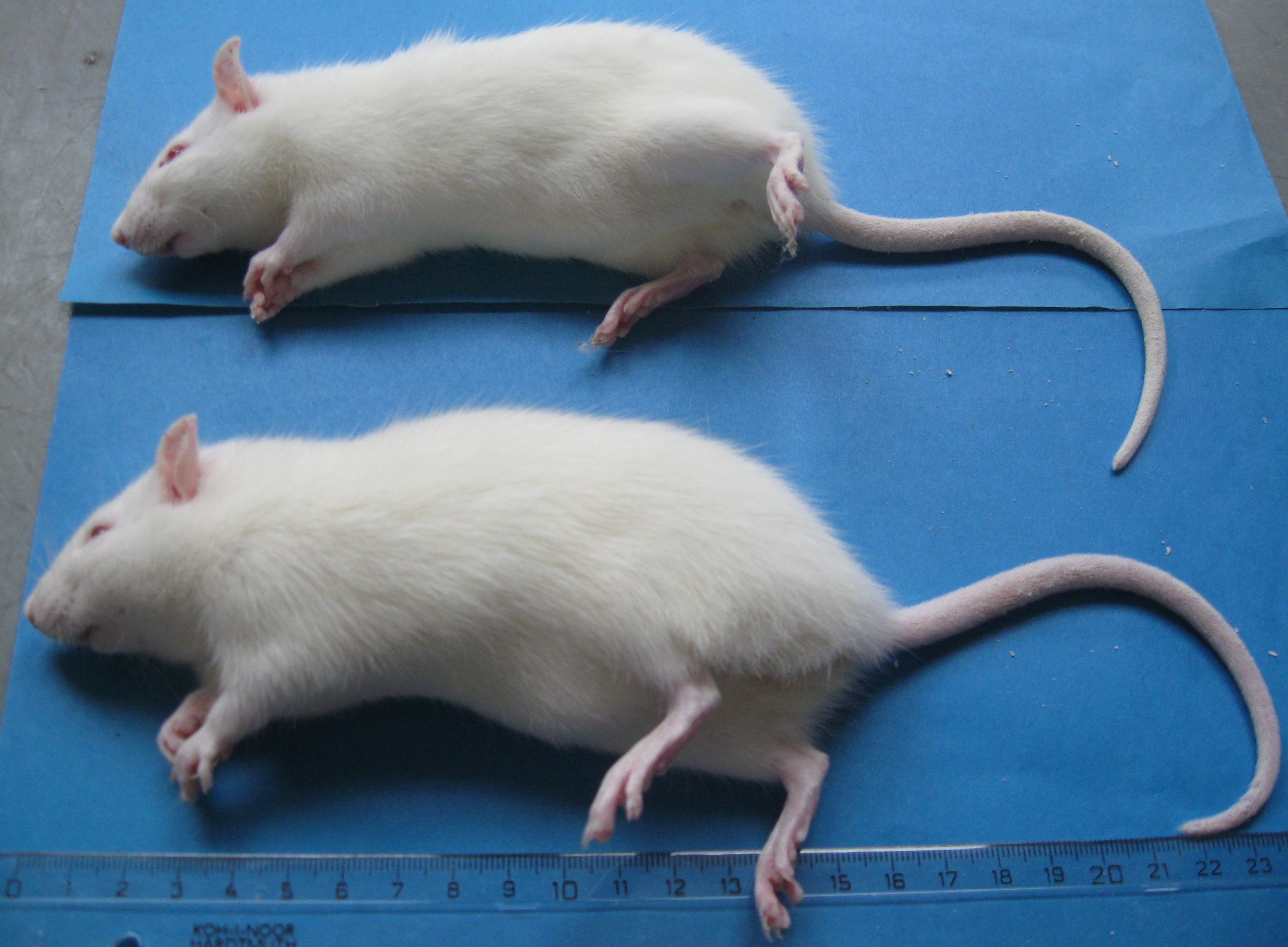
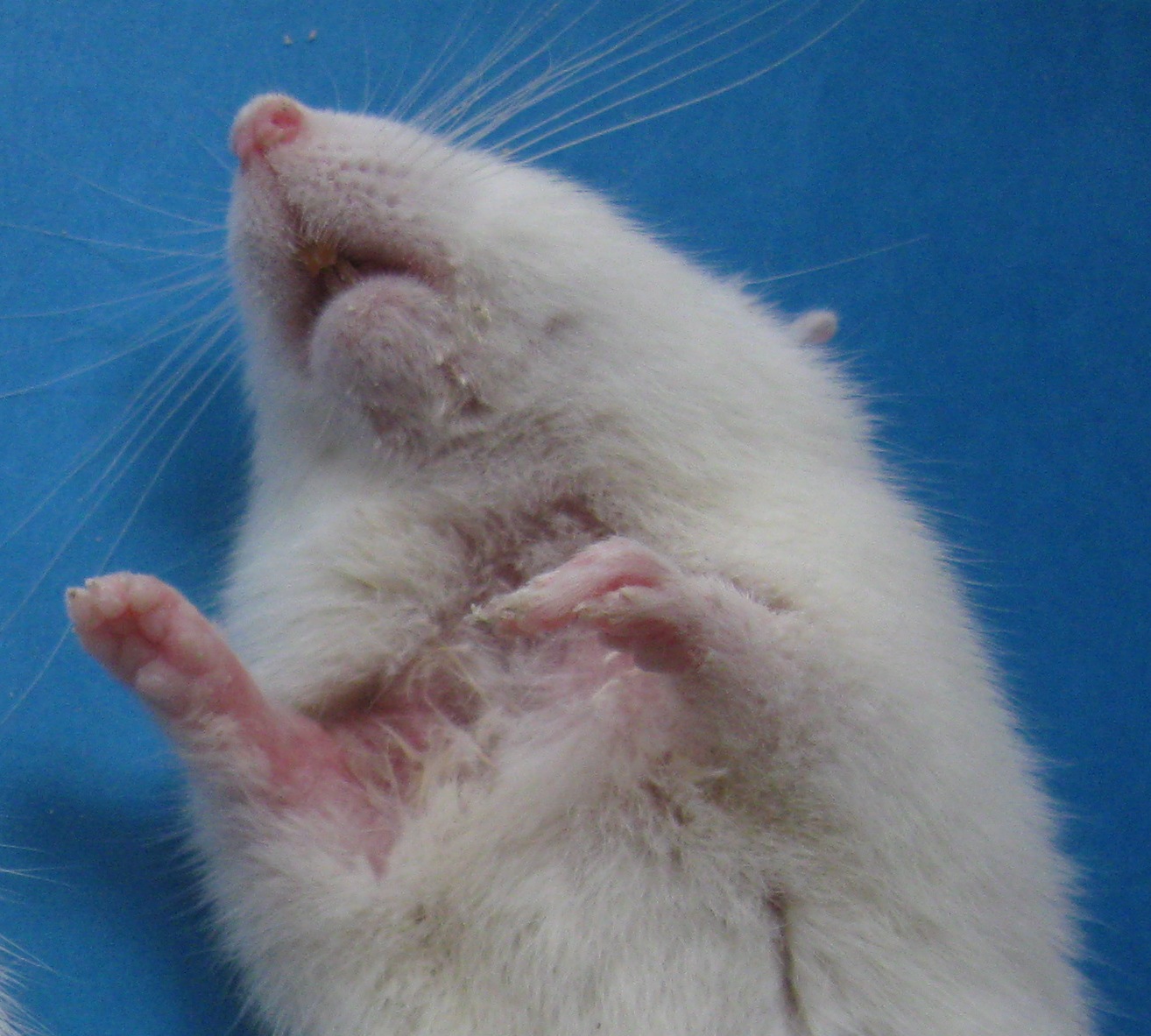
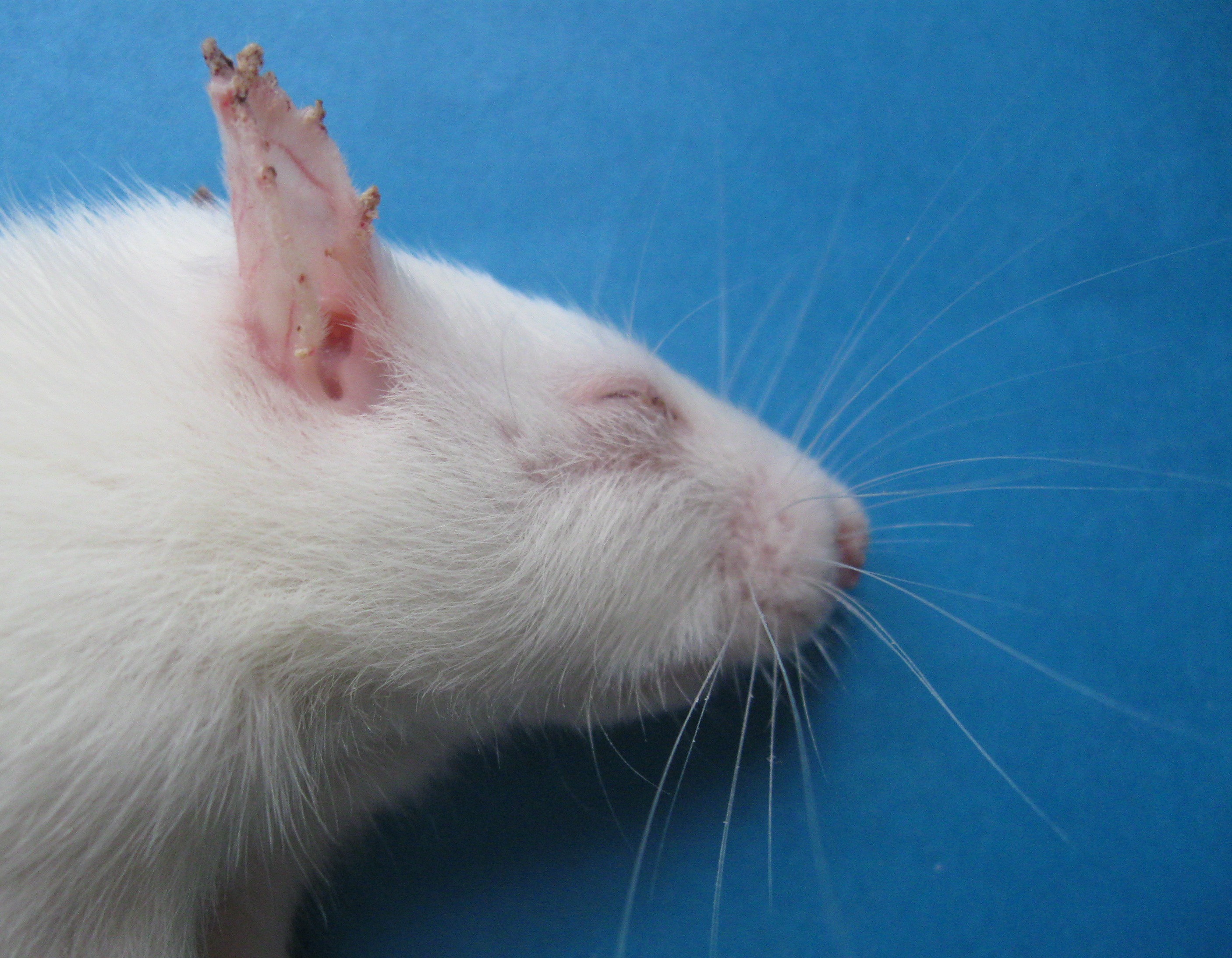
Рис. 3.1. Морфологічні ознаки авітамінозу А у дослідних тварин
а – сповільнення росту, б – зміни шерстяного поктиву, в – ксерофтальмія
Проведені дослідження показали, що ріст карциноми Герена в організмі, позбавленому вітамінних А ресурсів, загальмований, на що вказують показники темпів росту пухлини (рис. 3.2.), а також збільшення тривалості життя дослідних тварин (рис 3.3.).
період
після трансплантації, доба
*
*
*
*
*
*

Рис. 3.2. Темпи росту карциноми Герена
* – с татистично достовірна різниця порівняно з контролем, Р<0,05
Зокрема в логарифмічну стадію росту карциноми Герена величина морфологічних параметрів пухлин тварин, позбавлених вітаміну А, у 2,3 рази менша від показників контрольної групи (рис. 3.2.). Встановлене зниження темпів росту пухлинної тканини можна пояснити відсутністю вітаміна А як антиоксиданта, наявність якого необхідна для елімінації вільних радикалів, утворених в процесі інтенсивного метаболізму пухлинних клітин. Показано, що відсутність вітаміну А в дієті супроводжується зростанням інтенсивності утворення активних форм кисню (АФК) у первинній пухлинній тканині та метастазуючих зачатках, накопиченням продуктів окислення ДНК/РНК (8-гідроксо-2'-дезоксогуанін, 8-гідроксогуанін) та ліпідів (4-гідроксо-2-ноненаль), а також зростання кількості апоптичних клітин [6, 2 ].
період
після трансплантації, доба

Рис. 3.3. Крива виживання тварин з карциномою Герена з різним забезпеченням вітаміном А
Водночас введення до раціону фізіологічних доз вітаміну А зумовлює збільшення пухлинної маси в організмі та відсутність різниці у морфологічних параметрах пухлин в період активного росту карциноми Герена порівняно із контрольною групою (рис. 3.2.). Введення супрафізіологічних доз в організм пухлиноносія супроводжувалося зростанням темпів росту пухлини, розміри та вага якої в досліджуваний період переважали показники контрольної групи відповідно в 3,2 та 1,7 рази (рис. 3.2, рис. 3.4.).
-А/-А
-А/+А
-А/+АА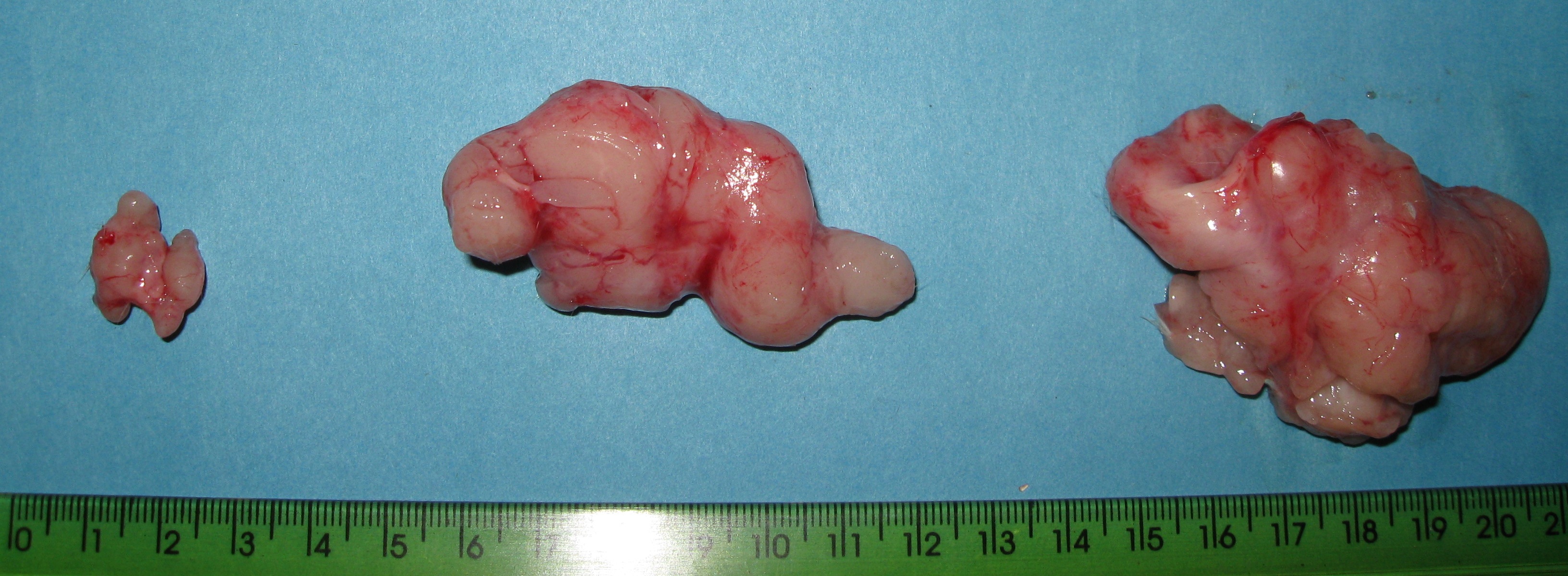
Рис.
3.4. Величина та вага карциноми Герена
тварин із різним забезпеченням вітаміном
А
*
-- статистично достовірна різниця
порівняно з контролем, Р<0,05
*
*

Різниця отриманих морфологічних показників росту карциноми Герена наводить на думку про імовірне переважання проліфераційних процесів (відносно великі розміри пухлинної маси) над ростовими (відносно низька вага), що може вказувати на більший туморогенний потенціал пухлин авітамінозних тварин в умовах їх гіперзабезпечення вітаміном А. Водночас виявлена залежність темпів росту карциноми Герена від забезпеченості вітаміном А носила дозозалежний характер (рис. 3.5.), що вказувало на індукційну (у відношенні збільшення пухлинної маси) роль вітаміну А в авітамінозному організмі з карциномою Герена.
0
МО
30
МО
3000
МО
y
= 0.0008x + 11.856


Рис. 3.5. Залежність показників розміру пухлин та кількістю вітаміну А в експериментальній дієті.
Аналізуючи математично отриману лінійну залежність можна передбачити, що в логарифмічний період росту карциноми Герена результатом збільшення кількості вітаміну А в дієті на кожні 100 МО є приріст пухлинної маси на 1 см3.
