- •Содержание
- •Введение
- •Основная часть обзор литературы
- •1 Гомогенный металлокомплексный катализ
- •Особенности каталитически активных комплексов переходных металлов
- •1.2 Механизм действия металлокомплексного катализатора
- •Основные типы реакций, катализируемых комплексами металлов
- •2.1 Гидрирование
- •2.2 Синтезы с участием оксида углерода.
- •2.3 Полимеризация, димеризация, олигомеризация олефинов и ацетиленов.
- •2.4 Окисление углеводородов в карбонильные соединения и эпоксиды.
- •Заключение
- •Список использованных источников
Особенности каталитически активных комплексов переходных металлов
Металлокомплексный катализ основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла в качестве кофактора.
Выделяют следующие особенности комплексов переходных металлов, определяющих их каталитическую активность [7-8]:
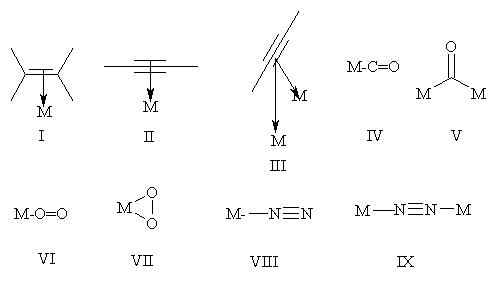
способность образовывать комплексы с молекулами различных типов, которые, входя в координационную сферу металла – комплексообразователя, активируются, что обеспечивает легкость их дальнейшего взаимодействия. Известны, например, комплексы с олефинами (формула I), ацетиленами (II и III), оксидом углерода (IV и V), кислородом (VI и VII), азотом (VIII и IX) и др. (М – атом металла с лигандами);
|
|
|
|
|
I |
II |
III |
IV |
V |
|
|
|
|
|
VI |
VII |
VIII |
IX |
|
образование комплексов с координирующим ионом или атомом металла понижает энергию связи реагирующих молекул субстратов, что уменьшает энергии активации их последующих реакций по сравнению с некоординированными молекулами. Понижение энергии связи при комплексообразовании происходит вследствие частичного переноса электронов со связывающих орбиталей молекул субстратов на свободные орбитали металлов и обратного переноса электрона с заполненных d-орбиталей металла на разрыхляющие (антисвязывающие) орбитали молекул субстратов;
в координационной сфере металла молекулы изменяют свои кислотные или основные свойства и возникает возможность кислотно-основного взаимодействия при тех значениях рН, при которых свободная молекула не реагирует. Например, азот в свободном состоянии является исключительно слабым основанием, а в комплексе типа (R3P)4W(N2)2 становится по основности близким к простым эфирам;
если имеется запрет по симметрии молекулярных орбиталей, препятствующий взаимодействию молекул, то при реакции в координационной сфере металла он может сниматься или значительно ослабляться. Во внутренней сфере процессы, протекающие через переходное состояние, могут быть разрешены и могут протекать с малыми энергиями активации.
а) Окислительное присоединение и обратное ему восстановительное элиминирование молекулы ХУ:

б) Внедрение ненасыщенных соединений по связи М–Х и обратное ему элиминирование:
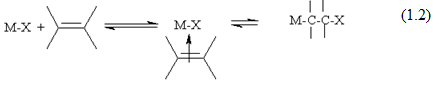
в) обратимое образование металлоцикла из ненасыщенных соединений и карбена в координационной сфере металла.
металлокомплексный катализ позволяет осуществить реакции многоэлектронного окисления и восстановления, в которых молекула субстрата в координационной сфере сразу принимает или отдает несколько электронов. При этом облегчаются процессы, в которых последовательный перенос электронов затруднен из-за термодинамических трудностей одно- или двухэлектронных стадий. Особенно благоприятны условия для таких реакций в случае многоядерных комплексов-кластеров, способных как к одноэлектронному окислению (восстановлению) при взаимодействии с реагентом, так и последующему n-электронному окислению (восстановлению) субстрата.