
- •Лабораторные работы по химии
- •План отчета
- •Экспериментальная часть
- •2. Металлы побочных подгрупп Цель работы
- •Теоретическое введение
- •Экспериментальная часть
- •3. Комплексные соединения Цель работы
- •Теоретическое введение
- •Экспериментальная часть
- •2.2. Диссоциация комплексного соединения
- •2.3. Диссоциация двойной соли
- •3.1. Разрушение комплексного иона
- •3.2. Разрушение комплексного иона
- •Экспериментальная часть
- •5. Кинетика химических реакций Цель работы
- •Теоретическое введение
- •Экспериментальная часть
- •6. Растворы электролитов Цель работы
- •Теоретическое введение
- •Экспериментальная часть
- •Идентификация ионов
- •Некоторые методы количественного анализа
- •Методы титриметрического анализа
- •Экспериментальная часть
- •1. По происхождению:
- •2. По внутреннему строению цепи атомов:
- •3. По химическому составу основной цепи:
- •4. По отношению к нагреванию:
- •Экспериментальная часть
- •Физико-химические свойства полимерных материалов
- •Литература Использованная
- •Рекомендуемая
Идентификация ионов
Ион |
Реагент |
Продукт реакции, качественный признак |
NH4+ |
NаОН(конц.) |
NН3, запах |
K+ |
Nа3[Co(NO2)6] гексанитрокобальтат натрия |
К2Nа [Co(NO2)6], желтый осадок |
Fe2+ |
К3[Fe (СN)6] гексацианоферрат (III) калия |
Fe 3[Fe (СN)6]2, темно-синий осадок |
Cu2+ |
К4[Fe (СN)6] гексацианоферрат (II) калия |
Cu 2[Fe (СN)6] красно-бурый осадок |
Ca2+ |
К2Сr2O7 дихромат калия |
СаСrO4 оранжевый осадок |
Cl- |
AgNO3 + 2 н НNO3 |
AgCl, белый осадок нерастворимый в НNO3 (разб.), растворим в NH4ОН (конц.) |
SO42- |
ВаСl2 |
ВаSO4, белый осадок, нерастворим в кислотах |
В количественном анализе измеряют интенсивность аналитического сигнала (т. е. химические, физические, физико-хими-ческие параметры образца), которая зависит от состава и содержания компонентов в образце.
Методы количественного анализа классифицируют по измеряемым свойствам (аналитический сигнал) (см. табл. 2).
Титриметрический анализ основан на точном измерении объема раствора реактива (называемого рабочим веществом (РВ) или титрантом), затраченного на реакцию с определяемым веществом (ОВ) в процессе титрования.
Титрование – процесс постепенного приливания раствора титранта (РВ) к раствору анализируемого вещества (ОВ) до установления точки эквивалентности (ТЭ). В ТЭ вещества полностью прореагируют между собой. При прямом титровании раствор анализируемого вещества (ОВ) непосредственно титруют раствором РВ. В ТЭ nэк(ОВ) = nэк((РВ), где nэк – количество эквива-лентов.
Таблица 2
Некоторые методы количественного анализа
Измеряемая величина |
Название метода |
Масса |
Гравиметрический |
Объем |
Титриметрический |
Поглощение света окрашенным раствором |
Фотоколориметрический |
Показатель преломления света |
Рефрактометрический |
Тепловой эффект реакции |
Термометрический и калориметрический |
Количество электричества |
Кулонометрический |
Электрическая проводимость |
Кондуктометрический |
Электродный потенциал |
Потенциометрический |
Радиоактивность |
Метод радиоактивных индикаторов |
Основные уравнения для расчетов:
сэк(ОВ) = сэк(РВ).V(РВ)/ V(ОВ), моль/л , (1)
m(ОВ) = сэк(РВ).V(РВ).Мэк(ОВ).Vмк/( V(ОВ).1000), (2)
где Vмк – объем мерной колбы.
Классификация методов титриметрического анализа по типу реакции дана в табл. 3.
Таблица 3
Методы титриметрического анализа
Реакция |
Название метода |
Нейтрализации Н+ + ОН- = Н2О |
Кислотно-основное титрование или метод нейтрализации |
Окислительно-восстановительная Ох + nē Red, Ох – окислитель, Red – восстановитель |
Редоксометрическое титрование |
Осаждения Кt+ + An- = KtAn(т), Кt+ – катион, An- – анион |
Осадительное титрование |
Комплексообразвания Ме2+ + Н2Y2- = MeY2- + 2H+, Н2Y2- – ион комплексона III Ме2+ – катион металла |
Комплексонометрическое титрование |
Опыт 1. Определение содержания H2SO4
В растворе методом нейтрализации
Полученный в мерной колбе анализируемый раствор H2SO4 доводят дистиллированной водой до метки и тщательно перемешивают.
Бюретку промывают водой и ополаскивают раствором H2SO4 для того, чтобы удалить оставшуюся воду. После этого через воронку наливают раствор H2SO4 выше нулевого деления. Оттянутый кончик бюретки заполняют раствором, чтобы в нем не было пузырьков воздуха. Затем вынимают воронку и устанавливают уровень раствора в бюретке на нуле. Из бюретки в три кони-ческие колбы отбирают по 10 мл раствора и добавляют по 2 капли фенолфталеина. Вторую бюретку заполняют раствором титранта NаОН, с = 0,1 моль/л. Раствор H2SO4 в конических колбах титруют при перемешивании раствором NаОН до появления розовой окраски индикатора. Титрование проводят не менее трех раз до получения сходящихся результатов. Различие объемов титранта не должно превышать 0,1 мл. Записывают объемы титранта V1, V2, V3.
При каждом повторном титровании уровень раствора NаОН в бюретке устанавливается на нуле.
В отчете: написать уравнение реакции, указать метод анализа по измеряемой величине и типу реакции, способ фиксирования ТЭ, рассчитать Vср(NаОН) и массу H2SO4 в объеме мерной колбы (см. уравнение 2).
Опыт 2. Определение содержания железа (II)
в растворе соли Мора методом
перманганатометрии
Редоксометрическое титрование основано на реакции окисления-восстановления между титруемым веществом (ОВ) и титрантом (РВ). В зависимости от названия титранта редоксометрическое титрование подразделяется на перманганатометию (КМnО4), дихроматометрию (К2Сr2О7) и иодометрию (I2).
Сущность перманганатометрии: РВ (титрант) – сильный окислитель (КМnО4) сэк = 0,02 моль/л, ОВ – восстановитель (FeSO4). Титрование проводят в сильно кислой среде. При титровании происходит реакция:
МnО4- + 8Н+ + 5ē = Мn 2+ + 4Н2О
Fe2+ = Fe3+ + ē 5

МnО4- + 8Н+ + 5Fe2+ = Мn 2+ + 5Fe3+ + 4Н2О
2 КМnО4 + 8 Н2SO4 + 10 FeSO4 =
= 2 МnSO4 + 5 Fe2(SO4)3 + К2SO4 + 8 Н2О.
В ТЭ nэк(Fe2+) = nэк(МnО4-). Точку эквивалентности ТЭ фиксируют безындикаторным способом до появления бледно-розовой окраски, присущей МnО4-.
Выполнение опыта. Полученный в мерной колбе раствор соли Мора (NH4)2SO4.FeSO4.6H2O доводят дистиллированной водой до метки и тщательно перемешивают. Заполняют бюретки титрантом (КМnО4, сэк = 0,02 моль/л) и раствором соли Мора. Из бюретки с раствором соли Мора в три конические колбы отбирают по 10 мл раствора и в каждую колбу добавляют по 10 мл раствора Н2SO4, сэк = 4 моль/л. Объем кислоты отмеряют мерным цилиндром. Полученный в конической колбе раствор титруют при перемешивании раствором КМnО4 до появления бледно-розовой окраски. При титровании различие объемов титранта не должно превышать 0,1 мл. При каждом повторном титровании уровень раствора в бюретке с КМnО4 устанавливают на нуле.
В отчете написать уравнение реакции, указать метод анализа по измеряемой величине, типу реакции и формуле титранта, способ фиксирования ТЭ, рассчитать Vср КМnО4 ,молярную массу эквивалентов железа Мэк(Fe), массу железа в объеме мерной колбы (см. уравнение (2)).
8. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
И ЭЛЕКТРОЛИЗ
Цель работы
Изучить устройство и процессы, протекающие в работающем гальваническом элементе; изучить сущность процесса электролиза и влияние на процесс состава электролита и материала электродов.
Теоретическое введение
Гальванический элемент (ГЭ) – устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую.
Одним из наиболее простых в изготовлении является ГЭ Якоби-Даниэля. Он состоит из двух стаканов с 1 М растворами ZnSO4 и CuSO4 соответственно. Растворы соединены П-образной трубкой, заполненной насыщенным раствором КСl (электроли-тический ключ). В раствор ZnSO4 опущена цинковая пластина (Zn – электрод), а в раствор CuSO4 – медная (Cu – электрод). Электроды соединены металлическим проводником.
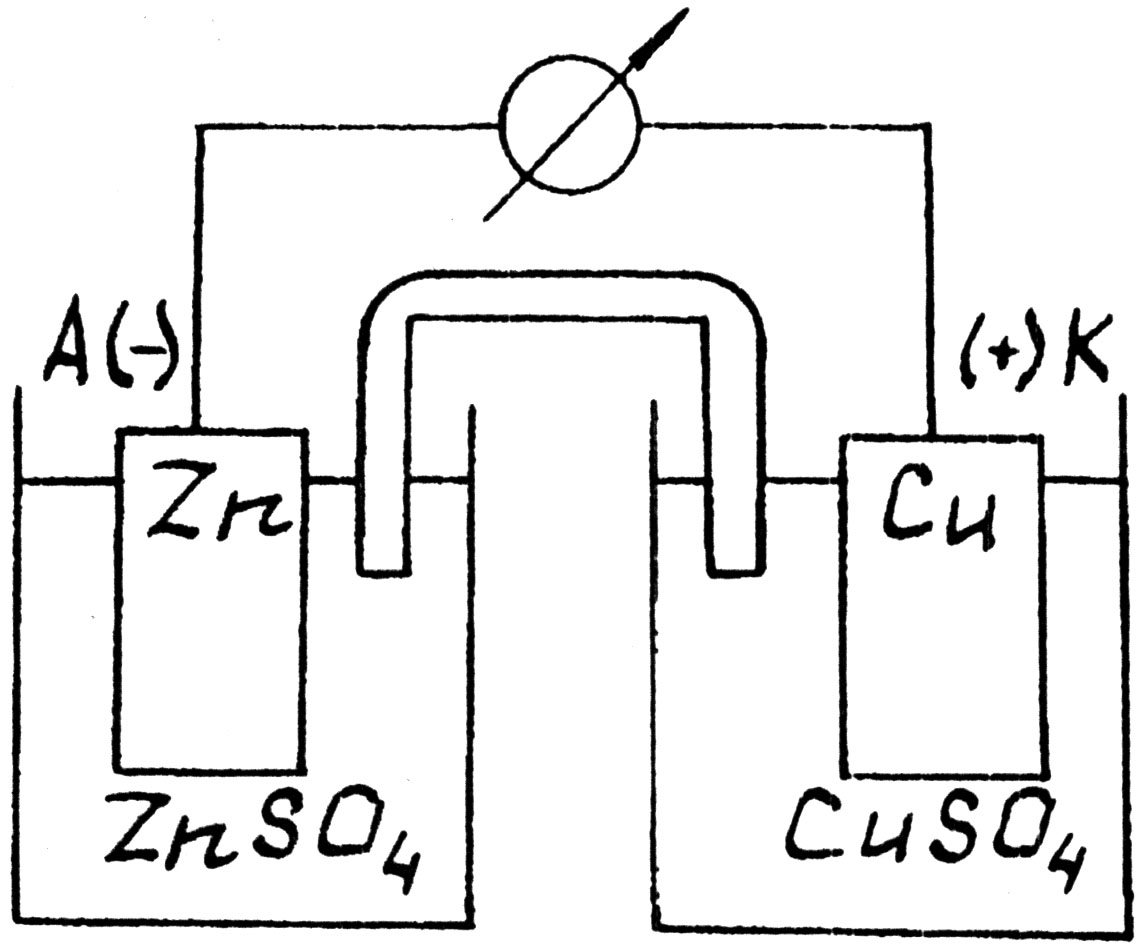
Рис.4. Элемент Якоби-Даниэля
Таким образом, в ГЭ реализуются две цепи: внешняя с электронной проводимостью и внутренняя с ионной проводимостью. Электроны движутся от электрода, имеющего меньшее значение электродного потенциала (он называется анодом), к электроду с большим значением потенциала (он называется катодом); в рассматриваемом примере – от цинка к меди. Устройство ГЭ изображается в виде схемы:
ZnZnSO4CuSO4Cu или ZnZn2+Cu2+Cu.
Вертикальная черта означает границу раздела твердой и жидкой фаз – место возникновения электродного потенциала, две черты – наличие электролитического ключа. Электролитический ключ служит для снятия диффузионного потенциала, обусловленного разной скоростью диффузии ионов электролита.
На аноде протекает процесс На катоде протекает процесс
окисления восстановления
Zn = Zn2+ + 2ē. Cu2+ + 2 ē = Cu.
Сложив оба уравнения, получим ионное уравнение суммарной реакции
Zn + Cu2+ = Zn2+ + Cu.
Напряжение гальванического элемента (ЭДС) равно разности электродных потенциалов катода и анода
ЕГЭ = Ек – Еа = Ео(CuCu2+) – Ео(Zn Zn2+) = 0,34 – (0,76) = 1,1 В.
Как видно из уравнений анодного и катодного процессов, в ГЭ Якоби-Даниэля не изменяется природа электродов. Поэтому в процессе работы ГЭ напряжение не меняется, и ГЭ является неполяризующимся.
Электролизом называется совокупность процессов, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. Электролиз проводится в электролизной ячейке (а в промышленности – в электролизерах). Электролизная ячейка представляет собой сосуд с электролитом, в который опущены два электрода. Электроды подключают к источнику постоянного тока. Электрод, подключенный к отрицательному полюсу источника тока, называется катодом, к положительному – анодом.
Как и ГЭ, на катоде протекает процесс восстановления, а на аноде – процесс окисления.
Различают электролиз: а) растворов; б) расплавов электро-литов.
Катодный процесс. На катоде легче восстанавливаются катионы или молекулы с бóльшим потенциалом выделения. Для большинства металлов их потенциал выделения близок к электродному потенциалу и не требуется дополнительного напряжения (перенапряжения) для восстановления катионов металлов из растворов их простых солей. На металлах водород выделяется с большим перенапряжением. Например, на Zn перенапряжение выделения водорода составляет 0,8 В. Характер катодного процесса обусловлен положением металла в ряду напряжений:
I II III
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Ni, Sn, Pb, H,Cu, Ag, Au.
Возможны три случая.
1. Катионы металлов, стоящих в ряду напряжений до Al (включительно), из водных растворов не восстанавливаются, а вос-
станавливаются лишь из расплавов солей. В водном растворе легче восстанавливается вода:
2Н2О + 2ē = Н2 + 2ОН-.
2. Катионы металлов, стоящих в ряду напряжений от Мn до Рb, восстанавливаются из водных растворов совместно с водо-родом:
1) Меn+ + n ē = Ме;
2) 2Н+ + 2 ē = Н2 .
3. Катионы металлов, стоящих в ряду напряжений после водорода, восстанавливаются без выделения водорода:
Меn+ + n ē = Ме.
Анодный процесс. Исходя из материала анода, различают электролиз: а) с растворимым и б) с нерастворимым анодом. В основном все металлы, за исключением платины, относятся к растворимым анодам. Растворимый анод сам подвергается окислению:
Ме = Меn+ + n ē.
Нерастворимый анод (графит, платина) химически в процессе электролиза не изменяется, а является лишь передатчиком электронов. На аноде легче окисляются анионы, атомы и молекулы с меньшим электродным потенциалом. Поэтому анионы бескислородных кислот (S2-, I-,Br-, Cl-) окисляются легче, чем вода. Если раствор содержит анионы F- или анионы кислородных кислот (SO42-, SO32 CO32-, РО43- и т. д.), то легче окисляется вода:
2Н2О = О2 + 4Н+ + 4 ē.
