
- •Э. Ф. Зорина, е. Ю. Тюменцева Химия
- •Часть II
- •Органическая химия
- •Оглавление
- •Предисловие
- •Введение
- •Тема 1 изомерия органических веществ
- •Тема 2 алканы
- •Лабораторная работа 1
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 3 алкены
- •Лабораторная работа 2
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 4 алкины и алкадиены
- •1. Гидрирование:
- •Лабораторная работа 3
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 5 Контрольная работа по теме: «Ациклические углеводороды»
- •Тема 6 ароматические углеводороды
- •Лабораторная работа 4
- •Методика выполнения лабораторной работы
- •Опыт № 4. Нитрование бензола
- •Опыт № 5. Сульфирование бензола и его гомологов
- •Контрольные вопросы
- •Тема 7 конденсированные ароматические соединения
- •Лабораторная работа 5
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 8 гетероциклические ароматические соединения
- •Лабораторная работа 6
- •Методика выполнения лабораторной работы
- •Опыт № 2. Пиридин и его свойства
- •Контрольные вопросы
- •Тема 9 галогенопроизводные
- •Лабораторная работа 7
- •Методика выполнения лабораторной работы Опыт № 1. Получение бромистого этила
- •Контрольные вопросы
- •Тема 10 фенолы и нафтолы
- •Лабораторная работа 8
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 11 коллоквиум по теме: «ароматические соединения. Электрофильное замещение»
- •Тема 12 спирты, простые эфиры
- •I. Свойства атома водорода в гидроксиле
- •II. Свойства гидроксила спирта
- •III.Свойства радикала спирта
- •IV. Реакции окисления спиртов
- •Лабораторная работа 9
- •Контрольные вопросы
- •Тема 13 карбонильные соединения: альдегиды и кетоны
- •Лабораторная работа 10
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 14 карбоновые кислоты
- •Лабораторная работа 11
- •Методика выполнения лабораторной работы
- •Опыт № 4. Получение щавелевой кислоты и ее свойства
- •Контрольные вопросы
- •Тема 15 окси- и кетокислоты
- •Лабораторная работа 12
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 16 сложные эфиры. Жиры. Мыла
- •Лабораторная работа 13
- •Методика выполнения лабораторной работы
- •Взаимодействие ацетоуксусного эфира с металлическим натрием
- •Контрольные вопросы
- •Тема 17 моносахариды
- •Лабораторная работа 14
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 18 дисахариды
- •Лабораторная работа 15
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 19 полисахариды
- •Лабораторная работа 16
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 20 контрольная работа по теме: «углеводы»
- •Тема 21 амины
- •Лабораторная работа 17
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 22 аминокислоты
- •Лабораторная работа 18
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 23 диазосоединения. Азокрасители
- •Лабораторная работа 19
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 24 элементоорганические соединения
- •Лабораторная работа 20
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 25 качественные реакции на белки
- •Лабораторная работа 21
- •Методика выполнения лабораторной работы
- •Опыт № 2. Ксантопротеиновая реакция
- •Контрольные вопросы
- •Тема 26 белки кожи, шерсти и шелка
- •Лабораторная работа 22
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 27 контрольная работа по теме: «аминосоединения, диазосоединения, белки»
- •Тема 28 химические отделки Приготовление раствора для правки кожи и меха
- •Приготовление раствора для устойчивой фиксации складок на шерстяных тканях
- •Лабораторная работа 23
- •Методика выполнения лабораторной работы
- •Контрольные вопросы
- •Тема 29 химия полимеров
- •Лабораторная работа 24
- •Методика выполнения лабораторной работы
- •Тема 30 коллоквиум по теме: «теория строения органических соединений. Электронные эффекты»
- •Заключение
- •Библиографический список
- •Словарь терминов и определений
- •Алфавитно-предметный указатель
Контрольные вопросы
1. Что представляет собой диазосоставляющая синтеза?
2. Какого типа реакция осуществляется при смешивании азо- и диазосоставляющих?
3. Перечислите основные условия проведения реакции диазотирования.
4. Напишите схему реакции, объясняющей применение метилового оранжевого как индикатора.
5. Укажите диазо- и азосоставляющую красителя n-диметиламиноазо-бензола.
Тема 24 элементоорганические соединения
Элементорганические соединения − соединения, в молекулах которых с атомом углерода связаны непосредственно металлы и неметаллы (кроме О, Н, N, S, галогенов, Р).
Среди элементорганических соединений большое внимание уделяют металлорганическим соединениям: магнийорганическим (СН3МgВr), органическим соединениям алюминия ((С2Н5)3Аℓ), свинецорганическим соединениям ((С2Н5)4Рb), и др. А также имеют большое значение кремнийорганические соединения ((СН3)2SiСℓ2), фосфорорганические соединения (СН3 − РН2).
Металлорганические соединения имеют широкое практическое применение. Среди них встречаются лекарственные препараты (соединения ртути), антиоксиданты и стабилизаторы высокомолекулярных соединений (соединения олова), антидетонаторы (тетраэтилсвинец), очень важные катализаторы (соединения щелочных металлов, алюминия, титана) и др.
Благодаря высокой реакционной способности многие металлорганические соединения (особенно соединения металлов первой и второй периодической системы) нашли широкое применение в органическом синтезе. Так, на способности металлорганических соединений взаимодействовать с серой, кислородом, галогенами, селеном, теллуром основано их применение для получения спиртов, тиоспиртов и других производных углеводородов. Особенно широкое применение в синтезе углеводородов и их производных (спирты, альдегиды, кетоны, кислоты) находит реакция присоединения металлорганических соединений по кратным связям С = С, С = О, С = N, С N, С = S, N = О и S = О.
И спользование
цинкорганических соединений в работах
А. М. Бутлерова, А. М. Зайцева, С. Н.
Реформатского послужило предпосылкой
для широкого применения органических
соединений магния в аналогичных синтезах
(Барбье, Гриньяр). Классическая работа
Вюрца, П. П. Шорыгина, Мортона, Гильмана
и других способствовали развитию
органического синтеза с использованием
металлов первой группы. По своей роли
в органическом синтезе соединения
щелочных металлов стоят на первом месте
среди всех металлорганических соединений,
уступая только магнийорганическим. Из
органических соединений металлов первой
группы наибольшее применение в
органическом синтезе получили
литийорганические соединения.
спользование
цинкорганических соединений в работах
А. М. Бутлерова, А. М. Зайцева, С. Н.
Реформатского послужило предпосылкой
для широкого применения органических
соединений магния в аналогичных синтезах
(Барбье, Гриньяр). Классическая работа
Вюрца, П. П. Шорыгина, Мортона, Гильмана
и других способствовали развитию
органического синтеза с использованием
металлов первой группы. По своей роли
в органическом синтезе соединения
щелочных металлов стоят на первом месте
среди всех металлорганических соединений,
уступая только магнийорганическим. Из
органических соединений металлов первой
группы наибольшее применение в
органическом синтезе получили
литийорганические соединения.
Смешанные магнийорганические соединения типа RМgХ ( реактив Гриньяра) весьма чувствительны к действию влаги, однако относительно устойчивы к действию кислорода воздуха. Это позволяет проводить магнийорганические синтезы в обычных условиях (без изоляции от воздуха), однако тщательно избегая попадания влаги в реакционную среду.
Магнийорганические соединения. Если на галогеноалкил подействовать магнием (мелкими стружками) в среде безводного этилового эфира, то можно получить магнийорганические соединения. Например:
эфир
С Н3 – Вr + Мg СН3 – Мg – Вr
бромистый
метилмагний
Эфирные растворы магнийорганических соединений называют реактивами Гриньяра (по имени французского химика В. Гриньяра). Эти соединения обладают высокой химической активностью. Поскольку электроотрицательность атома углерода намного выше электроотрицательности атома магния, связь С – Мg поляризована таким образом, что углеродный атом несет частичный отрицательный заряд:
δ- δ+
R – Мg – Х (Х = Сl, Вr, I) .
Поэтому алкильный радикал, связанный с магнием, обладает нуклеофильными свойствами и легко взаимодействует с веществами, содержащими активный (подвижный) атом водорода (например, с водой, спиртами, аминами, ацетиленом):

Н О – Н + СН3 – Мg – Сl СН4 + Мg(ОН)Сl .
О количестве влаги, содержащейся в веществах, можно судить по объему выделившегося метана.
Реактивы Гриньяра легко выступают во взаимодействие с альдегидами и кетонами:
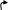 δ-
Н – ОН
δ-
Н – ОН

 δ +
О
δ +
О
Н

 – С + СН3
– Мg
– Сl
СН3
– СН2
– О – Мg
– Сl
– С + СН3
– Мg
– Сl
СН3
– СН2
– О – Мg
– Сl
Н
СН3 – СН2 – ОН + Мg(ОН)Сl .
В результате образуется первичный спирт. Но если реактив Гриньяра взаимодействует с любым другим альдегидом или кетоном, то образуются вторичные и третичные спирты.
С помощью реактива Гриньяра можно получать карбоновые кислоты:
Н – ОН
С2Н5 – Мg – Сl + СО2 С2Н5 – СООМgСl
С2Н5 – СООН + Мg(ОН)Сl .
Таким образом, магнийорганические соединения позволяют синтезировать соединения, относящиеся к различным классам органических соединений.
Органические соединения алюминия. Из этих соединений наибольшее значение приобрел триэтилалюминий (С2Н5)3Аl. Его получают из металлического алюминия, этилена и водорода:
А l + 6СН2 = СН2 + 3Н2 2Аl(С2Н5)3 .
Триэтилалюминий входит в состав катализатора Циглера–Натта. Его используют при полимеризации этиленовых углеводородов. Без использования катализатора Циглера–Натта полиэтилен получают в жестких условиях (высокая температура и очень высокое давление). Применение катализатора позволило резко изменить условия получения полиэтилена. Полиэтилен стали получать при невысокой температуре и низком давлении. Полиэтилен, полученный без катализатора Циглера–Натта, называют полиэтиленом высокого давления, а полученный с этим катализатором – полиэтиленом низкого давления. Эти два вида полиэтилена отличаются друг от друга по физическим свойствам. В настоящее время производят и тот, и другой полиэтилен.
Катализатор Циглера–Натта выполняет и другую важную роль – он позволяет получать полимеры с высокомолекулярным строением. Поэтому его называют стереоспецифическим катализатором.
С помощью триэтилалюминия получают алифатические спирты и кислоты. Для этого триэтилалюминий переводят в высший триалкилалюминий. Например:
(С2Н5)3Аl + 15СН2 = СН2 (С12Н25)3Аl.
тридодецил алюминия
Полученный продукт превращают в алкоголят алюминия при окислении кислородом воздуха. Разлагая водой алкоголят алюминия, получают высшие спирты:
 С12Н25
[О]
ОС12Н25
3Н2О
С12Н25
[О]
ОС12Н25
3Н2О
А l С12Н25 Аl ОС12Н25 3С12Н25ОН + Аl(ОН)3 .
С12Н25 ОС12Н25 додеканол
додеканолят
алюминия
Если высший триалкилалюминий ввести во взаимодействие с СО2, то образуется алюминиевая соль высший кислоты. Разлагая ее водой, получают высшие карбоновые кислоты:
С12Н25 ООСС12Н25 3Н2О
А l С12Н25 + 3СО2 Аl ООСС12Н25 3С12Н25 – СООН + Аl(ОН)3
С12Н25 ООСС12Н25 додекановая
кислота
Полученные высшие алифатические спирты и кислоты используют для производства синтетических моющих средств.
Свинецорганические соединения. Из этих соединений наиболее известен тетраэтилсвинец (С2Н5)4Рd, который используют в качестве антидетонатора для карбюраторных двигателей внутреннего сгорания. Добавление к бензину менее 1 %-го тетраэтилсвинца повышает октановое число горючего. Как известно, это не только улучшает качество бензина, но и ведет к его экономии. Однако тетраэтилсвинец очень ядовит. Использование тетраэтилсвинца в качестве детонатора приводит к тому, что ежегодно в атмосферу выбрасывается около 200 тыс. т свинца.
Ртутьорганические соединения. Они обладают высокой токсичностью для живых и растительных организмов. Поэтому ртутьорганические соединения используют в качестве фунгицидов и гербицидов. Например, при добавлении (С2Н5Нg)3РО4 в краску, которой окрашивают подводные части морских судов, можно добиться полного прекращения нарастания на их поверхности водорослей и моллюсков.
Кремнийорганические соединения. Эти вещества применяют практически во всех областях промышленности. Они используются в качестве гидрофобных (водоотталкивающих) веществ, гидравлических жидкостей, высокотемпературных смазок, теплоносителей, электроизоляторов, эластомеров (резин) и т. д.
Кремнийорганические соединения бывают мономерными и полимерными. Из мономерных соединений наибольшее значение имеют те, которые в молекулах содержат атомы галогена. Их получают взаимодействием элементарного кремния с галогеналкилами при нагревании и в присутствии катализатора. Например:
350 0C
3 СН3Сl + Si (CН3)2SiCl2
Cu диметилдихлорсилан
Гидролизом мономерных кремнийорганических соединений, содержащих атомы галогена, получают полимерные продукты – полиорганосилоксаны:
R 2SiCl2 + 2Н2О R2Si(ОН)2
диалкилсиландиол

 R
R
R
R
R
R
R
R
n НО – Si – ОН НО – Si – О – – Si – О – – Si – ОН + nН2О
R R R n – 2 R
полиорганосилоксан
В макромолекулах полиорганосилоксанов вместо непрочной связи Si–Si содержится прочная силоксановая связь Si–О. Такие соединения были впервые получены химиками под руководством академика К. А. Андрианова.
Полиорганосилоксаны делят на три группы. Первая группа – кремнийорганические жидкости со сравнительно невысокой молекулярной массой, которые используют в качестве гидрофобизаторов для кожи, бумаги, ткани, строительных материалов и конструкций. С этой же целью используют и мономерные кремнийорганические вещества: алкилхлорсиланы, алкиламиносиланы, алкилалкоксисиланы и др.
Вторая группа – это кремнийорганические каучуки (силастомеры), которые представляют собой полимерные материалы с молекулярной массой от нескольких сот до нескольких миллионов. Резина, изготовленная из такого каучука, устойчива к действию окислителей, высоких и низких температур (от –65 до +270 °С), влаги, органических растворителей и масел. Эта резина используется в авиационной промышленности, моторо- и машиностроении, электронике и медицине. Третья группа – кремнийорганические полимеры. Это вещества с высокой молекулярной массой и пространственным строением макромолекул. Их применяют для изготовления изоляционных материалов, слоистых пластиков, красок, пропиточных составов.
Фосфорорганические соединения. В Казанском университете под руководством русского химика академика А. Е. Арбузова создано целое направление – фосфорорганическая химия.
Из фосфорорганических соединений наибольшее значение имеют алкилфосфины (R–РН2, R2РН, R3Р) и алкил- и диалкилфосфиновые кислоты:
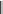 О
О
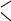
 ОН
R
О
ОН
R
О
R–Р Р
ОН R ОН
кислота алкилфосфиновая диалкилфосфиновая кислота
Эти кислоты можно рассматривать как производные ортофосфорной кислоты
 ОН
ОН
О = Р ОН
ОН,
в молекуле которой одна или две гидроксильные группы замещены на алкильные.
В 1905 г. А. Е. Арбузов открыл реакцию, которая позволяет получать эфиры алкилфосфиновых кислот из эфиров фосфористой кислоты (триалкилфосфитов):

 О
О
R
 О
О
 ОR
RО
R’
ОR
ОR
RО
R’
ОR
Р
 + R/
– Вr
Р Вr
R/
– Р + R
– Вr
+ R/
– Вr
Р Вr
R/
– Р + R
– Вr
RО О R ОR
ОR
эфир фосфористой полный эфир алкил-
кислоты фосфиновой кислоты
В результате этой реакции, получившей имя Арбузова, образуется фосфоруглеродная связь, а трехвалентный фосфор переходит в пятивалентный. Эта реакция легла в основу получения многих сотен фосфорорганических соединений, многие из которых обладают высокой физиологической активностью.
Таким образом, в данном разделе показаны различные представители элеменотоорганических соединений, показана роль учёных в становлении химии элементоорганических соединений и приведены свойства этого класса органических веществ.
[5, с. 344−348].
