
- •Конспект лекций составлен в соответствии с требованиями учебного плана и программой дисциплины «Физическая химия силикатов» и включает все необходимые сведения.
- •Структура вяжущих материалов
- •Структура тугоплавких простых и сложных оксидов, карбидов, боридов и силицидов.
- •Бориды кремния.
- •Силициды.
- •2. Водопотребность и нормальная густота теста.
- •3. Схватывание теста.
- •4.Равномерность изменения объема
- •6. Влияние температуры и добавок на скорость твердения портландцементов.
- •8. Переменное увлажнение и высушивание цементного камня.
- •9. Трещиностойкость
- •10. Ползучесть цементного камня
- •Силикаты в высокодисперсном состоянии
- •Однокомпонентные системы
- •Полиморфизм
- •Правило определения пути кристаллизации двухкомпонентной системы с образованием твердых растворов.
- •Применение правило рычага в двухкомпонентных системах.
- •Треугольник концентраций
- •2.Точки составов химических соединений.
- •3.Пограничные кривые и поля первичной кристаллизации.
- •Различные типы диаграмм состояния
- •Литература Основная
- •Дополнительная
- •Содержание
10. Ползучесть цементного камня
Ползучестью называется свойство цементного камня или бетона необратимо деформироваться под влиянием длительно действующих в них напряжений, возникающих при действии внешних нагрузок, а также усадки, температурного и других факторов.
В зависимости от величины приложенных сил деформация ползучести или постепенно стабилизируется на некотором постоянном уровне, или, непрерывно увеличиваясь, приводит к разрушению тела.
При напряжениях в бетоне до 50—60°/о предела его прочности при сжатии ползучесть носит линейный характер и обусловливается преимущественно вязким течением материала при малозаметном нарушении его микроструктуры.
Вопросы
Что такое вязкость?
Что относится к физико-механическим свойствам цементов?
Охарактеризуйте каждое свойство цементов.
Силикаты в высокодисперсном состоянии
Лекция №10.
Тема : Силикаты в высокодисперсном состоянии. Понятие о дисперсных системах. Мера дисперсности. Классификация дисперсных систем. Характеристика и методы получения коллоидных систем. Коллоидные формы кремнезема. Гели кремниевой кислоты.
1. Понятие о дисперсных системах. Мера дисперсности. Классификация дисперсных систем
2. Характеристика и методы получения коллоидных систем. Коллоидные формы кремнезема. Гели кремниевой кислоты.
Золь кремнезема, — это суспензия кремнезема
Гель –мягкая масса
Понятие о дисперсных системах. Мера дисперсности.
Дисперсные системы - гетерогенные системы с сильно развитой внутренней поверхностью между фазами, состоящие из двух или большего числа фаз, причем, по крайней мере одна из них (называемая дисперсной фазой), обладает достаточно высокой дисперсностью и распределена в окружающей сплошной дисперсионной среде в виде мелких частиц.
По мере уменьшения размеров частиц дисперсной фазы поверхность раздела фаз возрастает. Таким образом, понятие «дисперсные системы» объединяет системы, содержащие частицы малые во всех измерениях, и систему с частицами, имеющими значительные размеры (вплоть до микроскопических).
Дисперсность – характеристика гетерогенной системы, обратно пропорциональная размеру (диаметру) частиц дисперсной фазы. Дисперсность определяет величину удельной поверхности Sудv, т.е. отношение поверхности частицы S1 к ее объему V1:
Sудv= S1/ V1
На практике приходится иметь дело в подавляющем большинстве случаев с полидисперсными системами, размер частиц в которых колеблется от нескольких ангстрем (10-10м) до сотен микрометров (10-4м).
Большой интерес к дисперсным системам со стороны теоретиков и практиков вызван широким распространением их в природе и технике. Горные породы, грунты и почвы, туманы и облака, дождь и снег, космическая пыль и ткани живых организмов являются дисперсными системами. Дисперсной структурой обладают большинство материалов современной техники - сплавы, полимерные и волокнистые материалы, бетоны и композиты.
Классификации дисперсных систем
Существует немало классификаций дисперсных систем по различным признакам. Простейшей является разделение всех дисперсных систем на 3 группы по степени дисперсности: высокодисперсные, или ультрамикрогетерогенные, размер частиц которых лежит в пределах от 10-9 до 10-7м (1-100 нм), микрогетерогенные с размером частиц от 10-7 до 10-5 м (1-10 мкм) и грубодисперсные с частицами, размер которых превышает 10-5м.
По агрегатному состоянию дисперсные системы делятся на три группы - с твердой (т), жидкой (ж) и газообразной (г) дисперсионными средами. Каждую ив этих групп можно разделить но три подгруппы - в соответствии с агрегатным состоянием дисперсной фазы. Практически реализуются лишь 8 из 9-ти теоретически возможных комбинаций, т.к. газ в газе в обычных условиях образует гомогенную систему. Лишь в особах случаях (например, в космическом пространстве) возможны неоднородные области с флуктуациями плотности типа Г-Г.
В технологии тугоплавких неметаллических и силикатных материалов наибольшее значение имеют системы типа Т/Ж с высокой концентрацией дисперсной фазы (суспензии, пасты), Т/Г (разбавленные пыли, дымы; концентрировенные - порошки), Ж/Ж. - эмульсии. Суспензии в промышленности имеют различные названия: в технологии вяжущих материалов - шламы, в технологии керамики и огнеупоров – шликеры, в технологии неорганических веществ -пульпы. Высококонцентрированные суспензии называют пастой, тестом (например, известковое тесто).
По интенсивности молекулярного взаимодействия между фазами на их поверхности раздела дисперсные системы разделяются лиофильные и лиофобные (от греч. "лиос" - жидкость, "фило" -люблю, "фобо" - ненавижу). Применительно к водной дисперсионной среде такие системы называют гидрофильными и гидрофобными. Лиофильные системы (например, глины) проявляют сильное взаимодействие с дисперсионной средой за счет небольшого различия в их молекулярной природе (полярности и способны диспергироваться самопроизвольно, образуя термодинамически устойчивые коллоиды. В лиофобных системах это взаимодействие является слабым вследствие большой разности полярностей образующих их веществ, в результате чего такие системы термодинамически неустойчивы. Мелкие частицы, обладающие повышенной свободной поверхностной энергией, самопроизвольно коагулируют (слипаются) или коалесцируют (сливаются). Для повышения устойчивости подобных систем вводят стабилизаторы (ионы, поверхностно-активные веществе к др.), адсорбирующиеся на поверхности частиц дисперсной фазы и образующие защитные слои, препятствующие обличению частиц друг с другом.
По степени структурирования дисперсные системы можно разделить на 3 основные группы. К первой относятся свободнодисперсные (бесструктурные) системы (золи), в которых частицы дисперсной фазы свободны, не связаны друг с другом и могут независимо перемещаться в дисперсионной среде под действием силы тяжести или броуновского движения. К ним относятся лиозоли, некоторые суспензии и эмульсии, аэрозоли. Вторую группу составляют связнодисперсные системы, характеризующиеся наличием пространственной структуры (сетки, каркаса), составленной частицами дисперсной фазы, например: гели, пасти, порошки, некоторые суспензии и др. Частички, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения. При достаточно прочной структурпой сетке такие дисперсные системы приобретают ряд свойств твердых тел (высокая структурная вязкость, упругость и др.), независимо от агрегатного состояния дисперсионной среды и дисперсной фгеы, П.А.Ребиндер системы первой группы назвал жидкообразными, а второй - твердообразными. Промежуточное положение занимают структурированные жидкости - дисперсные системы, отдельные частицы дисперсной фазы которой связаны друг с другом в рыхлые агрегаты, но не образуют сплошной структуры. Эти агрегаты могут рассматриваться как обрывки пространственной сетки, которая по тем или иным причинам не получила полного развития или частично распалась. При полном разрушении структуры структурированные дисперсные системы переходят в бесструктурные (свободнодисперсные). Если такое превращение происходит обратимо, то говорят о наличии тиксотропии в системе.
Характеристика и методы получения коллоидных систем.
Гетерогенные высокодисперсные (коллоидные) системы широко распространены в природе и имеют исключительно важное значение в технике. Коллоидное состояние характеризуется определенной дисперсностью (степенью измельчения) твердой фазы, В зависимости от размера частиц все дисперсные системы классифицируют следующим образом: грубодисперсные системы (суспензии, эмульсии), состоящие из частиц крупнее 10-6 м; системы промежуточной дисперсности (тонкие взвеси, дымы, пористые тела), состоящие из частиц размерами 10-6... 10-7 м; высокодисперсные системы (собственно коллоиды), состоящие из частиц размерами 10-7.. 19-9 м. Поскольку измельченное вещество обычно находится в какой-либо среде, с которой оно в большей или меньшей степени взаимодействует, то свойства его необходимо рассматривать в совокупности с этой средой. В результате взаимодействия коллоидных частиц друг с другом и с дисперсионной средой образуются коллоидные структуры со специфическим комплексом свойств. Многообразие свойств высокодисперсных систем обусловливается следующими факторами: химическим составом отдельных компонентов, размерами частиц дисперсной фазы, агрегатным состоянием исходных продуктов, молекулярными силами в поверхностных межфазных слоях, а также свойствами и строением этих слоев.
Коллоидные системы образуются в результате либо дробления крупных кусков вещества до требуемой дисперсности, либо объединения молекул или ионов в агрегаты коллоидных размеров. В соответствии с этим существуют диспергационные и конденсационные методы получения дисперсных систем.
Диспергационные методы. По этим методам над системой совершают работу для преодоления межмолекулярных сил и накопления свободной поверхностной энергии. Механическое диспергирование предусматривает измельчение материала за счет механической работы. Электрический способ получения коллоидных систем основан на образовании вольтовой дуги между электродами из диспергируемого металла, помещенными в охлаждаемую воду. Этот метод к диспергационным относится условно, так как металл электрода распыляется при температуре дуги с образованием паров, которые впоследствии конденсируются в холодной жидкости. Также условно к методам диспергирования относят-метод пептизации: к свежеприготовленному рыхлому осадку диспергируемого вещества прибавляют раствор электролита-стабилизатора, под действием которого частицы осадка отделяются друг от друга и переходят во взвешенное состояние, образуя золь. Диспергационными методами достичь высокой дисперсности обычно не удается.
Конденсационные методы. Этими методами, подразделяющимися на физические и химические, получают системы с размерами частиц порядка 10-8... 10-9 м.
Важнейшие физические методы получения дисперсных систем — конденсация из паров и замена растворителя. При изменении параметров системы, в частности, при понижении температуры, давление пара над жидкостью (или твердым телом) может Стать выше равновесного и в газовой фазе возникнет новая жидкая (или твердая) фаза; система становится гетерогенной, конденсирующиеся частицы образуют с газовой фазой дисперсную систему— туман (или дым). Для образования дисперсной системы по методу замены растворителя к истинному раствору какого-либо вещества добавляют в большом объеме другую жидкость, являющуюся для этого вещества плохим растворителем, но хорошо смешивающуюся с исходным растворителем. Методы химической конденсации основаны на конденсационном выделении новой фазы из пересыщенного раствора, при этом вещество, образующее дисперсную фазу, появляется в результате химических реакций обмена, окислительно-восстановительных, гидролиза и др.
Коллоидные формы кремнезема. Гели кремниевой кислоты.
Большинство изменений, которые происходят с кремнеземом в природе, вызывается взаимодействием с водой. Основной характеристикой системы кремнезем — вода является тенденция этого оксида образовывать коллоидные растворы или гидратированные массы. Предполагают, что при образовании кварцевых жил осаждение геля кремнезема иногда предшествует развитию кристаллов кварца. При образовании аморфного опала кремнезем вначале выделяется в виде мягкой гелеобразной массы, которая постепенно твердеет и начинает проявлять свойственные ей дифракционные свойства.
К типичным природным коллоидным формам кремнезема принадлежат опалы; метаколлоидный характер имеют халцедоны и часть кварца.
Коллоидный кремнезем, или золь кремнезема, — это суспензия кремнезема, размеры частиц которого находятся в коллоидной области. Известны следующие способы приготовления водных золей кремнезема: нейтрализация раствора силиката натрия и диализ через полупроницаемые мембраны; применение электродиализа; растворение элементарного кремния в водных растворах аммиака или амина; нейтрализация силиката натрия кислотой; пептизация гелей при повышенной температуре; применение ионообменной смолы для удаления натрия из раствора силиката натрия. После смешивания силиката натрия и соляной кислоты кремниевая кислота получается в высокодисперсном, вероятно, молекулярном, состоянии; она постепенно становится коллоидной при непрерывном росте частиц. Даже при тщательной дальнейшей очистке относительная вязкость золя увеличивается вплоть до образовании геля. Если пересыщенный раствор монокремниевой кислоты оставить стареть, то в конечном счете определяется твердая фаза аморфного кремнезема. Этот кремнезем может появиться в форме коллоидных частиц, осадка или геля. Предполагалось, что превращение монокремниевой кислоты происходит через промежуточные формы поликремниевой кислоты до одной из этих форм аморфного кремнезема,- так как изменение представляет собой возвращение системы к состоянию, отвечающему минимальной поверхностной энергии. Но это положение, по Р. Айлеру, не объясняет механизма полимеризации кремниевой кислоты и не предсказывает, какую форму примет конечный полимер. Общее уравнение полимеризации может быть представлено следующим образом:
n Si(OH)4→(SiO2)n + 2nH2O
По мнению В. А. Вейля, процесс полимеризации влечет за собой распределение ОН--ионов между различными атомами кремния, ведущее к образованию полимерных ячеек, в которых каждый атом Si4+ окружен октаэдрически шестью ОН--ионами. В присутствии небольшого количества щелочи кремниевая кислота может полимеризоваться до образования устойчивых дисперсных коллоидных частиц, в то время как в кислом растворе образуется гель кремнезема.
Поверхность частиц коллоидного кремнезема настолько велика, что гидратация становится измеримой и можно говорить о коллоидном гидратированном кремнеземе.
Образование геля кремнезема протекает в две стадии. В первую стадию первоначально образованный Si(ОН)4 конденсируется до образования коллоидных частичек. В разбавленном растворе дальнейшее медленное увеличение размеров частиц является единственным изменением, но при содержании около 1% (мае.) SiO2 эти первоначальные частицы способны конденсироваться до образования непрерывной структуры, которая обеспечивает определенную степень ее жесткости.
Механизм обеих стадий полимеризации является одинаковым, а именно: конденсация до образования связей Si—О—Si. Необратимость процесса формирования геля объясняется необратимостью реакции конденсации, сопровождающейся образованием силоксановой связи.
Коагуляционные структуры образуются путем сцепления частиц ван-дер-ваальсовыми силами через прослойки жидкости в звенья, цепочки, пространственные сетки — рыхлые каркасы. Системы с коагуляционными структурами обладают, как правило, небольшой прочностью, известной пластичностью, а также некоторой эластичностью. Специфическим свойством коагуляционных структур является тиксотропия - способность структур после их разрушения в результате какого-нибудь механического воздействия самопроизвольно восстанавливаться во времени.
Конденсационно-кристаллизационные структуры возникают либо в результате образования прочных химических связей между частицами (конденсационные структуры), либо вследствие сращивания кристалликов в процессе выкристаллизовывания новой фазы. Структуры с таким характером связей между частицами проявляют упругохрупкие свойства. Прочность их обычно значительно выше прочности коагуляционных структур.
Вопросы
1. Характеристика дисперсных систем? Что является мерой дисперсности?
2.По каким признакам классификацируются дисперсные системы?
3. Какие методы получения коллоидных систем существуют?
4. Гели кремниевой кислоты.
Лекция № 11.
Тема : Коллоидно-химические явления в технологии вяжущих материалов.
1. По какому принципу делят коллоидные вяжущие вещества?
2. Влияние на свойства твердеющего материала размера частиц.
Синтез прочности твердеющих вяжущих веществ обусловлен совокупностью процессов, среди которых важное место занимает образование соединений коллоидной дисперсности.
Размер частиц продуктов гидратации изменяется от коллоидных до кристаллов, видимых под микроскопом. По этому принципу вяжущие вещества могут быть разделены на три группы.
1. Вяжущие, действие которых почти полностью обусловлено образованием коллоидных продуктов. К этой группе относится портландцемент, твердеющий при обычных температурах с образованием гидросиликатов кальция. Наличие в портландцементе ионов А13+, Fе3+ и SO42- существенно не влияет на ход процесса гидратации, за исключением самой ранней стадии. Тесто, приготовленное из чистого трехкальциевого силиката С3S (ЗСаО∙SiO2), схватывается и твердеет в основном так же, как и тесто, изготовленное из портландцемента. Продуктами твердения теста из С3S являются гидросиликаты кальция и Са(ОН)2. Так же схватывается и твердеет тесто, приготовленное из двухкальциевого силиката С2S(2СаО∙SiO2). Однако при этом образуется лишь тоберморитовый гель с небольшим содержанием Са(ОН)2. Процесс этот продолжительный, что объясняется медленным взаимодействием β-С2S с водой. Конечная прочность теста из β-С2S такая же, как и прочность тестер C2S.
2. Вяжущие, действие которых почти полностью обусловлено образованием кристаллических продуктов. К этой группе относятся магнезиальные цементы и строительный гипс на основе полуводного гипса. Микроскопические исследования полностью затвердевшего камня, полученного из этих материалов, показывают, что он состоит из плотно упакованной массы кристаллов. На очень ранней стадии схватывания этих вяжущих образуются частицы коллоидного и субмикроскопического размера. Однако по мере твердения они, по-видимому, замещаются более крупными кристаллами.
3. Вяжущие, действие которых обусловлено образованием как коллоидных, так и кристаллических продуктов. Так, прочность рульфатно-шлаковых цементов в начальные сроки твердения, по-видимому, зависит главным образом от возникновения кристаллов эттрингита, тогда как в более поздние сроки все более важную роль играют гидросиликаты кальция. При твердении алюминатных цементов в нормальных условиях на прочность влияют как кристаллические продукты — САН10(СаО-А1203∙10Н2О) и С2АН8(2САО∙АlО3-8Н2О), так и коллоидный А1(ОН)3. Существует оптимальное соотношение кристаллических и коллоидных составляющих.
Твердение может быть связано с образованием как кристаллических, так и коллоидных продуктов, либо продуктов обоих типов. Размер частиц продуктов влияет на ряд свойств твердеющего материала. Одно из них — влажностные деформации, |т. е. объемные деформации, возникающие при изменении влажности атмосферы, в которую материал помещен. При прочих равных условиях цементы, содержащие больше кристаллических гидратных новообразований, характеризуются меньшими влажностными деформациями, чем цементы, состоящие в основном из коллоидных продуктов. Предполагают, что они отличаются повышенной устойчивостью к химическим воздействиям.
Продукты гидратации вяжущих способны срастаться, образовывая монолит. Связь между частицами наряду с чисто механическим упрочнением за счет формирования переплетающихся волокон и армирующим действием кристаллов, распределенных в твердеющем тесте, обеспечивается химическими силами связи, действующими по местам фазовых контактов.
Несмотря на значительные успехи в химии и технологии вяжущих веществ, до настоящего времени существуют разногласия во взглядах на процессы гидратации и гидролиза и особенно на взаимосвязь этих явлений с формированием пространственных структур в дисперсиях и соответственно синтезом прочности материалов: большинство исследователей трактуют стадию взаимодействия кристаллов с водой как топохимическую, т. е. сопровождающуюся присоединением поверхностью кристаллов молекул воды или ионов Н+ и ОН- с образованием гидратированного слоя небольшой толщины и последующим переходом частично или полностью гидратированных ионов в водный раствор. Значительный вклад в развитие топохимического механизма гидратации внесли Д. Джеффри, X. Функ, О. П. Мчедлов-Петросян, В. В. Тимашев, И. П. Выродов, Р. Кондо и др. Многие исследователи считают, что при твердении вяжущих возможны кристаллизационные и коллоидационные процессы. При этом более растворимые соединения (например, гипс) гидратируются через раствор, а малорастворимые (силикаты кальция и др.) - топохимически.
Электронно-микроскопические исследования затвердевшего цементного камня свидетельствуют, что значительная часть гидратированной цементной массы состоит из плохо закристаллизованных гидросиликатов кальция. Наряду с гидроксидом кальция наблюдаются кристаллические образования гидросульфоалюминатов, которые участвуют в создании первичной кристаллической структуры. Рис. 18 иллюстрирует изменение свойств цементного камня при его гидратации. В начальныйпериод гиратации при соприкосновении частиц цемента с водой на контактной поверхности начинают идти реакция растворения кристаллов безводных минералов и результатом их протекания является насыщение воды затворения ионами Са2+, S042-, ОН-, К+, Nа+ и др.
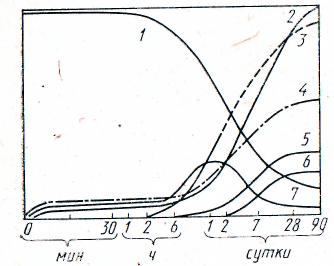
Рис. 18. Зависимость изменения характеристик системы цемент —
вода от времени взаимодействия:
пористость (1) и прочность (2) цементного камня, содержание в системе коротковолокнистых гидросиликатов (3) и гидроксида (4) кальция С4(А,F)Н13 (5), моносульфата кальция (6) и эттрингита (7)
Увеличение содержания элементов в растворе во времени обусловлено растворением минералов, а снижение их содержания вызывается вступлением их в реакцию друг с другом или с исходным вяжущим с образованием новых водосодержащих соединений — кристаллогидратов. После достижения пересыщения из раствора кристаллизуются Са(ОН)2 и эттрингит, образующие осадки в виде плотной корки на частичках цемента, которая затрудняет диффузию воды к негидратированной их части и замедляют тем самым процесс гидратации. На последующих стадиях процесса гидратации происходит выделение кристаллов большого числа гидратов. Усиленное образование мельчайших частиц гидросиликатов кальция способствует дальнейшему уплотнению структуры геля, снижению пористости камня, нарастанию его прочности .
Вопросы
Какие группы коллоидных вяжущих веществ вы знаете?
Что такое влажностные деформации?
О чем свидетельствует электронно-микроскопические исследования затвердевшего цементного камня?
Лекция № 12.
Тема : Твердофазовые процессы в силикатных системах - вяжущих материалах. Спекание и рекристаллизация. Реакции веществ в твердом состоянии. Механизм реакции в твердом состоянии.
Твердофазовые процессы в силикатной системах.
Механизм реакции в твердом состоянии.
Основные положения о механизме и специфических особенностях протекания реакций в кристаллических смесях.
Реакции веществ в твердом состоянии были открыты и стали изучаться в конце XIX — начале XX вв. Основы учения о твердых растворах заложены исследованиями П. П. Аносова, Н. Н. Бекетова, Д. К. Чернова, В. Шпринга, Ф. М. Флавицкого и позднее И. В. Кобба, Дж. А. Хедвала и Г. Таммана. Реакции в смесях кристаллических оксидов и силикатов подробно рассматриваются также в трудах А. И. Августиника, А. С. Бережного, П. П. Будникова, А. М. Гинстлинга, И. С. Кайнарского, Э. К. Келера, П. С. Мамыкина и др.
Реакции веществ в твердом состоянии представляют большой научный и практический интерес. Они имеют первостепенное значение для производства разнообразнейших типов и видов керамики и огнеупоров, для химической, металлургической промышленности и промышленности строительных материалов, а также для некоторых новых областей техники. Отличительной особенностью реакций в твердых фазах является то, что взаимодействие твердых веществ (обычно в виде порошков различной степени дисперсности) происходит в отсутствие жидкой фазы, при этом наряду с химическими в системе протекают физические и физико-химические процессы. Твердофазовые процессы протекают очень медленно и в реальных условиях практически никогда не доходят до конца, однако большинство смесей оксидов и силикатов реагируют в твердом состоянии при нагревании. При достижении некоторой температуры, характерной для каждого из реагирующих веществ, амплитуда колебаний атомов в кристаллической решетке становится настолько большой, что атомы могут перемещаться внутри решетки или выходить за ее пределы. Течение процесса облегчается при нагревании: решетка кристаллов становится более рыхлой, увеличивается число дефектов в решетке и существенно возрастает роль диффузионных процессов, фактически обеспечивающих взаимодействие в твердой фазе.
Механизм реакции в твердом состоянии
Химические взаимодействия в смеси твердых реагентов имеют некоторые существенные особенности: протекают на поверхности раздела сосуществующих фаз (имеют гетерогенный характер), зависят от пространственного расположения масс реагирующих компонентов и в конечном счете связаны с возникновением фаз измененного химического состава.
По Г. Ф. Хюттигу, процесс взаимодействия реагентов в смеси разделяется на шесть основных периодов: 1) «прикрывание» — соприкосновение зерен, затрудняющее доступ реагента к местам их контакта; 2) активирование — образование элементарных оболочек («квазимолекул») из передвигающихся ионов более подвижного компонента на поверхности зерен менее подвижного компонента на поверхности зерен менее подвижного компонента; 3) дезактивация — уменьшение подвижности частиц в образовавшихся оболочках в результате усиления их связи, с решеткой покрываемого компонента и насыщения поверхности частиц этого компонента; 4) второе активирование — начало диффузии более подвижного компонента внутрь решетки менее подвижного компонента; 5) образование кристаллического продукта реакции, решетка которого имеет много дефектов структуры; 6) исправление дефектов решетки образовавшегося соединения. В некоторых системах зафиксированы не все перечисленные периоды.
Исследование процессов образования новой фазы в результате прохождения реакции в твердых телах показало, что важной стадией этих процессов являются возникновение и скорость роста зародышей кристаллического новообразования. В целом процесс, заключается в образовании начальных центров реакции, развития из них устойчивых ядер продукта и пространственного роста образовавшихся ядер с созданием границы между старой и новой фазами. На этой границе преимущественно или полностью локализуется процесс образования зародышей новой фазы. Возникновение и рост зародышей новой фазы, а следовательно, и скорость протекания твердофазовых реакций в значительной мере определяются наличием или образованием при нагревании дефектов кристаллической решетки, снижающих энергию активации диффузии и облегчающих ее протекание.
Многочисленными исследованиями установлено, что в общем случае процесс физико-химических превращений в смеси твердых веществ может включать в себя следующие основные процессы или стадии: возникновение дефектов, разрыхление кристаллических решеток; перестройку решеток вследствие полиморфных превращений; образование и распад твердых растворов; диффузию (внешнюю, внутреннюю, поверхностную); спекание, «отдых» — уменьшение числа дефектов решетки, рекристаллизацию, плавление, растворение компонентов системы в расплаве; кристаллизацию из жидкой фазы; возгонку; диссоциацию; собственно химическое взаимодействие. Таким образом, для понимания сущности и условий протекания реакций в смесях твердых веществ необходимо изучить механизм и закономерности, которым подчиняются указанные элементарные процессы.
Основные положения о механизме и специфических особенностях протекания реакций в кристаллических смесях сформулированы Г. Тамманом и Дж. А. Хедвалом. Они могут быть сведены к следующему.
1. Реакции, возникающие при нагревании смесей кристаллических веществ (например, солей и оксидов, основных и кислотных оксидов, металлов и оксидов, сульфидов и металлов, сульфидов» и оксидов и т. д.), протекают за счет непосредственного взаимодействия между зернами этих тел. Роль жидких и газообразных веществ в этих реакциях исключается.
2. Реакции между твердыми веществами идут с выделением теплоты.
3. Достижение равновесия в системах, не содержащих твердых растворов, практически невозможно. В отсутствие твердых растворов состояние равновесия при протекании таких реакций может наступить лишь при определенных значениях температуры процесса и при условии, что теплота реакции весьма мала, а суммы теплоемкостей исходных веществ и продуктов реакции существенно различаются между собой (вероятность этого весьма незначительна).
4. Температура начала реакции соответствует температуре интенсивного обмена местами элементов кристаллических решеток реагирующих веществ и температуре их спекания (совпадает с этой температурой). Температура начала реакции между оксидом и солью определяется подвижностью элементов кристаллической решетки оксида.
5. При полиморфном превращении одного из компонентов смеси при относительно низкой температуре химическая реакция начинается и интенсивно протекает в точке этого полиморфного превращения.
Вопросы
Что является отличительной особенностью реакций в твердых фазах?
Каков механизм реакции в твердом состоянии?
Кем сформулированы основные положения о механизме и
специфических особенностях протекания реакций в кристаллических
смесях и расскажите о них.
Лекция № 13.
Тема : Влияние отдельных факторов на скорость твердофазовых реакций. Дисперсность, температура, газовая и жидкая фаза.
Общая характеристика процесса спекания. Спекание в твердой фазе. Рекристаллизация.
Понятия дисперсность, температура, газовая и жидкая фаза.
Общая характеристика процесса спекания. Спекание в твердой фазе.
Рекристаллизация.
Дисперсность. Равномерность и степень измельчения кристаллических реагентов оказывают влияние прежде всего на следующие параметры процессов, протекающих в твердой фазе: на площадь поверхности и величину поверхностной энергии зерен; на скорость растворения, возгонки, диссоциации и химического взаимодействия с другими реагентами; на толщину слоя продукта, образующегося на зернах в процессе химического взаимодействия, и на скорость диффузии через этот слой. Влияние дисперсности реагентов на скорость реакций, протекающих в твердой фазе, иллюстрируется данными рис. 19.
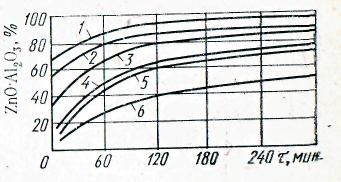
Рис. 19. Зависимость скорости взаимодействия ZnO с А1203 при 800°С от размера зерен компонентов, мкм:
1—2—6; .2—6; 2 — 2—6; 70—90; 3 —2—6; 150—200; 4 — 70—90, 2—6; 5 —70—90; 70—90; 6—150—200; 2—6 (по Будникову)
В производственных условиях увеличение площади реакционной поверхности и уменьшение пути внутренней диффузии при уменьшении размеров зерен не только благоприятно сказывается на производительности применяемой для обжига аппаратуры, но и позволяет снизить температуру процесса и удельный расход энергии. Однако следует отметить, что кривые зависимости скорости реакций от степени дисперсности имеют максимум, т. е. существует оптимальное значение дисперсности порошков, при котором взаимодеиствие происходит с наибольшей интенсивностью.
Температура.

Рис. 20. Изменение скорости реакции от температуры в различных условиях:
/ —область, химической кинетики; 2 — диффузионная область; 3 — постепенный переход из области / в область 2; 4 — относительно резкий переход из области / в область 2
На практике реакции в кристаллических смесях обычно протекают при постепенном повышении температуры. При таком прохождении процесса вероятен его переход из одной области (стадии) в другую, например из области химической кинетики в диффузионную и др.
Газовая и жидкая фазы. Наличие жидкой и газовой фаз оказывает существенное влияние на протекание реакций в твердых фазах, главным образом увеличивая площадь поверхности взаимодействия между реагентами. Если процесс протекает при наличии газа или жидкости, то они омывают зерна, в связи с чем площадь реакционной поверхности равна (или близка) площади поверхности зерен одного из реагентов. Площадь поверхности химического взаимодействия, осуществляемого при непосредственном контакте твердых частиц, обычно в 104... 107 раз меньше, чем при взаимодействии, осуществляемом через газовую или жидкую фазу.
Непосредственное взаимодействие между зернами кристаллических реагентов происходит путем передачи массы от одного реагента к другому через твердый слой продукта благодаря внутренней диффузии. Значения коэффициента диффузии D твердого в твердом лежат в пределах 10 ... 10-8 м2/с, при этом степень превращения твердых веществ за 1 ч может составить от 10-8 до 10-2, При участии в процессе газовой или жидкой фазы интенсивность массопередачи увеличивается на несколько порядков.
Учитывая, что роль газовой и жидкой фазы в процессах, происходящих при нагревании твердых смесей, имеет большое значение для характеристики их механизмов, эти процессы можно разделить на следующие группы: 1) процессы непосредственного взаимодействия между зернами твердых веществ; 2) процессы, протекающие при участии газовой фазы; 3) процессы, протекающие при участии жидкой фазы; 4) процессы, протекающие при одновременном участии газовой и жидкой фаз. Наиболее существенные варианты возможного механизма реакций в твердой смеси, протекающих при участии газовой и жидкой фаз, изучены П. П. Будниковым и А. М. Гинстлингом.
Общая характеристика процесса спекания.
В технологии силикатов обычно применяют композиции, содержащие несколько компонентов. До нагревания смеси представляют собой системы с различной пористостью, в процессе термообработки превращающиеся в более плотное тело. Явление упрочнения и уплотнения исходных, относительно малосвязанных смесей зернистых компонентов, происходящее за счет физико-химических процессов переноса вещества, развивающихся и протекающих с заметной скоростью при повышении температуры (и давления), называется спеканием.
На первой стадии происходит взаимное припекание частиц, сопровождающееся увеличением поверхности их контакта. Однако суммарная поверхность контактов мала, и поры являются непрерывной фазой. На второй стадии материал превращается в сплошное пористое тело, в котором и твердая и поровая фазы являются практически непрерывными. Третья стадия характеризуется наличием разобщенных, изолированных пор, включенных в непрерывную твердую фазу; уплотнение материала на этой стадии, происходит за счет уменьшения числа пор и их размеров. В реальных системах эти стадии в различной мере перекрываются, протекая одновременно.
Следовательно, при спекании протекают следующие процессы: Образование и рост контактов между частицами твердой фазы; уменьшение числа и размеров пор вплоть до их исчезновения; смещение границ между зернами, приводящее к увеличению размеров зерен.
С позиций термодинамики движущей силой процессов переноса вещества является уменьшение термодинамического потенциала системы. Так как результирующая сил, действующих на поверхностную частицу зерна, направлена внутрь, то зерно всегда обладает тенденцией к сокращению поверхности. Уменьшение суммарной поверхности зерен и зарастание пор снижает поверхностную, а следовательно, и полную энергию системы. Движущая сила процесса спекания тем больше, чем больше поверхностная энергия системы, обусловленная высокой удельной поверхностью, дефектностью структуры, несовершенством контактов между частицами.
Внешним признаком спекания служит уменьшение размеров (усадка) спекаемого тела. Перенос вещества осуществляется по одному или нескольким механизмам; спекание может происходить как в твердой фазе, так и в присутствии жидкой фазы.
Спекание в твердой фазе
При спекании протекают два параллельных процесса — образование и рост контактов между частицами и изменение формы и величины поровых каналов. Неодинаковое прохождение этих процессов может быть вызвано лишь различными механизмами переноса вещества при спекании. Современная теория спекания предусматривает несколько механизмов переноса вещества: объемная и поверхностная самодиффузия, вязкое и пластическое течение, испарение — конденсация. Чаще всего спекание в твердой фазе осуществляется по двум механизмам: за счет переноса вещества испарением — конденсацией и за счет диффузии.
Рекристаллизация. В подавляющем большинстве случаев диффузионное спекание кристаллических тел в некотором температурном интервале сопровождается образованием новых кристаллов или ростом одних зерен за счет других. Изменение количества и (или) размеров кристаллов по сравнению с исходными называется рекристаллизацией.
Существуют различные представления о движущей силе и физической сущности процесса рекристаллизации. Наиболее распространено мнение о том, что движущей силой процесса рекристаллизации следует считать уменьшение термодинамического потенциала тела либо за счет уменьшения суммарной поверхности границ между зернами, либо при снятии искажений и напряжений в решетках. Следует различать основные компоненты, слагающие процесс рекристаллизации, — первичную рекристаллизацию, вторичную рекристаллизацию и рост зерен.
Первичная (истинная, рекристаллизация обработки) рекристаллизация—процесс, при котором в массе, подвергнутой пластической деформации, образуются центры кристаллизации и растут зерна новообразований.
Первичная рекристаллизация, происходящая в результате пластической деформации, характерна для технологии получения изделий из металлов.
Вторичная (аномальная, собирательная, прерывистая) рекристаллизация —процесс, не связанный с предварительной деформацией тела. Вторичная рекристаллизация может протекать в материалах с деформированной и недеформированной решеткой и сводится к укрупнению некоторого количества зерен большого диаметра за счет тонкозернистой массы путем перемещения границ зерна
Вопросы
Дайте характеристику понятий дисперсности, температуры, газовой и жидкой фазы.
Что называется спеканием?
Какие процессы протекают при спекании?
4. Основные компоненты, слагающие процесс рекристаллизации.
Лекция № 14.
Тема : Спекание в присутствии жидкой фазы. Твердожидкостное спекание.
1. Спекание в присутствии жидкой фазы
2. Твердожидкостное спекание.
Спекание в присутствии жидкой фазы
Спекание в присутствии жидкой фазы, смачивающей твердую, является самым распространенным случаем спекания в технологии силикатов. Такое спекание может происходить как при наличии, так и в отсутствие взаимодействия между жидкой и твердой фазами.
Спекание в отсутствие заметного взаимодействия твердой и жидкой фаз, имеющее место при получении некоторых огнеупоров, сопровождается заполнением жидкой фазой пор между зернами.
Если количество жидкой фазы достаточно, то все поры будут заполнены, произойдет перегруппировка зерен и усадка материала. Движущей силой этого вида спекания является поверхностное натяжение расплава, определяющее возникновение в замкнутой округлой поре отрицательного давления, которое приводит к заплыванию поры и сближению зерен.
Если при спекании происходит взаимодействие жидкой и твердой фаз, спекание протекает в три стадии. На первой стадии после появления жидкой фазы происходит сближение и перераспределение зерен (рисунок 21). Между двумя близко расположенными зернами спекаемого вещества появляется прослойка смачивающей жидкости, приобретающая форму линзы с вогнутым мениском на границе с газовой средой. Силы поверхностного напряжения вызывают избыточное давление, направленное с сторону центра кривизны мениска. Это давление перемещает жидкость из зоны контакта, за счет чего происходит сближение твердых зерен на величину ∆L, сопровождающееся более плотной упаковкой частиц и заполнением пор расплавом. Усадка на этой стадии, по Кингери, пропорциональна времени в степени (1+х). На второй стадии протекает процесс растворения твердой фазы в жидкой и по мере ее насыщения – кристаллизация из нее этой же фазы
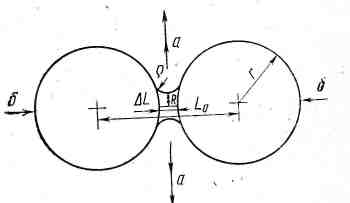
Рис. 21. Схема спекания в присутствии жидкой фазы
В первую очередь растворение идет в местах контакта, в результате чего происходит дальнейшее сближение кристаллов, причем по Кингери, доля усадки на этой стадии уменьшается становится пропорциональной времени в степени 1/3. Мелкие кристаллы могут полностью раствориться, однако более крупные растут- идет перекристаллизация через расплав. На третьей стадии заканчивается рекристаллизация и прекращается уплотнение, формируется жесткий каркас тела.
Твердожидкостное спекание
В таких силикатных материалах, как фарфор, портландцементный клинкер и др., когда в процессе обжига происходит образование новых кристаллических фаз, процессы спекания еще более сложны. В этих случаях процесс спекания слагается из двух групп реакций с участием расплава. Г.В. Куколев назвал такое спекание смешанным твердожидкостным спеканием.
Скорость реакций первого твердофазового периода невелика, скорость реакции в присутствии жидкой фазы значительна. Скорость спекания возрастает при увеличении доли эвтектических расплавов, в которых частичное или полное растворение компонентов шихты и из которых осуществляется кристаллизация новых фаз; при уменьшении размеров зерен исходных компонентов; при повышении температуры.
Установлено, что имеет значение не только абсолютное значение температуры, но и скорость ее повышения. При быстром нагревании в большей степени сохраняется активность исходных тонкодисперсных порошков. В реакциях участвуют компоненты с нарушенной кристаллической решеткой, что приводит к ускорению реакций между твердыми веществами, к повышению их растворимости в жидкой фазе
Примерами смешанного твердожидкостного спекания могут быть процессы спекания фарфоро-фаянсовых масс и портландцементного клинкера.
Спекание портландцементного клинкера
При нагревании портландцементных сырьевых смесей отдельные компоненты претерпевают различные физико-химические превращения: глинистые минералы (водные алюмосиликаты) теряют механически примешанную и адсорбированную влагу, что сопровождается аморфизацией решетки; карбонаты диссоциируют с выделением углекислого газа; кристаллы кварца претерпевают полиморфные превращения и т. д
По мере повышения температуры и протекания процессов диффузии кристаллические решетки компонентов приобретают повышенную активность вследствие появления вакансий на местах, ранее занятых Н2О, ОН-, СО2. Результатом взаимодействия дефектных кристаллов друг с другом являются собирательная рекристаллизация (укрупнение кристаллов существующих фаз) и образование кристаллов новых соединений. Реакции в твердом состоянии, происходящие при обжиге портландцементного клинкера, как уже отмечалось, характеризуются многоступенчатостью, что затрудняет описание процесса одним кинетическим уравнением. Поэтому разрабатываются уравнения либо для описания кинетики твердофазовых реакций в наиболее простых, бинарных системах оксидов, либо для описания отдельных стадий процессов в более сложных системах.
Наличие различных примесей в сырье приводит к образованию в обжигаемых смесях псевдоэвтектических жидких фаз в виде отдельных микрокапель или тонких пленок расплава на поверхности зерен. Эти первичные жидкие фазы, несмотря на весьма незначительные их количества, существенно ускоряют реакции. При появлении в гранулах зон микрорасплавов протекает процесс объемной диффузии. Роль газовой фазы при невысоких температурах невелика, но резко возрастает при 1400...1500°С, усиливая массопередачу между зернами реагирующих компонентов.
Таким образом, портландцементные сырьевые смеси при температуре 1200...1300°С состоят из минералов, образовавшихся в твердых фазах, и непрореагировавшего свободного оксида кальция. Дальнейшее повышение температуры вызывает появление расплава, процесс спекания идет с участием жидкой фазы. Количество и состав жидкости при нагревании изменяются за счет насыщения эвтектического расплава растворяющимися в нем компонентами смеси. В нормальном по составу клинкере количество жидкой фазы колеблется от 20 до 30%. Скорость растворения плотных частиц оксида кальция и двухкальциевого силиката в клинкерном расплаве лимитируется скоростью диффузии ионов через сорбированный на частицах слой расплава, при этом скорость, растворения оксида кальция в 3—4 раза превышает скорость растворения двухкальциевого силиката. При достаточном насыщении жидкой фазы необходимыми компонентами начинается процесс кристаллизации расплава с выделением новой фазы — трехкальциевого силиката. Процесс последовательно проходит три стадии: 1) насыщение и пересыщение жидкой фазы необходимыми компонентами; 2) образование центров, кристаллизации новой фазы; 3) рост кристаллов. Основной фазой, кристаллизующейся из расплава, является трехкальциевый силикат, а при понижении степени пересыщения жидкой фазы по отношению к оксиду кальция — остаточное количество двухкальциевого силиката.
Спекание портландцементного клинкера, как и других рассмотренных систем, сопровождается изменениями объема. Величина усадки зависит от температуры и времени спекания. При изотермическом спекании на кривых изменения линейных размеров образцов от времени термообработки наблюдаются три стадии. В начальной стадии спекания кривая усадки резко возрастает, на следующем этапе — становится более пологой, а затем асимптотически приближается к пределу, соответствующему максимальной плотности материала. На первом участке величина |усадки пропорциональна времени - в степени от 1 до 2, что, по Кингери, свидетельствует о процессе перегруппировки частиц — начальной стадии жидкофазного спекания. На последующем этапе - усадка пропорциональна времени в степени от 0,2 до 0,5; это соответствует следующей стадии жидкофазного спекания (процессу растворения —осаждения).
Усадка материала сопровождается изменением пористости, начальная пористость зерен составляет от 30 до 50% в зависимости от способа подготовки сырья (способа производства клинкера). В процессе обжига пористость неоднократно изменяется: понижается при усадке глинистого компонента при температуре до 300°С, увеличивается при удалении связанной воды из глинистых минералов при температуре 900...1100°С, значительно уменьшается при протекании процессов твердо- и особенно жидкофазного спекания.
Вопросы
Самый распространенный случай спекания в технологии силикатов.
2. Что такое твердожидкостное спекание?
3. Назовите стадии спекания портландцементного клинкера.
Лекция № 15.
Тема : Основные понятия и определения. Правило фаз. Фазовые превращения в системах вяжущих материалов. Общие понятия о диаграммах состояния тугоплавких систем и их информативность.
Основные понятия и определения
Правило фаз. Фазовые превращения в системах вяжущих материалов.
Общие понятия о диаграммах состояния тугоплавких систем и их
информативность.
Учение о фазовых равновесиях – один из разделов классической термодинамики в котором изучаются условия равновесного существования в различных агрегатных состояниях. Термодинамические данные о свойствах равновесных фаз могут быть предоставлены с помощью математических уравнений или таблиц. Однако наиболее наглядным т общепринятым способом их описания являются графический способ с помощью диаграммы состояния.
Данные о термодинамических свойствах позволяют установить теоретически достижимые параметры технологических процессов, оценить их движущую силу, обуславливающую скорость протекающего того или иного процесса, определить состав, и следовательно ожидаемые свойства материала, оценить стабильность систематических продуктов в различных условиях эксплуатации и т.д.
Учения о реакциях в системах образуемых силикатов основывается прежде всего на многочисленных исследованиях главным образом гетерогенное равновесие, произведенных при высоких температурах, преимущественно в условиях плавления или кристаллизации вещества.
Если систему, содержащую какие- либо вещества, изолировать от остальных материальных систем, то система будет находиться в равновесном состоянии в том случае, если с течением времени в ней не будет происходить ни каких изменений при постоянстве внешних условий (температура и давление).
Равновесие в гетерогенных системах подчиняется правилу фаз, которое было сформулировано в 1876 году, а применении его к различным гетерогенным системам детально разработано Курнаковым. В учении о фазовых равновесиях основными понятиями являются система фаз, компоненты, степень свободы.
Системой называется совокупность веществ в которых протекает изучаемый процесс.
Фаза - это однородная часть системы отделенная от других частей систем поверхностью раздела и отделенная от них механическим путем. Смесь кристаллов в различных полиморфных модификациях какого – либо вещества так же следует рассматривать как систему состоящую из двух или более фаз. Например: смесь кристаллов кварца, тридимита, кристаболита состоит из трех фаз.
Компонент – это каждое отдельное химическое вещество входящее в состав системы, то есть составная часть. Например: система представляющая собой раствор какой – либо соли в воде является двухкомпонентной системой, так как имеется две составные части системы – соль и вода . В системе соль и вода обе составные части независимы друг от друга. Независимая составная часть системы представляет собой химически – однородное вещество, которое может быть выделен из системы и может длительно существовать вне ее без всяких изменений называется компонентом.
Степень свободы – это условие, когда независимые параметры температура, давление и концентрация можно произвольно изменять в определенных пределах не нарушая фазового равновесия системы. Число же условий независимых параметров, которые можно произвольно менять не нарушая равновесия системы называется числом степени свободы.
Правило фаз Гиббса.
F= k+ m-p
F – число степеней свободы;
k – число компонентов;
p – число фаз;
m – число независимых компонентов.
Правило фаз Гиббса (закон равновесия фаз) является важнейшим принципом классификации равновесий в сложных гетерогенных системах, состоящих из многих фаз и компонентов. Правило фаз устанавливает соотношение между числом компонентов, числом фаз и числом степеней свободы равновесной системы. Согласно правилу фаз для физико-химических систем, находящихся в состоянии равновесия, сумма числа степеней свободы и числа фаз равна числу компонентов, увеличенному на два:
где F — число степеней свободы; п — число фаз; К — число компонентов.
Для силикатных и других систем, плавящихся при высоких температурах, один из параметров состояния системы — давление— сохраняет постоянное значение, так как газообразная фаза практически отсутствует. Влияние давления на такие системы очень мало, его изменениями можно пренебречь. Правило фаз при этом примет вид
F+ п = К + 1
Если оба параметра состояния (давление и температура) остаются постоянными, то правило фаз принимает вид
F + п = К
При необходимости использовать в качестве параметров состояния системы кроме давления и температуры дополнительные независимые переменные следует к правой части уравнения правила фаз прибавлять по единице на каждый новый введенный параметр.
Фазовые превращения (фазовые переходы) — это переход веществ из одной фазы в другую. При этом в весьма узком интервале изменения параметров состояния системы происходит скачкообразное изменение ее свойств. Термодинамическая теория фазовых превращений рассматривает фазовые равновесия систем, при которых происходит взаимное превращение фаз. Например, если жидкая и газообразная фазы находятся, в состоянии термодинамического равновесия, то они взаимно обмениваются частицами без нарушения равновесия в системе. Такой обмен называют подвижным равновесием.
Гетерогенное (междуфазное) равновесие нескольких фаз имеет место при соблюдении трех условий. Во-первых, в системе должен отсутствовать систематический поток теплоты из одной фазы в другую, что выражается равенством температур обеих фаз. Во-вторых, фазы должны находиться в состоянии механического равновесия (равенство давлений обеих фаз). В-третьих, химические потенциалы фаз должны быть равны, во избежание систематического перехода энергии из одной фазы в другую.
Кривая, выражающая зависимость давления от температуры при фазовых превращениях, получила название кривой фазового равновесия. Она показывает, при каких значениях температур и соответствующих им давлений фазы существуют в равновесных состояниях.
Существуют фазовые превращения двух типов. При фазовых превращениях первого рода происходит скачкообразное изменение внутренней энергии, концентрации и плотности вещества. Примерами превращений первого рода являются плавление, испарение, возгонка, перекристаллизация вещества, полиморфные превращения и др. Фазовые превращения первого рода всегда сопровождаются либо поглощением, либо выделением теплоты перехода.
Фазовые превращения второго рода сопровождаются скачкообразным изменением теплоемкости, сжимаемости и коэффициента термического расширения тел. Внутренняя энергия и плотность вещества при этом не изменяются, а следовательно, теплота перехода равна нулю. Фазовые превращения второго рода имеют место при переходе металлов из ферромагнитного в парамагнитное состояние в точке Кюри, при процессах упорядочения в сплавах, перехода проводников из. нормального в сверхпроводящее состояние и т. п. Теория фазовых переходов второго рода развита советским ученым Л. Д. Ландау.
Общие понятия о диаграммах состояния тугоплавких систем и их информативность.
При исследовании равновесных систем конечной целью физико-химического анализа является установление зависимости между параметрами системы характеризующими ее, состояние и в частности определение составов равновесных фаз при тех или иных параметрах состояния.
Термодинамическая диаграмма представляет собой диаграмму на которой по оси координат откладывают значения термодинамических параметров или функции состояния. Такие диаграммы позволяют описать изменение свойств системы при изменении ее параметров.
Особенность диаграмм состояния заключается в том, что любая точка на диаграмме имеет строгий физико-химический смысл. Другими словами каждое состояние системы изображается на диаграмме некоторой точкой, которая называется фигуративной точкой.
Диаграммы состояния имеют исключительно важное значение для многих областей промышленности, в частности микроэлектроники, химической технологии, технологии силикатных и тугоплавких неметаллических материалов.
Эти диаграммы позволяют решать ряд и важных практических и теоретических проблем связанных с получением разнообразных веществ с различным сочетанием свойств.
Диаграмма состояния во многих случаях дает возможность объяснить и усовершенствовать процессы, протекающие при образовании данного материала, установить и объяснить влияние фазового состава продукта на его свойства для получения материала заранее заданными свойствами.
Следует отметить, что непосредственно в процессе обжига многих силикатных продуктов при высоких температурах, когда образуется жидкая фаза их состояния приближается к равновесному. Это равновесие нарушается обычно только в процессе слишком быстрого охлаждения, которое имеет место при изготовлении многих силикатных продуктов.
Вопросы
Дайте определение понятиям система, фаза, компонент, степень свободы.
Применение правила фаз Гиббса.
Что входит в общие понятия о диаграммах состояния тугоплавких
систем и их информативность.
Лекция № 16.
Тема : Методы построения диаграмм состояния. Однокомпонентные системы в производстве вяжущих материалов. Элементы строения диаграммы и правила работы с ними.
1. Сущность экспериментальных методов построения диаграмм состояния.
2. Принципы непрерывности и соответствия.
3. Динамический и статистический методы построения диаграмм.
4. Однокомпонентные системы и правила работы с ними.
Сущность экспериментальных методов построения диаграмм состояния сводится к определению опытным путем температур фазовых превращений, характера и состава фаз, находящихся в данной системе в равновесии при различных температурах. Эти исследования проводятся различными методами физического и физико-химического анализа - термическим, микроскопическим, электронно-микроскопическим, рентгенографическим, электронографическим и другими методами.
Правильность построения диаграмм состояния на основе экспериментальных данных контролируются правилом фаз и так называемыми принципами непрерывности и соответствия сформулированные Н.С. Курнаковым, которым диаграмма не должна противоречить.
Принцип непрерывности заключается в том, что при непрерывном изменении параметров, определяющих состояние систем, свойства отдельных фаз и системы в целом изменяются так же непрерывно, но при условии, что не изменяется фазовый состав системы, то есть не возникают новые и не исчезают старые фазы.
Принцип соответствия заключается в том, что каждой фазе или совокупности фаз систем, находящихся в равновесии, соответствует на диаграмме определенный геометрический образ- точка, линия, область. Наиболее распространенным методом экспериментального построения диаграмм состояния являются динамический метод (метод построения кривых охлаждения или нагревания) и статистический метод (метод закалки).
Сущность динамического метода построения диаграмм состояния состоит в построении методом термического анализа кривых охлаждения(или нагревания) образующихся в координатах температура время.
Применение динамического метода построения диаграмм состояния силикатных систем ограничено тем, что скорость достижения равновесия в этих системах часто мало и высоковязкие силикатные расплавы весьма склонные к переохлаждению. В связи с этим метод построения кривых охлаждения для силикатных систем может дать искаженные результаты.
Метод построения диаграмм состояния. Для силикатных систем более приемлемым является оптический метод (метод закалки).
Принцип статического метода заключается в фиксации равновесных при данной температуре фаз в системе и последующего определения их состава содержания в системе. Метод состоит из следующих операций:
проводят отжим;
закалки;
определение состава и содержание фаз в закаленном образце.
Это проводится с помощью метода микроскопического, рентгенографического анализов, или другими методами.
Метод закалки является чрезвычайно трудоемким из – за необходимости исследовать большое число смесей различного состава и при различных температурах.
