
- •Методические указания
- •Часть I.
- •Введение. Общие правила выполнения лабораторных работ
- •Лабораторная работа № 1 основные типы химических реакций. Классы неорганических соединений
- •1.1 Теоретическая часть
- •1.2 Экспериментальная часть
- •Контрольные вопросы
- •Основные расчетные формулы молярных масс эквивалентов сложных веществ
- •2.2 Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа № 3 скорость химических реакций
- •3.1 Теоретическая часть
- •3.2 Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа № 4 растворы электролитов
- •4.1 Теоретическая часть
- •А. Реакции, идущие с образованием осадка
- •Б. Реакции, идущие с образованием газа
- •В. Реакции, идущие с образованием слабого электролита
- •4.2.2 Реакции ионного обмена
- •4.2.2.1 Реакции с образованием слабых электролитов
- •4.2.2.2 Реакции с образованием газа
- •4.2.2.3 Реакции с образованием осадков
- •4.2.2.4 Растворение осадков
- •4.2.2.5 Получение и растворение амфотерных гидроксидов
- •4.2.2.6 Реакции, идущие с образованием комплексного иона
- •Контрольные вопросы
- •Давление насыщенного пара воды при различных температурах
А. Реакции, идущие с образованием осадка
При составлении уравнений реакций этого типа следует учитывать растворимость веществ (приложение, табл.1). Для получения нерастворимого соединения (осадка) следует исходить из двух растворимых веществ, содержащих необходимые ионы. В уравнении реакции вещество, выпадающее в осадок, изображается молекулярной формулой. Уравнение реакции осаждения ВаSО4:
![]() ;
;
![]() .
.
Б. Реакции, идущие с образованием газа
К газам, образующимся в результате обменных ионных реакций, следует отнести сложные газообразные вещества. В основном это водородные соединения неметаллов: CH4, SiH4, NH3, H2S, HBr, HJ и др.
Для получения одного из таких газов по реакции ионного обмена следует исходить из соединения данного неметалла с металлом и соединения, содержащего ионы Н+ (кислота, вода).
![]() .
.
Если исходное вещество (соединение неметалла с металлом) плохо растворимо в воде, то в уравнении реакции его пишут в молекулярной форме:
![]() .
.
В. Реакции, идущие с образованием слабого электролита
К слабым электролитам относятся: вода,
слабые кислоты и основания, кислотные
остатки многоосновных кислот, содержащие
ион
![]() ,
основные остатки многоатомных оснований,
содержащие ионы
,
основные остатки многоатомных оснований,
содержащие ионы
![]() ,
амфотерные гидроксиды, комплексные
ионы.
,
амфотерные гидроксиды, комплексные
ионы.
а) Реакция нейтрализации. Нейтрализацией называется реакция соединения ионов основания (или основной соли) и ионов кислоты (или кислой соли) с образованием слабого электролита – воды.
![]() ;
;
![]() ;
;
![]() .
.
б) Вытеснение слабых кислот из их солей сильными кислотами. Исходными веществами являются соль слабой кислоты и сильная кислота
![]() ;
;
![]() .
.
Если образующаяся слабая кислота является малоустойчивой (Н2СО3, H2SO3), то происходит разложение ее на воду и ангидрид, выделяющийся в виде газа:
![]() ;
;
![]() .
.
в) Вытеснение слабых оснований из их солей сильными основаниями (щелочами). К слабым основаниям относятся: гидроксиды тяжелых металлов, гидроксид аммония.
![]() ;
;
![]() .
.
г) Перевод нормальных солей в кислые. Процесс перевода средних солей в кислые обусловливается взаимодействием ионов, приводящим к образованию слабого электролита – иона кислой соли.
![]() ;
;
 ;
;
 – более слабый электролит
– более слабый электролит
![]()
д) Амфотерные электролиты. Гидроксиды
металлов со степенью окисления (+3) и
(+4) являются амфотерными:
![]() ,
,
![]() ,
,
![]() .
К амфотерным относятся также гидроксиды
некоторых металлов со степенью окисления
(+2): Ве(ОН)2, Zn(OH)2,
Sn(OH)2,
Pb(OH)2
и др.
.
К амфотерным относятся также гидроксиды
некоторых металлов со степенью окисления
(+2): Ве(ОН)2, Zn(OH)2,
Sn(OH)2,
Pb(OH)2
и др.
Амфотерные гидроксиды ведут себя как основания при реакциях с кислотами и как кислоты при реакциях со щелочами.
![]() ;
;
![]() .
.
Эта двойственность объясняется тем, что в растворе они могут диссоциировать и по типу кислот и по типу оснований

у) Реакции, идущие с образованием комплексного иона. Комплексные ионы могут получаться при растворении амфотерных гидроксидов в растворах щелочей, растворении трудонорастворимых солей некоторых металлов в растворах солей щелочных металлов, в растворах аммиака, в избытке кислоты и др. случаях.
Комплексный ион состоит из центральной частицы - комплексообразователя (атом в определенной степени окисления) и окружающих ее лигандов (ионы противоположного знака или молекулы).
Число лигандов вокруг комплексообразователя называется его координационным числом. Заряд комплексного иона равнее алгебраической сумме зарядов комплексообразователя и лигандов и может быть положительным, отрицательным и нулевым. Комплексный ион при написании формулы заключается в квадратные скобки. Комплексный ион является слабым электролитом и может диссоциировать на составляющие его частицы.


В насыщенном растворе труднорастворимого электролита устанавливается равновесие между осадком и его ионами в растворе:
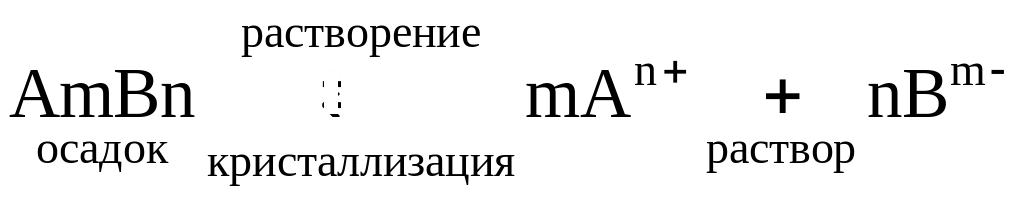 .
.
Концентрации ионов над твердой фазой
электролита (![]() и
и
![]() )
являются равновесными при данной
температуре.
)
являются равновесными при данной
температуре.
Константа равновесия этого гетерогенного процесса определяется только произведением концентраций ионов в растворе в степенях, равных коэффициентам в уравнении диссоциации данного электролита и не зависит от концентрации твердого компонента:
![]() .
.
Произведение концентраций ионов в насыщенном растворе малорастворимого электролита при заданной температуре есть величина постоянная, ее называют произведением растворимости и обозначают ПР.
При увеличении концентрации одного из ионов в насыщенном растворе над твердой фазой концентрация другого иона уменьшается.
По известному произведению растворимости электролита AmBn и концентрации одного из ионов ( или ) можно рассчитать концентрацию другого иона, необходимую для осаждения электролита AmBn. Математическим условием образования осадка в этом случае является выражение
![]() .
.
Осадок растворяется, если
![]() .
.
Величины ПР можно найти в справочниках.
По величине произведений растворимости и констант диссоциации можно предвидеть направление реакций с участием осадков.
Величина ПР или Кдисс, возведенная в степень коэффициента, с которым данное соединение участвует в реакции обмена, называется приведенной величиной произведения растворимости или константы диссоциации.
Реакция обмена протекает в направлении образования электролита с меньшей приведенной величиной произведения растворимости (в случае осадкой) или меньшей приведенной величиной константы диссоциации (в случае образования электролитов).
Пример 1. Растворение осадка в кислотах
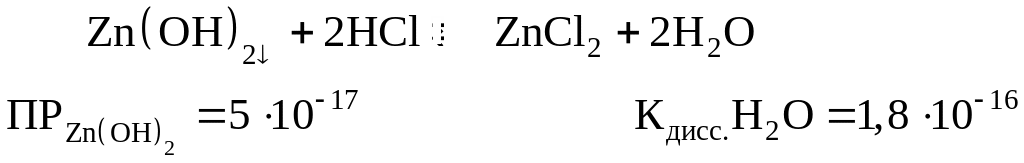
Приведенные величины:
![]() ,
т.к. коэффициент перед Zn(OH)2
в уравнении равен 1;
,
т.к. коэффициент перед Zn(OH)2
в уравнении равен 1;
![]() ,
т.к. коэффициент перед молекулой Н2О
равен 2.
,
т.к. коэффициент перед молекулой Н2О
равен 2.
Растворение осадка Zn(OH)2
возможно, т.к. приведенная величина
КдиссН2О на 15 порядков меньше
приведенной величины
![]() .
.
Пример 2. Реакции обмена с участием осадков

Приведенные величины ПР:
![]() ,
,
![]() .
Реакция пойдет вправо, т.к.
.
Реакция пойдет вправо, т.к.
![]() на 12 порядков меньше
на 12 порядков меньше
![]() .
.
Реакции ионного обмена с участием осадков идут в направлении наиболее полного связывания ионов.
4.2 Экспериментальная часть
4.2.1 Электролитическая диссоциация
Д ля
выполнения опытов 4.2.1.1 – 4.2.1.3 собрать
прибор (рис.1).
ля
выполнения опытов 4.2.1.1 – 4.2.1.3 собрать
прибор (рис.1).
Опыт 4.2.1.1. Сравнение электропроводности электролитов (групповой)
а) Электропроводность дистиллированной и водопроводной воды.
Опустить электроды в стакан с дистиллированной водой (предварительно сполоснуть стакан и электроды этой водой). Заменить дистиллированную воду в стакане водопроводной водой. Как горит лампа в 1-ом и во 2-ом случаях? Чем объяснить наблюдаемое явление?
б) Сравнение электропроводности растворов различных веществ.
Опыт а) повторить, наполняя стакан последовательно растворами сахара, соляной кислоты, нитрата калия, едкого натра. Перед каждым опытом следует тщательно промывать электроды, воронку и стакан и ополаскивать их дистиллированной водой. Растворы каких веществ проводят ток? Что называется электролитом? Составить уравнения электролитической диссоциации исследованных электролитов. Какими ионами характеризуются растворы кислот и щелочей?
Опыт 4.2.1.2 Зависимость электропроводности электролита от разбавления раствора.
Ополоснуть стакан и электроды
дистиллированной водой. Налить в стакан
прибора
![]() объема концентрированной уксусной
кислоты и проверить ее электропроводность.
Включить ток и постепенно доливать в
стакан с кислотой дистиллированную
воду. Объяснить наблюдаемое изменение
накала лампочки. Написать уравнение
диссоциации уксусной кислоты. Как влияет
разбавление на степень диссоциации ?
объема концентрированной уксусной
кислоты и проверить ее электропроводность.
Включить ток и постепенно доливать в
стакан с кислотой дистиллированную
воду. Объяснить наблюдаемое изменение
накала лампочки. Написать уравнение
диссоциации уксусной кислоты. Как влияет
разбавление на степень диссоциации ?
Опыт 4.2.1.3 Изменение электропроводности при нейтрализации слабого основания слабой кислотой.
Налить в стакан разбавленный раствор аммиака (25 %-ный). Отметить неяркое свечение лампочки. Прилить к раствору аммиака равный объем слабого электролита – концентрированной уксусной кислоты. Как изменится накал лампы? Написать уравнение реакции в полярной ионной форме и объяснить причину изменения электропроводности раствора.
Опыт 4.2.1.4 Влияние одноименного иона на равновесие диссоциации слабого электролита.
а) Налить в пробирку 1 мл разбавленной уксусной кислоты и добавить 2-3 капли индикатора метилового-оранжевого. Раствор окрашивается в розовый цвет. Кислоту разлить в две пробирки. Одну оставить для сравнения, в другую добавить немного твердой соли ацетата натрия и взболтать. Отметить изменение окраски при добавлении соли.
Написать уравнение диссоциации уксусной кислоты, выражение константы ее диссоциации, уравнение диссоциации ацетата натрия. Объяснить причину изменения окраски раствора при добавлении ацетата натрия. В каком направлении сместилось равновесие диссоциации СН3СООН? Как влияют одноименные ионы на степень диссоциации слабых электролитов?
б) Провести опыт аналогично опыту а, взяв вместо разбавленной уксусной кислоты раствор аммиака NH4OH, индикатор фенолфталеин и кристаллы соли NH4Cl. Дать все необходимые объяснения.
