
- •6.051301 “Хімічна технологія” денної і заочної форм навчання
- •6.051301 “Хімічна технологія” денної і заочної форм навчання
- •Передмова
- •Вимоги до звіту лабораторних робіт
- •Техніка безпеки в хімічній лабораторії
- •Методи визначення аміаку в газах
- •1. Теоретичні відомості
- •2. Обладнання і хімічні реактиви
- •3 Опис лабораторної установки
- •4. Послідовність виконання роботи і проведення розрахунків
- •5. Техніка безпеки
- •6 Контрольні питання
- •7 Література
- •Конверсія оксиду вуглецю (II)
- •1 Теоретичні відомості
- •2 Обладнання і хімічні реактиви
- •3 Опис лабораторної установки, послідовність виконання роботи і проведення розрахунків
- •Опис приладу
- •Підготовка приладу до роботи
- •Відбір проби на аналіз
- •Проведення аналізу
- •4. Техніка безпеки
- •5. Контрольні питання
- •6. Література
- •Аналітичний контроль нітрозних газів
- •1. Теоретичні відомості
- •2 Обладнання і хімічні реактиви
- •3. Опис лабораторної установки
- •4 Послідовність виконання роботи і проведення розрахунків
- •5 Техніка безпеки
- •6 Контрольні питання
- •7 Література
- •Каталітичне окиснення аміаку
- •1 Теоретичні відомості
- •2 Обладнання і хімічні реактиви
- •3 Опис лабораторної установки
- •4 Порядок виконання роботи і проведення розрахунків
- •5 Техніка безпеки
- •2. Обладнання та хімічні реактиви
- •3. Порядок виконання роботи
- •4 Опрацювання результатів
- •5 Техніка безпеки
- •6 Контрольні питання
- •7 Література
- •Абсорбція оксидів азоту в пінному апараті
- •1 Теоретичні відомості
- •2 Обладнання і хімічні реактиви:
- •3 Опис лабораторної установки
- •4. Порядок виконання роботи і проведення розрахунків
- •5 Техніка безпеки
- •6 Контрольні питання
- •7 Література
- •Аналіз азотної кислоти
- •1 Теоретичні відомості
- •2 Обладнання і хімічні реактиви:
- •3 Опис лабораторної установки
- •4. Техніка безпеки
- •5. Контрольні питання
- •6. Література
- •1 Умови виконання вимірювань
- •2 Приготування розчинів
- •3. Приготування градуювальних розчинів
Підготовка приладу до роботи
Перед початком роботи необхідно видалити з приладу повітря (або газ). Для цього за допомогою напірної склянки 3 і кранів 5 і 9 установлюють поглинальні розчини на рівні міток, нанесених на капілярній трубці кожної поглинальної посудини.
Треба звернути особливу увагу на те, щоб рівень рідини у поглинальних посудинах і особливо у капілярних трубках піднімався повільно і рідина не попадала у гребінку. Якщо поглинальні розчини у посудинах 6, 7 і 8 доведені до мітки, прилад потрібно перевірити на герметичність. Для цього (попередньо поставивши усі крани у положення 1) витискають газ з вимірювальної бюретки (кран 9 при цьому знаходиться у положенні 2), доводячи рівень рідини у бюретці до верхньої мітки. Після цього кран 9 ставлять у положення 3, а порівняльну склянку 3 – на нижню полицю приладу. Якщо рівень рідини у поглинальних посудинах і у бюретці спочатку трохи опуститься внаслідок створюваного розрідження, а потім залишиться постійним, то прилад герметичний.
Відбір проби на аналіз
Для заповнення вимірювальної бюретки газом, попередньо зєднують гумовою трубкою відросток А крана 9 з газометром, що містить досліджуваний газ, ставлять кран 9 у положення 1 і, поступово опускаючи напірну склянку, наповнюють вимірювальну бюретку газом.
Враховуючи те, що в газорозподільчій системі, тобто гребінці, є повітря, яким газ може бути розбавлено, необхідно гребінку промити газом. Для цього перед відбором робочої проби газу на аналіз частину бюретки 1-2 рази наповнюють досліджуваним газом (20-25 см3) і потім випускають цей газ з системи у атмосферу крізь кран 9.
Під час заміру об'єму газу напірну склянку потрібно держати біля бюретки, а рівні рідини у бюретці і напірній склянці повинні бути на одній висоті, цим зрівноважують тиск у бюретці з атмосферним. Після відбору проби газу для аналізу прилад ізолюється від джерела газу установкою крана в положення 4.
Увага! Під час установки крана в положення 4 газ із газометра вільно проходить в атмосферу за направленням АВ. (рисунок 3). Тому після відбору газу лінія подачі газу негайно перекривається зажимами на гумових з'єднувальних трубках і кранами на газометрах.
Проведення аналізу
Аналіз газу починають з визначення вмісту СО2, пропускаючи газ у посудину 6 з розчином КОН. Для цього кран, який поєднує гребінку з поглинальною посудиною 6, ставлять у положення 2 та, повільно піднімаючи і опускаючи напірну склянку, перепускають газ із бюретки у посудину і навпаки. Після трьох-чотирикратного пропускання газу через поглинальну посудину доводять рівень розчину КОН у поглиначі до верхньої мітки і ставлять кран у положення 1. Напірну склянку піднімають на висоту, при якій рівень рідини у склянці і бюретці буде однаковим, і замірюють рівень розчину у вимірювальній бюретці. Потім вказану процедуру повторюють і знову визначають рівень розчину в бюретці. Якщо рівень не змінився або змінився менше ніж на 0,2 см3, то поглинання вважають закінченим. У випадку, коли спостерігається більша різниця у рівнях, визначення повторюють до виконання зазначеної умови. Записують об'єм поглиненого газу по вихідній (лівій) шкалі або об'єм газу, що залишився згідно з правою шкалою. Аналогічно (з обов'язковим виконанням контрольних прокачувань) виконується поглинання О2 у посудині 7 і поглинання СО у посудині 8.
Одним із факторів, що впливає на рівновагу реакції (1), є об'ємне співвідношення Н2О(пара) вихідний газ.
При невеликій
кількості вихідного газу, що пропускається
крізь парозмішувач, можна у першому
наближенні вважати, що об'ємне
співвідношення Н2О(пара):
вихідний газ
визначається, в основному, парціальним
тиском водяної пари (рв.п.),
залежним від температури в парогазозмішувачі
(див. таблицю 4), у якій наведені такі
парціальні тиски газу (рг)
і відношення![]() для відповідних температур.
для відповідних температур.
Зв’язок між об'ємним відношенням Н2О (пара): СО, яке ми зазначимо через n і об'ємним відношенням Н2О (пара): вихідний газ, рівним (див. таблицю 2.1), установлюється формулою:
![]()
де V-вміст СО у вихідному газі, % об.
Перетворюючи формулу 11, отримуємо розрахунковий вираз
![]()
Підставляючи у вираз 12 значення n, задане викладачем, і значення V, визначене при аналізі вихідної газової суміші, отримуємо робоче відношення
![]() ,
за яким за допомогою таблиці 1 знаходимо
температуру у парагазозмішувачі.
,
за яким за допомогою таблиці 1 знаходимо
температуру у парагазозмішувачі.
Визначення теоретичного ступеню конверсії СО
Стан рівноваги (реакція 4) визначається температурою і концентрацією реагуючих речовин і може бути розрахований за допомогою виразу для константи рівноваги
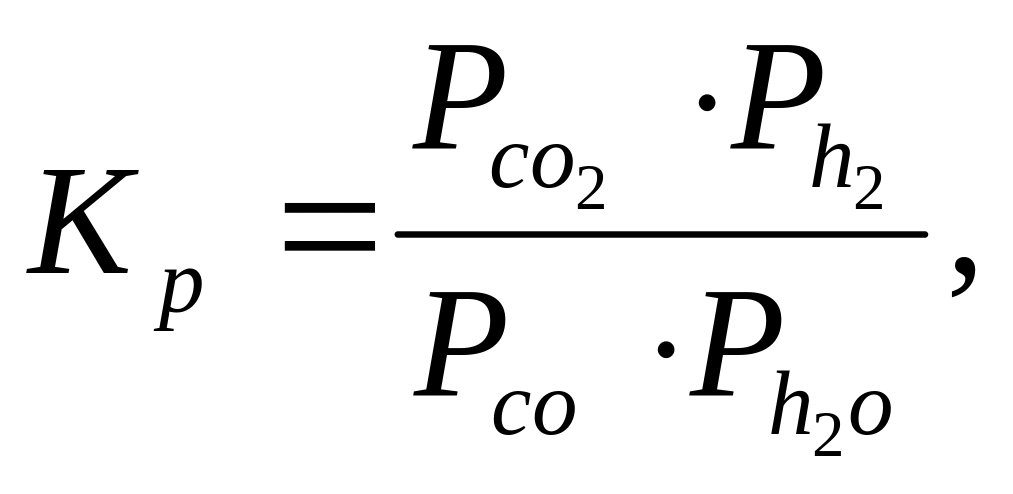
де
![]() - парціальні тиски відповідних компонентів
газової суміші. Визначаючи через х
рівноважну ступінь конверсії СО,
отримаємо
- парціальні тиски відповідних компонентів
газової суміші. Визначаючи через х
рівноважну ступінь конверсії СО,
отримаємо
Кр=![]() .
.
Числові значення величини Кр для різних температур знаходяться за рівнянням:
lgКр=![]()
Значення Кр для деяких температур розраховані за рівнянням 15, а також розраховані на їх підставі за допомогою формули (14), значення величини х при змінах відношення Н2О(пара):СО наведені у таблиці 2.
Знаючи задані викладачем температуру процесу і об’ємне (мольне) відношення Н2О(пара):СО, за допомогою таблиці 2 легко знайти теоретичний (рівноважний) ступінь конверсії СО.
Визначення практичного ступеню конверсії СО
Практичну ступінь конверсії СО хпр в частках одиниці розраховують за формулою
Хпр=![]() ,
,
де m – кількість СО, що прореагував на 100 см3 вихідного газу, см3.
Величина m визначається за процентним вмістом СО в конвертованому газі (d) і у вихідному газі (V), виходячи з того, що збільшення об'єму конвертованого газу дорівнює об’єму СО, що прореагував.
Звідси
![]() ,
,
![]() ,
,
![]()
Отримане значення порівнюють з максимальним (рівноважним) значенням х і визначають відносний ступінь конверсії СО хвідн. за виразом
хвідн.=![]()
Таблиця 2.1 Залежність співвідношення пар:газ від температури в парозмішувачі
Темпе- ратура, оС |
Рвп, Па |
Рг, Па |
|
Темпе- ратура, оС |
Рвп, Па |
Рг, Па |
|
85 86 87 |
57771 60074 62446 |
43483 41180 38808 |
1,33 1,46 1,61 |
93 94 95 |
78420 81389 84437 |
22834 19865 16797 |
3,43 4,10 5,03 |
88 89 90 |
64896 67424 70050 |
36358 33830 31203 |
1,78 1,99 2,24 |
96 97 98 |
87612 90875 94237 |
13642 10378 7017 |
6,42 8,76 13,43 |
91 92 |
72755 75538 |
28498 25715 |
2,55 2,94 |
99 100 |
97686 101254 |
3567 0 |
27,38 |
Таблиця 2.2 Залежність рівноважного ступеню перетворення СО від температури, константи рівноваги та мольного співвідношення Н2О:СО
Температура, оС Константа рівноваги Кр |
400 |
450 |
500 |
550 |
600 |
|
12,27 |
7,67 |
5,11 |
3,60 |
2,64 |
||
Рівноважний ступінь Перетворення СО(х) при мольному співвідношенні Н2О : СО, що дорівнює: |
1:1 2:1 |
0,778 0,933 0,963 0,974 0,98 0,984 0,987 |
0,7350 0,9030 0,9440 0,9600 0,9700 0,9750 0,9790 |
0,693 0,869 0,920 0,943 0,956 0,964 0,970 |
0,655 0,834 0,895 0,923 0,940 0,950 0,958 |
0,619 0,799 0,867 0,901 0,921 0,935 0,944 |
