
- •Биологическая роль белков и пептидов: ферментативная, интегративная, иммунологическая, структурная, сократительная, гемостатическая.
- •Методы разделения и очистки белков.
- •Ферменты – белки, выполняющие роль катализаторов.
- •Биологическая роль активных форм кислорода:
- •Гормональная регуляция уровня глюкозы в крови. Гипергликемические гормоны: адреналин, глюкагон, глюкокортикоиды. Гипогликемические: инсулин.
- •Концентрация глюкозы как интегральный показатель углеводного обмена в организме.
- •Липопротеины – транспортная форма липидов. Это комплекс из липидов и апобелков.
- •Липолиз. Бета-окисление высших жирных кислот:
- •Переваривание белков в желудке.
- •Основные пути использования аминокислот в организме.
- •Дезаминирование аминокислот.
- •Глютамин как транспортная форма аммиака. Система глутамин-глутаминаза в клетках печени и почечных канальцев, биороль, связь с образованием конечных продуктов обмена аммиака.
- •Образование катехоламинов. Роль гидроксилирования, декарбоксилирования и метилирования в этом процессе. Биологическая роль катехоламинов.
- •Понятие о нуклеопротеидах, их превращения в желудочно-кишечном тракте. Строение, биологическая роль, особенности обмена мононуклеотидов в организме человека.
- •Регуляция клеточного цикла и репликации. Роль циклинов и белка р53.
- •Вот что говорит Вика.
- •Механизмы регуляции транскрипции. Примеры воздействия на процессы биосинтеза белка лекарственными препаратами.
- •ВитаминВ1 (тиамин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •В2 (рибофлавин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин в5 (никотинамид). Активные формы витамина. Участие в биохимических реакциях. Проявление недостаточности. Фармакологическое действие витамина в5.
- •Витамин в6 (пиридоксин), Витамин в9 (фолиевая кислота) и в12 (цианокобаламин). Активные формы витаминов. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин с (аскорбиновая кислота). Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин а (ретинол). Роль в процессах светоощущения, обмена эпителия, эндотелия и соединительной ткани. Проявления недостаточности.
- •Белки межклеточных контактов и адгезии. Хемокины.
- •Гистогормоны (гистамин, серотонин, гастрин, секретин, холецистокинин, натрийуретический пептид). Клетки-продуценты, пути передачи сигналов, биологическая роль.
- •Инсулин. Глюкагон. Химическая природа, образование, ткани-мишени. Влияние инсулина на углеводный, белковый и липидный обмены.
- •Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
- •Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
- •Гормональная регуляция репродуктивной функции организма.
- •Основные компоненты внеклеточного матрикса соединительных тканей: коллагеновые волокна, эластиновые волокна, глюкозамингликаны, протеогликаны. Структура и роль.
- •Механизм синтеза и распада коллагена. Промежуточные продукты маркеры резорбции и образования костной ткани.
- •Костная ткань как твердая разновидность соединительной ткани, ее основные функции. Особенности структуры гидроксиапатита и их связь с биологической функцией костной ткани.
- •Понятие об остеомаляции и остеопорозе, возможных причинах их развития.
- •Участие печени в обмене белков.
- •Желчеобразующая функция печени. Состав и функции желчи. Гепатоэнтеральная циркуляция желчных кислот. Биосинтез желчных кислот и их роль.
- •Экзогенные и эндогенные субстраты детоксикации. Реакции гидроксилирования (микросомальная система окисления) и конъюгации.
- •Общая схема регуляции эндотелием адаптивных реакций сосудистой стенки. Роль эндотелия в регуляции структурных изменений сосудистой стенки, ангиогенезе, гемостаза.
- •Оксид азота и супероксид. Пути образования и инактивации. Эндотелин 1. Схема образования, эффекты на тонус сосудов в норме и при повышенной продукции.
- •Метаболические особенности миокарда: механизм сокращения миоцитов, основные энергетические субстраты и пути их утилизации. Роль миоглобина и креатинфосфата в энергетическом обмене миокарда.
- •Эритроциты, место образования и распада. Регуляция эритропоэза эритропоэтином. Особенности метаболизма эритроцитов и структуры их мембран.
- •Обмен железа. Лабораторные показатели дефицита железа в организме. Понятие о физиологической желтухе новорожденных.
- •Механизм адгезии и агрегации тромбоцитов. Фактор Виллебранда: структура, участие в гемостазе. Тромбоксан простациклин: схема синтеза, участие в гемостазе.
- •Связывание с рецептором
- •Модуляция синаптической нейротрансмиссии
- •Интеграция синаптических входов
- •Гамма-аминомасляная кислота
- •Гематоэнцефалический барьер
Дезаминирование аминокислот.
Ну, дезаминирвоание это есть отщепление аминогруппы от аминокислоты с образованием альфа-кетокислоты и аммиака… НЕОЖИДАННО, НЕПРАВДА ЛИ???
Реакции прямого и непрямого окислительного дезаминирования, ферменты, механизм, продукты реакций. Прямому дезаминированию подвергается токо глутамат. Он под действием глутаматдегидрогеназы (NAD зависимый фермент) идёт в альфа кетоглутарат и аммиак. Ну тут есть ещё промежуточный продукт альфа-иминоглутарат, но сделаем вид будто его нет.
Непрямому дезаминированию, видимо, подвергается всё остальное. Тут ваще легко. Есть аминокислота и альфа-кетоглутарат. Аминогруппа от аминокислоты идёт к альфа кетоглутарату (аминоксилота пошла в альфа-кетокислоту), который соответственно теперь уже глутамат. А тут теперь глутаматдегидрогеназа (прямое дезаминирование). То есть, непрямое дезаминирование – это вначале трансаминирование, а затем прямое дезаминирование. Здесь вас скорей всего спросят про АЛТ и АСТ, смотрите ниже
Пути превращений альфа-кетокислот на примере пирувата. Пируват может декарбоксилирвоаться до Ацетил-КоА, который затем идёт в ЦТК или может использоваться для синтеза кетоновых тел, может участвовать в трансаминировании для синтеза заменимых аминокислот, идти на синтез глюкозы.
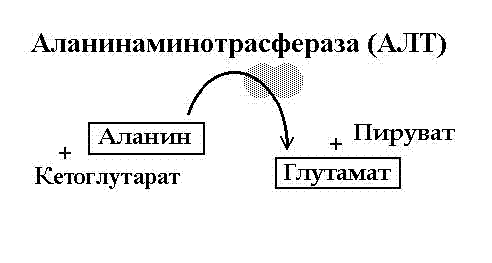
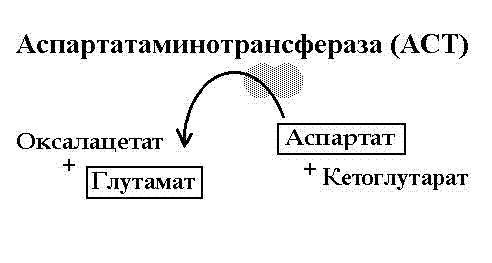
Реакция трансаминирования (написать реакции с участием аланин- и аспартатаминотрансфераз).
Трансаминирование – это перенос альфа-аминогруппы с аминокислоты на альфакетокислоту, в результате чего образуется другая аминокислота и альфа-кетокислота. У аминотрансфераз всегда есть пиридоксальфосфат.
 Биологическая
роль – образование заменимых аминокислот
и альфа-кетокислот.
Биологическая
роль – образование заменимых аминокислот
и альфа-кетокислот.
Клинико-диагностическое значение определения АЛТ и АСТ в сыворотке крови. АСТ и АЛТ в наибольшем количестве есть в печени и сердце, при чём в сердце больше АСТ, а в печени – АЛТ. Если есть какая-то патология с сердцем или печенью – в крови резко повышается количество этих ферментов.
Аммиак: пути образования Аммиак берётся при дезаминировании аминоксилот, биогенных аминов, при гниении белков в кишечнике.
механизм токсического действия Аммиак вреден так как сдвигает реакцию прямого дезаминирования в сторону образования глутамата из альфа-кетоглутарата и аммиака, хотя в норме идёт наоборот. Напомню, что альфа-кетоглутарат учавствует в ЦТК, а если он будет постоянно переходить в глутамат, не завершая Цикл трикарбоновых кислот, то у нас не будет энергии чтобы жить… sad, but true.
пути обезвреживания. Синтез глутамина из глутамата и аммиака(используется атф до АДФ) Он проходит в мышцах, мозге и печени. Далее глутамин попадает в кровь и идёт в кишечник и в почки. И там и там он распадается на тот же глутамат и аммиак, который уходит или с фекалиями, или в виде солей аммония. Также глутамин может идти на синтез многих соединений.
Синтез аспарагина из аспартата и аммиака (используется АТФ до АМФ).
Синтез мочевины и её вывод.
Синтез аланина из пирувата и аминогруппы глутамата. Аланин идёт в печень, где идёт распад на аммиак и пируват. Аммиак в мочу.
