
- •Биологическая роль белков и пептидов: ферментативная, интегративная, иммунологическая, структурная, сократительная, гемостатическая.
- •Методы разделения и очистки белков.
- •Ферменты – белки, выполняющие роль катализаторов.
- •Биологическая роль активных форм кислорода:
- •Гормональная регуляция уровня глюкозы в крови. Гипергликемические гормоны: адреналин, глюкагон, глюкокортикоиды. Гипогликемические: инсулин.
- •Концентрация глюкозы как интегральный показатель углеводного обмена в организме.
- •Липопротеины – транспортная форма липидов. Это комплекс из липидов и апобелков.
- •Липолиз. Бета-окисление высших жирных кислот:
- •Переваривание белков в желудке.
- •Основные пути использования аминокислот в организме.
- •Дезаминирование аминокислот.
- •Глютамин как транспортная форма аммиака. Система глутамин-глутаминаза в клетках печени и почечных канальцев, биороль, связь с образованием конечных продуктов обмена аммиака.
- •Образование катехоламинов. Роль гидроксилирования, декарбоксилирования и метилирования в этом процессе. Биологическая роль катехоламинов.
- •Понятие о нуклеопротеидах, их превращения в желудочно-кишечном тракте. Строение, биологическая роль, особенности обмена мононуклеотидов в организме человека.
- •Регуляция клеточного цикла и репликации. Роль циклинов и белка р53.
- •Вот что говорит Вика.
- •Механизмы регуляции транскрипции. Примеры воздействия на процессы биосинтеза белка лекарственными препаратами.
- •ВитаминВ1 (тиамин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •В2 (рибофлавин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин в5 (никотинамид). Активные формы витамина. Участие в биохимических реакциях. Проявление недостаточности. Фармакологическое действие витамина в5.
- •Витамин в6 (пиридоксин), Витамин в9 (фолиевая кислота) и в12 (цианокобаламин). Активные формы витаминов. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин с (аскорбиновая кислота). Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин а (ретинол). Роль в процессах светоощущения, обмена эпителия, эндотелия и соединительной ткани. Проявления недостаточности.
- •Белки межклеточных контактов и адгезии. Хемокины.
- •Гистогормоны (гистамин, серотонин, гастрин, секретин, холецистокинин, натрийуретический пептид). Клетки-продуценты, пути передачи сигналов, биологическая роль.
- •Инсулин. Глюкагон. Химическая природа, образование, ткани-мишени. Влияние инсулина на углеводный, белковый и липидный обмены.
- •Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
- •Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
- •Гормональная регуляция репродуктивной функции организма.
- •Основные компоненты внеклеточного матрикса соединительных тканей: коллагеновые волокна, эластиновые волокна, глюкозамингликаны, протеогликаны. Структура и роль.
- •Механизм синтеза и распада коллагена. Промежуточные продукты маркеры резорбции и образования костной ткани.
- •Костная ткань как твердая разновидность соединительной ткани, ее основные функции. Особенности структуры гидроксиапатита и их связь с биологической функцией костной ткани.
- •Понятие об остеомаляции и остеопорозе, возможных причинах их развития.
- •Участие печени в обмене белков.
- •Желчеобразующая функция печени. Состав и функции желчи. Гепатоэнтеральная циркуляция желчных кислот. Биосинтез желчных кислот и их роль.
- •Экзогенные и эндогенные субстраты детоксикации. Реакции гидроксилирования (микросомальная система окисления) и конъюгации.
- •Общая схема регуляции эндотелием адаптивных реакций сосудистой стенки. Роль эндотелия в регуляции структурных изменений сосудистой стенки, ангиогенезе, гемостаза.
- •Оксид азота и супероксид. Пути образования и инактивации. Эндотелин 1. Схема образования, эффекты на тонус сосудов в норме и при повышенной продукции.
- •Метаболические особенности миокарда: механизм сокращения миоцитов, основные энергетические субстраты и пути их утилизации. Роль миоглобина и креатинфосфата в энергетическом обмене миокарда.
- •Эритроциты, место образования и распада. Регуляция эритропоэза эритропоэтином. Особенности метаболизма эритроцитов и структуры их мембран.
- •Обмен железа. Лабораторные показатели дефицита железа в организме. Понятие о физиологической желтухе новорожденных.
- •Механизм адгезии и агрегации тромбоцитов. Фактор Виллебранда: структура, участие в гемостазе. Тромбоксан простациклин: схема синтеза, участие в гемостазе.
- •Связывание с рецептором
- •Модуляция синаптической нейротрансмиссии
- •Интеграция синаптических входов
- •Гамма-аминомасляная кислота
- •Гематоэнцефалический барьер
Липопротеины – транспортная форма липидов. Это комплекс из липидов и апобелков.
Биологическая роль: липиды гидрофобны и потому не могут спокойно плыть себе по крови, которая вода. Поэтому существуют липопротеины, роль которых – транспорт липидов из ткани в ткани.
Место образования, строение, состав: Все липопротеины состоят из гидрофобного ядра (эфиры холестерина, ТАГ) и гидрофильного слоя на поверхности (апопротеины, фосфолипиды, холестерин). Апобелки:
- эмульгируют жиры, т.е. растворяют жиры в плазме крови.
- регулируют активность ферментов липидного обмена
- некоторые апобелки сами обладают ферментативной активностью
- играют роль сигнальных молекул
Хиломикроны: образуются в тонком кишечнике, в составе преобладают ТАГ (85%). Из апобелков: B-48, C-2, E. Функция – транспорт экзогенных ТАГ.
Липопротеины очень низкой плотности (ЛПОНП) – также преобладает ТАГ, но его уже меньше. Образуются в печени. Апопротеины: B-100, C-2, E. Функция – транспорт эндогенных жиров.
ЛП низкой плотности (ЛПНП) – преобладает холестерин и его эфиры. Апопротеины: В-100. Образуются в крови из ЛПОНП. Функция – транспорт холестерина от печени в периферические ткани.
ЛП высокой плотности (ЛПВП) – преобладает белок. Апопротеины: А-1, С-2, Е. Предшественники образуются в печени, сами ЛПВП (полноценные) образуются в тканях. Функция – транспорт избыточного холестерина из периферических тканей в печень.
Метаболические превращения:
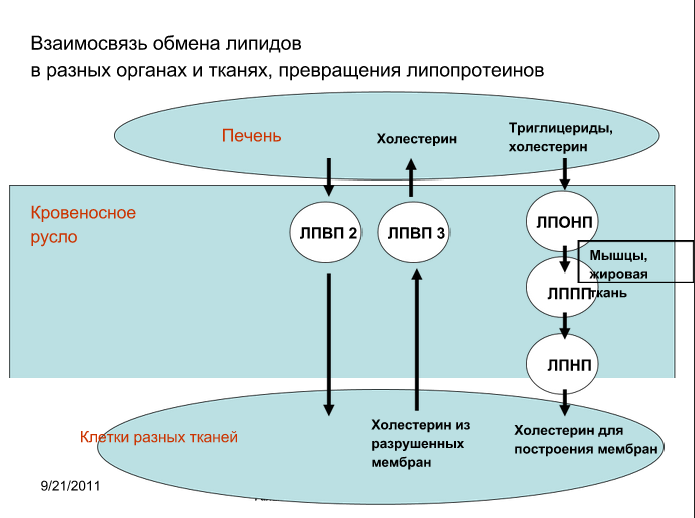
Пояснения: ЛПОНП синтезируется в печени, в кровотоке под действием ЛП-липазы разрушаются, ТАГ в большинстве своём идут в мышцы и жировую ткань, то, что осталось от ЛПОНП переходит в ЛППП (промежуточной плотности), а затем в ЛПНП. ЛПНП переносят холестерин из печени в ткани. ЛПВП предшественник синтезируется в печени, доходит до тканей, набирается холестерина, превращается в ЛПВП3 и несёт холестерин в печень. Когда он дошёл до печени он отдаёт холестерин и превращается в ЛПВП2, который снова может идти к тканям для транспорта холестерина.
Роль С-2, В100, Е и А-1 апопротеинов: С-2 активирует ЛП-липазу; В100 является основным структурным белком ЛПОНП, НП, взаимодействует с рецепторами ЛПНП; Е взаимодействует с рецепторами ЛПНП; А-1 активирует лецитинхолестеролацилтрансферазу (ЛХАТ – превращает холестерол в эфиры холестерола)
Липолиз. Бета-окисление высших жирных кислот:
Пояснение: у нас есть ВЖК с количеством углеродов в цепи n. В результате этих 4 реакций у нас получается ацетил-КоА и эта же самая ВЖК, только с количеством углеродов в цепи (n-2) (2 атома ушло на ацетил-КоА). Эта кислота снова вступает в цикл. Таким образом ВЖК будет снова и снова вступать в цикл, пока полностью не расщепиться.
Биологическое значение: образуется много энергии и Ацетил-КоА, который может идти на синтез многих соединений или опять же на туже энергию.
Локализация в клетке: митохондрии
Энергетический эффект: напрямую зависит от ВЖК. Я провёл несколько лет в секретном НИИ, проводя сложные математические вычисления, и вывел формулу для подсчёта количества АТФ в зависимости от количества углеродов (n) в ВЖК: 5*((n/2)-1)+12*(n/2). Что такое? Эта формула не понятна для тебя, мой не совсем алгебраичный друг? Я мог бы её объяснить, но это очень долго. Просто запомни – из пальмитиновой кислоты при бета окислении образуется 131 АТФ. После этого экзаменатор должен быть удовлетворён.
Распад глицерина. Схема процесса:
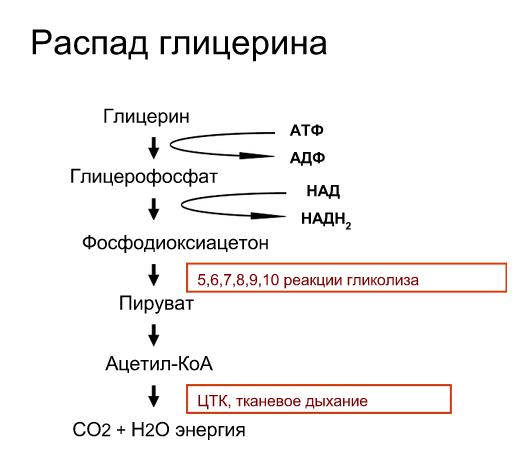
Энергетический эффект: 1 АТФ расходуется, NADH2 даёт 3 АТФ, образуется два пирувата, что даёт 30 АТФ. (если у тебя вопрос «А ОТКУДА ДВА ПИРУВАТА???» то я отвечу тебе – повтори аэробный гликолиз – в 6 реакции у нас образуется два продукта реакции из одного субстрата)
И того 32 АТФ.
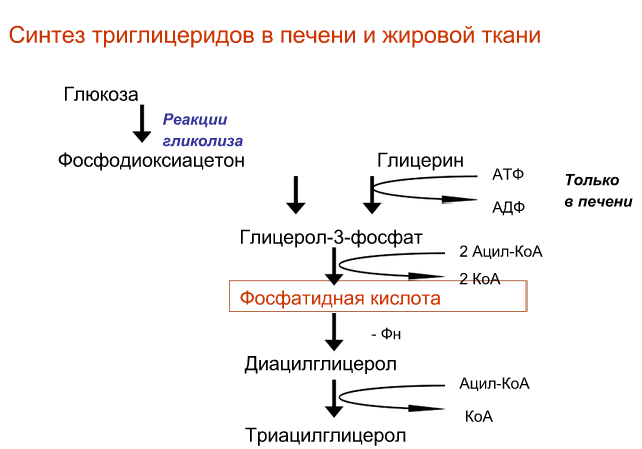
Анаболические превращение глицерина: глицерин используется для синтеза триацилглицеринов, глюкозы
Липогенез в печени и жировой ткани.
Виды жировой ткани, особенности метаболизма: есть белая и есть бурая жировая ткань. Ткань эта состоит из адипоцитов. Белая жировая ткань играет роль запаса ТАГ, теплоизоляционную, защитную и эндокринную (лептин). В адипоцитах большую часть занимает жировая капля (ТАГ), органоиды вытеснены на периферию. Адипоциты бурой жировой ткани богаты митохондриями, из-за чего и имеют бурый цвет. Основная функция бурой ткани – выработка тепла. Её много у детей и у животных, впадающих в спячку. У взрослых человеков её почти нет.
Ожирение – чрезмерное увеличение массы тела за счёт жировой ткани.
Роль лептина: лептин вырабатывается в адипоцитах и действие его заключается в том, что он снижает порог возбудимости для центра насыщения и поднимает его для центра голода (тоесть, грубо говоря, насыщаемся мы быстрее, голод испытываем позже и слабее). Если лептина вырабатывается недостаточно, то чувство насыщения при приёме адекватного количества пищи не возникает, и человек вынужден переедать. Но к тебе это, скорей всего, не относится – ты жирный просто потому что слабак. И я тоже :(
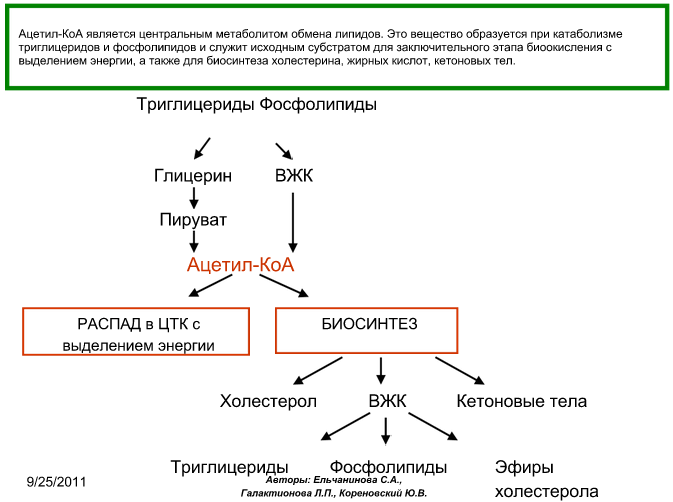
Кетогенез:

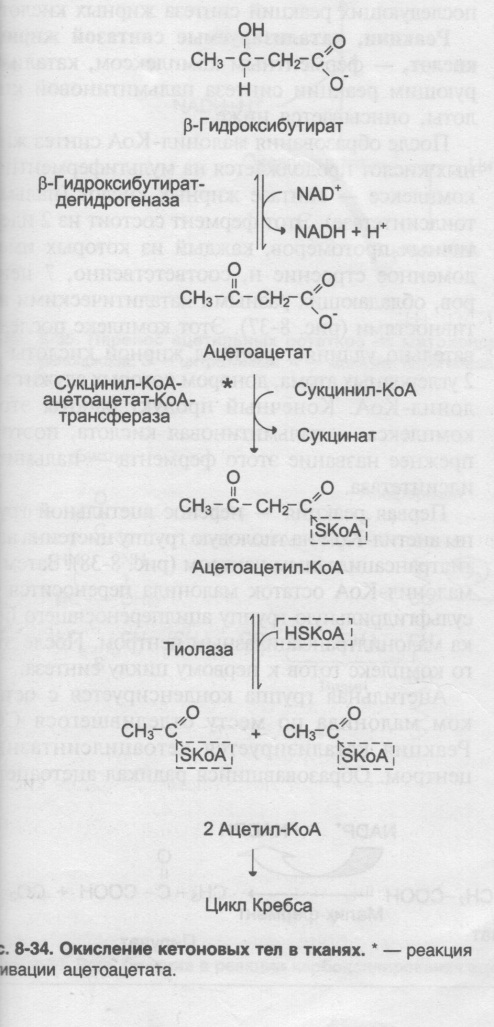
При низком соотношении инсулин/глюкагон в жировой ткани активируется распад жиров. Жирные кислоты в большом количестве поступают в печень, где распадаются до большого количества ацетил-КоА, больше, чем может вступить в цикл Кребса. Поэтому избыток идёт на синтез кетоновых тел. В крови в основном встречается бета-гидроксибутират, ацетоацетата меньше. В крови ацетоацетат может неферментативно декарбоксилироваться, в результате чего образуется Ацетон. Он не используется для окисления, выводится лёгкими и почками.
Биологическая роль: при длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца, почек.
Эйкозаноиды. Роль фосфолипазы А2, циклооксигеназы, липооксигеназы в образовании простагландинов, тромбоксанов, лейкотриенов. Биологическая роль эйкозаноидов. Лекарственные вещества – ингибиторы циклооксигеназы.
Буду отвечать не по порядку вопроса, а по порядку образования. Есть мембрана. На мембране есть фосфолипиды. Некоторые их них могут иметь арахидоновую кислоту во второй позиции. Что значит вторая позиция? Господи, сейчас вам нарисую.
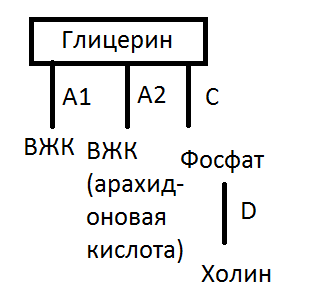
Как видно, арахидоновая кислота находится в А2 позиции. Поэтому фермент, который отщепляет арахидоновую кислоту назван фосфолипаза А2.
Дальше арахидоновая кислота может пойти по двум путям.
1. Пойти в простогландины под действием циклооксигеназы. Действие разное. Например PG E2 расслабляет гладкую мускулатуру, тем самым расширяя сосуды. Если простогландин имеет два кольца в своей структуре, то он уже не просто простогландин, он уже простациклин PG I2 подавляет агрегацию тромбоцитов, расширяет сосуды.
В тромбоцитах из простагландинов синтезируются тромбоксаны. Только в них! TX A2 например стимулирует агрегацию тромбоцитов, сужает сосуды
2. Под воздействием липоксигеназы может пойти в лейкотриены. Выделяются лейкоцитами. Активируют хемотаксис и агрегацию тромбоцитов, сужают бронхи.
Также нужно знать, что эйкозаноиды участвуют в воспалении.
В качестве противовоспалительных средств используются ингибиторы циклооксигеназы – это препараты нестироидного действия, например аспирин. Поскольку циклооксигеназа ингибируется, то арахидоновая кислота идёт в образование лейкотриенов. А если у вас астма? Ведь лейкотриены сужают бронхи! Для этого есть лекарственные препараты стероидного действия, которые ингибируют непосредственно фосфолипазу А2. Ну это так, многие преподаватели любят задавать такой вопрос, да и для общего развития полезно.
Понятие о синтезе высших жирных кислот в организме человека: организм синтезирует заменимые ВЖК из ацетил-КоА, который образуется при распаде глюкозы. То есть синтезируемые ВЖК нужны нам для запаса излишков углеводов, поступающих с пищей (ну кроме там всяких структурных функций)
Локализация: в основном в печени, меньше в жировой ткани и сись.. ой, простите, лактирующих молочных железах. Синтез происходит частично в цитозоле, частично в митохондриях.
Исходные субстраты: ацетил-КоА (не одна молекула, для синтеза пальмитиновой кислоты требуется 8 ацетил-КоА) и NADPH2 как источник атомов водорода.
Типы химических реакций: 1. В митохондриях образование ацетил-КоА из пирувата (декарбоксилирование).
2. ацетил-КоА + оксалоацетат = цитрат + HS KoA. (цитратсинтаза) (конденсация)
3. транспорт цитрата из митохондрий в цитозоль.
4. Цитрат + HS-KoA +АТФ = Ацетил-КоА + АДФ + Pi + оксалоацетат
5. Образование малонил- КоА из ацетил-КоА (ацетил-КоА-карбоксилаза) (карбоксилирование)
6. Синтез пальмитиновой кислоты с помошью синтазы жирных кислот (пальмитатсинтазы). Там много тонкостей, но, думаю, будет достаточно сказать, что синтез идёт путём последовательного присоединения малонил-КоА к субстрату, пока не образуется пальмитиновая кислота.
7. На основе пальмитиновой кислоты в эндоплазматическом ретикулуме образуется другие заменимые ВЖК по тому же типу, что и пальмитиновая кислота, но уже без синтазы жирных кислот.
Роль пальмитатсинтазы: синтез пальмитиновой кислоты идёт непосредственно на этом ферменте. Он может стимулироваться цитратом и инсулином и ингибируется пальмитоил-КоА, глюкагоном и адреналином.
Заменимые и незаменимые жирные кислоты: незаменимые – линолевая и линоленовая. Должны поступать с пищей. Заменимые: пальмитиновая, стеариновая, арахидоновая, олеиновая. Могут синтезироваться.
Строение и биологическая роль холестерина: Холестерин – стероид. Биологическая роль: идёт на синтез многих веществ а также является структурным элементом мембран клеток.
Понятие о синтезе и направлениях превращений холестерина: Синтез холестерина проходит в три этапа.
1 этап. Из ацетил-КоА и ацетоацетил-КоА (который образуется из двух ацетил-КоА при действии тиолазы) образуется ГМГ-КоА. Она превращается в мевалонат под воздействием ГМГ-КоА-редуктазы.
2 этап. Мевалонат, пройдя через множество реакций, разбираться в которых я даже не собираюсь, превращается в сквален. Про этот этап можете сказать, что идёт образование углеродных колец.
3 этап. Сквален под действием циклазы превращается в ланостерол, который проходит через 20 реакций, превращаясь в конце концов в холестерин.
Холестерин используется для синтеза стероидных гормонов, витамина D, желчных кислот.
Роль ГМГ-КоА-редуктазы и липопротеинов в обмене холестерина: ГМГ-КоА-редуктаза является ключевым ферментом синтеза холестерина. Фермент регулируется соотношением инсулин/глюкагон. Когда инсулина много – фермент дефосфорилируется и становится активным. Когда глюкагона много – фермент фосфорилируется и становится неактивным.
Липопротеины: ЛПНП отвечают за транспорт холестерина из печени в ткани, а ЛПВП – из тканей в печень. Важно, чтобы ЛПВП было в достаточном количестве, иначе холестерин будет задерживаться в тканях и как следствие – атеросклероз.
Жировая инфильтрация печени – накопление ТАГ в печени. Причины –
1. Увеличение поступления жира: слишком много жира и углеводов (которые в печени переходят в жиры) поступает с пищей.; голодание (липолиз в жировой ткани, жир идёт в печень.)
2. Уменьшение оттока жира: мало ЛПОНП, мало липотропных факторов.
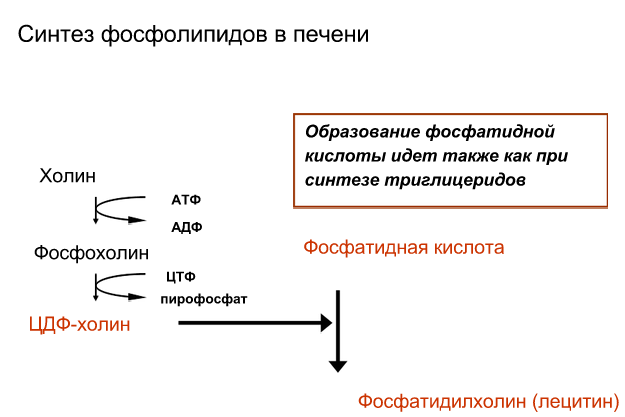
Понятие о липотропных факторах и механизмах их действия: печень может синтезировать из фосфатидной кислоты либо фосфолипиды, либо ТАГ. Фосфолипиды всегда в ходу, а вот ТАГ имеют свойство накапливаться в печени. Поэтому всегда предпочтительней синтезировать именно фосфолипиды. Липотропные факторы этим и занимаются – усиливают синтез фосфолипидов. К липотропным факторам относятся витамины В9 и В12.
Биохимические основы развития атеросклероза.
К тканям липиды у нас несут ЛПНП, а от тканей – ЛПВП. Если у нас много ЛПНП, или мало ЛПВП, или и то и другое вместе (дислипопротеинэмия) – то холестерин задерживается в тканях (его транспортируют в ткани, а от тканей – нет). Это одна из причин развития атеросклероза – нарушения обмена ЛПНП и ЛПВП (снизу написана другая причина – нарушение поглощения ЛПНП тканями. Также причиной может являться избыточное поступление холестерина, нарушения его вывода с желчью). ЛПНП из-за этого называются атерогенными липопротеидами, а ЛПВП – антиатерогенными.
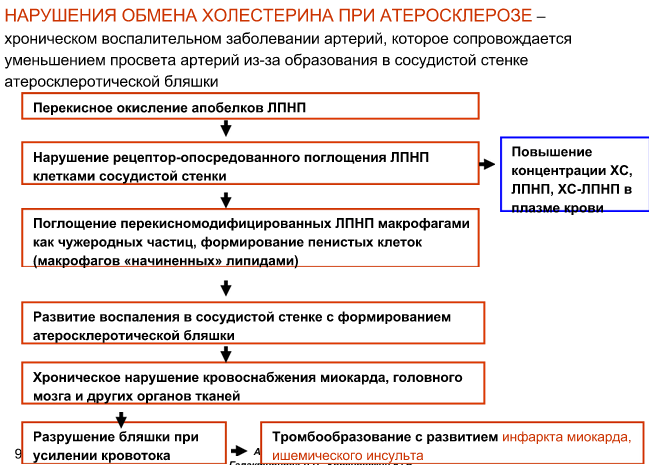
Направления коррекции нарушений липидного обмена: употреблять меньше холестерина (диета – стараться употреблять только растительную пищу, которая не содержит холестерина), принятие C,E,A витаминов (ингибируют перекисное окисление липидов в ЛПНП), принятие секвестрантов желчных кислот (увеличивают вывод желчных кислот с калом, печень вынуждена синтезировать новые из холестерина), принятие препаратов ингибиторов ГМГ-КоА-редуктазы (участвует в синтезе холестерина), принятие фибратов – лекарственные препараты, стимулирующие липопротеин-липазу.
Гормональная регуляция липидного обмена.
Эффекты инсулина: активирует липопротеинлипазу, ацетил КоА карбоксилазу, синтазу жирных кислот
Подавляет ТАГ-липазу.
Короче делает всё, чтобы жир запасался
Адреналина: опосредует свой эффект через усиление секреции глюкагона и снижения секреции инсулина
Глюкагона: стимулирует ТАГ-липазу – мобилизация жира.
Нарушения липидного обмена при сахарном диабете. Механизм развития гиперлипидэмии, кетоза.
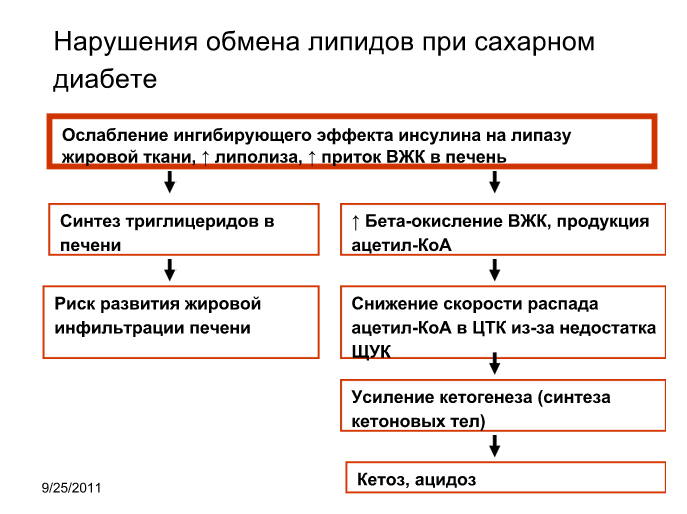
Пояснение для тугоумов: гиперлипидэмия возникает из-за избыточного синтеза ТАГ в печени.
Динамическое состояние белков в организме.
Белки дофига особенные, ибо в отличие от других органических молекул – у них есть срок жизни. По приходу этого срока они нафиг разрываются протеазами на аминокислоты, которые снова идут на синтез белков (ну разве что малое количество уходит). Это и есть динамическое состояние белков.
Заменимые и незаменимые аминокислоты. Незаменимые: фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин.
Частично заменимые (в детском возрасте синтез не идёт): аргинин, гистидин.
Условно заменимые: тирозин и цистеин.
Заменимые: глицин, аспаргат, аспарагин, глутамат, глутамин, серин, пролин, аланин.
Азотистый баланс, его виды. Азотистый баланс – разница между приходом и уходом азота. Бывает нормальный, отрицательный и положительный. Характеризует обмен белков.
Отрицательный азотистый баланс: основные причины развития,
– старение, голодание, тяжёлые болезни.
метаболические последствия
- гипоальбуминэмия
- снижение пролиферации кроветворных клеток
- снижение синтеза апобелков-липопротеинов, как следствие – жировая инфильтрация.
-снижение синтеза ферментов желудочно-кишечного тракта.
возможные клинические проявления: гипоальбуминэмия, анемия, гиполипопротеинэмия.
