
- •Биологическая роль белков и пептидов: ферментативная, интегративная, иммунологическая, структурная, сократительная, гемостатическая.
- •Методы разделения и очистки белков.
- •Ферменты – белки, выполняющие роль катализаторов.
- •Биологическая роль активных форм кислорода:
- •Гормональная регуляция уровня глюкозы в крови. Гипергликемические гормоны: адреналин, глюкагон, глюкокортикоиды. Гипогликемические: инсулин.
- •Концентрация глюкозы как интегральный показатель углеводного обмена в организме.
- •Липопротеины – транспортная форма липидов. Это комплекс из липидов и апобелков.
- •Липолиз. Бета-окисление высших жирных кислот:
- •Переваривание белков в желудке.
- •Основные пути использования аминокислот в организме.
- •Дезаминирование аминокислот.
- •Глютамин как транспортная форма аммиака. Система глутамин-глутаминаза в клетках печени и почечных канальцев, биороль, связь с образованием конечных продуктов обмена аммиака.
- •Образование катехоламинов. Роль гидроксилирования, декарбоксилирования и метилирования в этом процессе. Биологическая роль катехоламинов.
- •Понятие о нуклеопротеидах, их превращения в желудочно-кишечном тракте. Строение, биологическая роль, особенности обмена мононуклеотидов в организме человека.
- •Регуляция клеточного цикла и репликации. Роль циклинов и белка р53.
- •Вот что говорит Вика.
- •Механизмы регуляции транскрипции. Примеры воздействия на процессы биосинтеза белка лекарственными препаратами.
- •ВитаминВ1 (тиамин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •В2 (рибофлавин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин в5 (никотинамид). Активные формы витамина. Участие в биохимических реакциях. Проявление недостаточности. Фармакологическое действие витамина в5.
- •Витамин в6 (пиридоксин), Витамин в9 (фолиевая кислота) и в12 (цианокобаламин). Активные формы витаминов. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин с (аскорбиновая кислота). Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин а (ретинол). Роль в процессах светоощущения, обмена эпителия, эндотелия и соединительной ткани. Проявления недостаточности.
- •Белки межклеточных контактов и адгезии. Хемокины.
- •Гистогормоны (гистамин, серотонин, гастрин, секретин, холецистокинин, натрийуретический пептид). Клетки-продуценты, пути передачи сигналов, биологическая роль.
- •Инсулин. Глюкагон. Химическая природа, образование, ткани-мишени. Влияние инсулина на углеводный, белковый и липидный обмены.
- •Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
- •Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
- •Гормональная регуляция репродуктивной функции организма.
- •Основные компоненты внеклеточного матрикса соединительных тканей: коллагеновые волокна, эластиновые волокна, глюкозамингликаны, протеогликаны. Структура и роль.
- •Механизм синтеза и распада коллагена. Промежуточные продукты маркеры резорбции и образования костной ткани.
- •Костная ткань как твердая разновидность соединительной ткани, ее основные функции. Особенности структуры гидроксиапатита и их связь с биологической функцией костной ткани.
- •Понятие об остеомаляции и остеопорозе, возможных причинах их развития.
- •Участие печени в обмене белков.
- •Желчеобразующая функция печени. Состав и функции желчи. Гепатоэнтеральная циркуляция желчных кислот. Биосинтез желчных кислот и их роль.
- •Экзогенные и эндогенные субстраты детоксикации. Реакции гидроксилирования (микросомальная система окисления) и конъюгации.
- •Общая схема регуляции эндотелием адаптивных реакций сосудистой стенки. Роль эндотелия в регуляции структурных изменений сосудистой стенки, ангиогенезе, гемостаза.
- •Оксид азота и супероксид. Пути образования и инактивации. Эндотелин 1. Схема образования, эффекты на тонус сосудов в норме и при повышенной продукции.
- •Метаболические особенности миокарда: механизм сокращения миоцитов, основные энергетические субстраты и пути их утилизации. Роль миоглобина и креатинфосфата в энергетическом обмене миокарда.
- •Эритроциты, место образования и распада. Регуляция эритропоэза эритропоэтином. Особенности метаболизма эритроцитов и структуры их мембран.
- •Обмен железа. Лабораторные показатели дефицита железа в организме. Понятие о физиологической желтухе новорожденных.
- •Механизм адгезии и агрегации тромбоцитов. Фактор Виллебранда: структура, участие в гемостазе. Тромбоксан простациклин: схема синтеза, участие в гемостазе.
- •Связывание с рецептором
- •Модуляция синаптической нейротрансмиссии
- •Интеграция синаптических входов
- •Гамма-аминомасляная кислота
- •Гематоэнцефалический барьер
Механизм адгезии и агрегации тромбоцитов. Фактор Виллебранда: структура, участие в гемостазе. Тромбоксан простациклин: схема синтеза, участие в гемостазе.
При повреждении сосуда высвобождается фактор Виллербранда (гликопротеид) и обнажается коллаген. Тромбоциты имеют рецепторы к этому фактору, так что в присутствии кальция они связываются с этим фактором, адгезируясь на месте. Когда адгезируются они высвобождают содержимое своих гранул (их действие приведено где-то рядом в другом вопросе). Плюс ко всему тромбоциты способны образовывать ложноножки, которые могут сокращаться, стягивая место поражения. Всё это называется активацией тромбоцитов. А к этому времени и фибрин подспевает. Он связывается с рецепторами тромбоцитов, образуя фибриновые мостики между тромбоцитами. Это называется агрегацией.
Чё? Тромбоксан простациклин? Странно, когда я учил простагландины мне казалось, что тромбоксаны и простациклины разные вещи. Да, так и есть – простациклины и тромбоксаны разные вещи. Ладно. Ща найду ответ из своих старых работ и просто скопирую сюды.
Есть мембрана. На мембране есть фосфолипиды. Некоторые их них могут иметь арахидоновую кислоту во второй позиции. Что значит вторая позиция? Господи, сейчас вам нарисую.
Как видно, арахидоновая кислота находится в А2 позиции. Поэтому фермент, который отщепляет арахидоновую кислоту назван фосфолипаза А2.
Дальше арахидоновая кислота может пойти по двум путям.
1. Пойти в простогландины под действием циклооксигеназы. Действие разное. Например PG E2 расслабляет гладкую мускулатуру, тем самым расширяя сосуды. Если простогландин имеет два кольца в своей структуре, то он уже не просто простогландин, он уже простациклин PG I2 подавляет агрегацию тромбоцитов, расширяет сосуды.
В тромбоцитах из простагландинов синтезируются тромбоксаны. Только в них! TX A2 например стимулирует агрегацию тромбоцитов, сужает сосуды
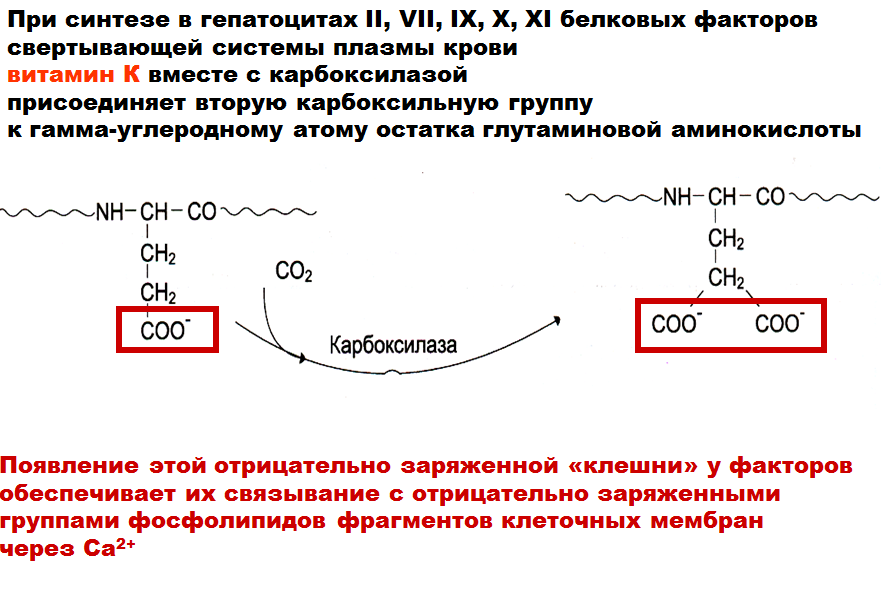
Реакции в свертывающей системе плазмы крови, ведущие к образованию фибрина. Факторы свертывания, строение, место синтеза. Кофакторы. Значение витамина К для синтеза факторов свертывания.
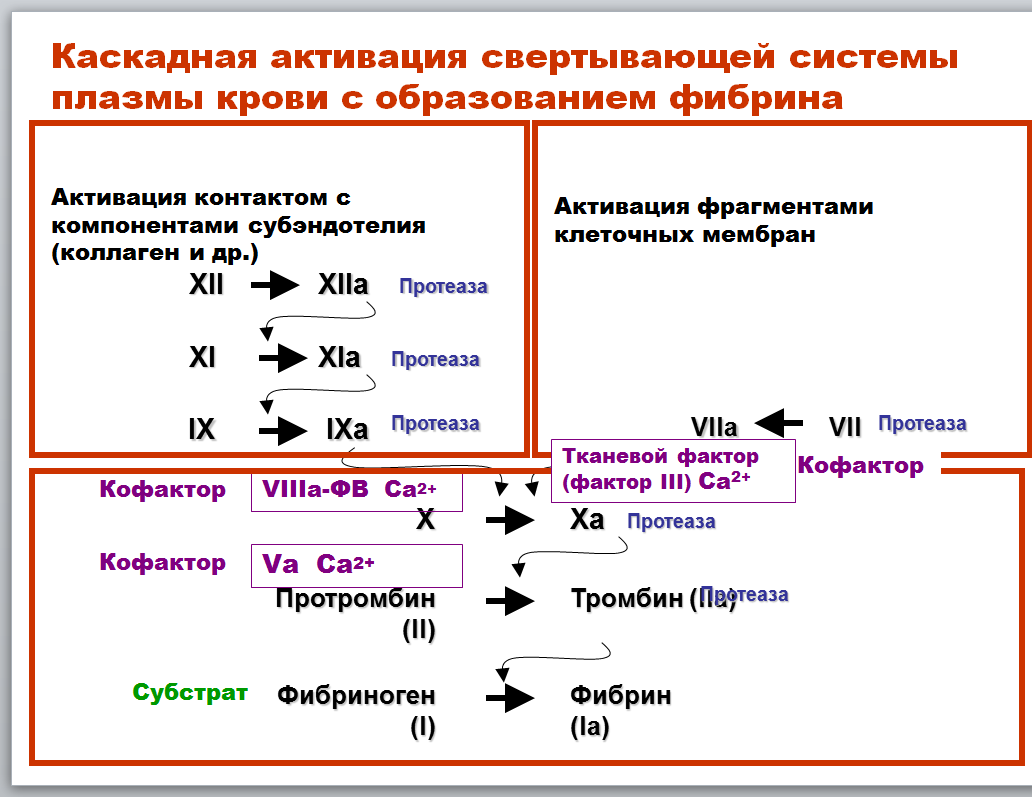
Что касается факторов свёртывания – вы должны были по ним рисовать таблицу. Почти все образуются в печени, являются белками – проферментами (кроме кальция, который ионы), активируются путём ограниченного протеолиза.
Кофакторы – 4 фактор – кальций, 8 – фактор Виллербранда, 5 - акцелерин и 3 фактор – тканевой фактор.
Антикоагулянты (гепарин, антитромбин III, ингибитор тканевого пути свертывания, протеины С и S): химическая природа, место синтеза, механизм действия.
Все белки, вроде.
Гепарин – синтез в базофилах. Активируется при разрушении базофилов. Активирует антитромбин 3.
Антитромбин 3 – синтез в печени и эндотелиоцитах. Активируется гепарином, ингибирует внутренний путь свёртывания и общий этап.
Ингибитор тканевого пути свёртывания: печень, базофилы, выделяется при разрушении базофилов, ингибирует внешний путь активации и общий этап свёртывания.
Протеин С – печень, активируется отсутствием тромбина и присутствием протеина S, инактивирует белки кофакторы, участвующие в свёртывании.
Протеин S – печени и эндотелиоциты, активируется при повреждении сосудов, активирует протеин С.
Фибринолитическая система крови: компоненты, механизмы активации и функционирования.
Компоненты: плазминоген – синтезируется в печени и крастном костном мозге. Под действием тканевого активатора плазминогена превращается в плазмин. Также плазминоген активирует 12 фактор свёртывания и калликреин.
Функция одна – лизирование фибринового сгустка. При этом распаде остаются в кровотоке ди и мономеры фибрина.
Факторы, влияющие на функциональную способность свертывающей, противосвертывающей, фибринолитической систем гемостаза. Роль эндотелия в регуляции гемостаза. Основные направления коррекции нарушений гемостаза.
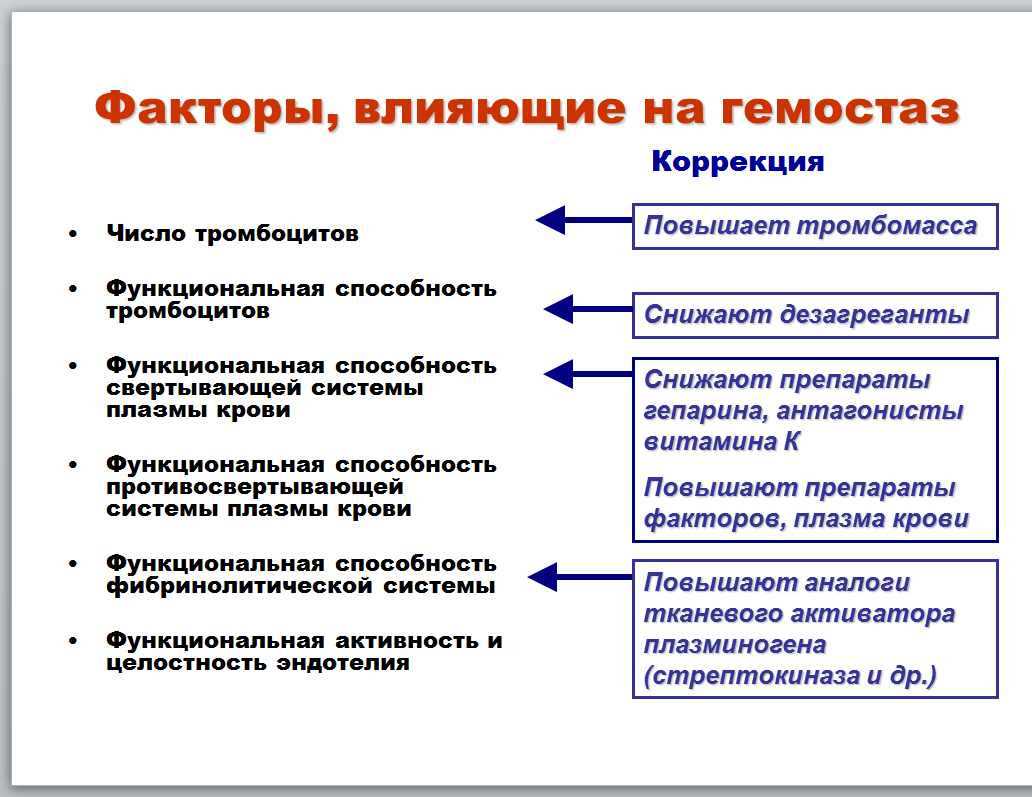
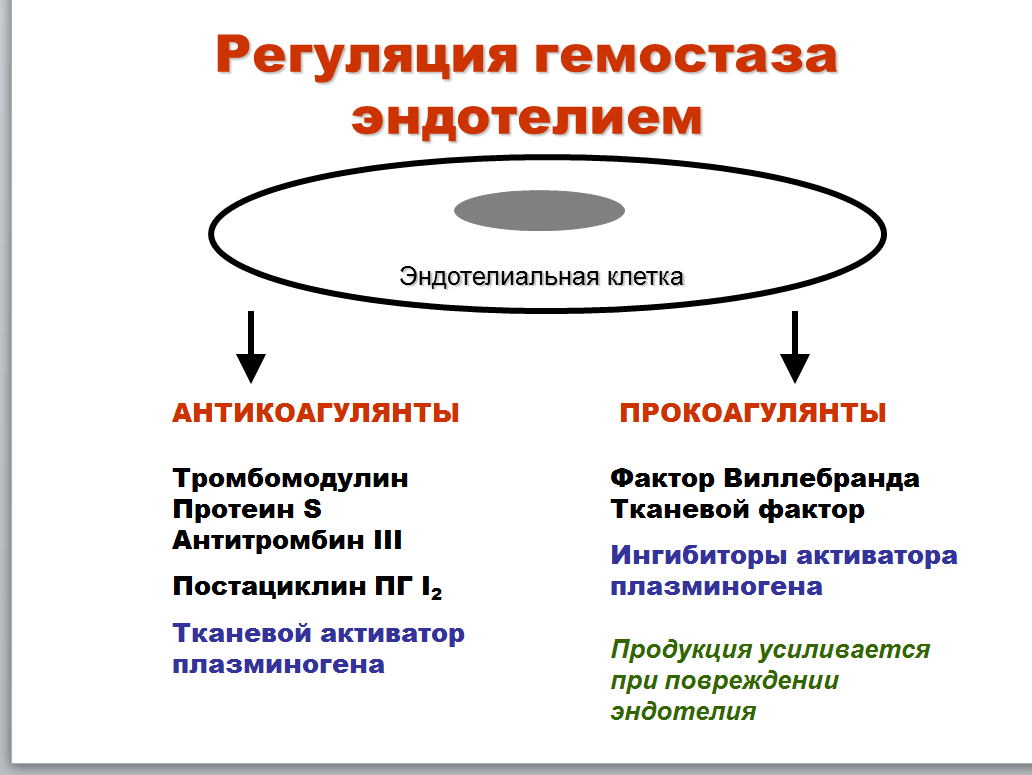
Активность свертывающей, противосвертывающей и фибринолитической систем: биологическое значение баланса, обеспечивающие взаимосвязь механизмы, возможные последствия нарушений баланса. Основные лабораторные показатели активности свертывающей, противосвертывающей, фибринолитической систем гемостаза.
Баланс между этими тремя системами очень важен, ибо если вверх возьмёт, скажем, свёртывающая, то у нас будет склонность тромбообразованиям, а если вверх возьмёт противосвёртывающая – гемофилия
обеспечивающие взаимосвязь механизмы: видимо имеется ввиду, что активация компонентов одной системы может служить активатором другой, что помогает работать системам слаженно. Последствия уже назвал.
Показатели: Свёртывающая система – парциальное агглютинируюшие протромбиновое время (ПАПВ) – показывает активность внутреннего пути активации, Протромбиновое время – внешнего, тромбиновое время – общий этап свёртывания
Противосвёртывающая: определение активности протеина С и антитромбина 3.
Фибринолитическая: количество D и мономеров фибрина.
Функции почек: 1)гемостатическая а)водно-солевой баланс б) кислотно-щелочное равновесие 2)Экскреторная а)конечные продукты обмена – мочевина, мочевая кислота, креатинин б) избыток веществ: вода, органические кислоты, витамины. в)ксенобиотики 3. Регуляторная: ренин, витамин D3, эритропоэтин, простагландины(PgE, PgF).
Этапы образования мочи: фильтрация, реабсорбция, секреция
Фильтрация: процесс, происходящий в почечном клубочке, заключающийся в прохождении через почечный фильтр всех веществ крови кроме крупных белков и клеток крови.
Механизм образования первичной мочи: кровь притекает к почечному клубочку, там под давлением большая часть веществ проходит через почечный фильтр и вауля! первичная моча. В день образуется около 150 л первичной мочи.
Структура и функции почечного фильтра: состоит из эндотелия капилляров, базальной мембраны и подоцитов. Подоциты: они не только образуют поры, но также отрицательно заряжены, что отталкивает белки-анионы. Функция: непропускание крупных белков, клеток и форменных элементов крови
Состав первичной мочи: состав такой же, как и у плазмы крови, но практически лишена белков размером свыше 40 кД, клеток и форменных элементов крови.
Также, когда говорите про фильтрацию, упомяните про фильтрационное давление, которое равно гидростатическое давление крови - онкотическое давление крови – давление первичной мочи.
Нарушение фильтрации – изменение состава фильтрата:

Уменьшение скорости клубочковой фильтрации:

Клиренс
креатинина как показатель скорости
клубочковой фильтрации:

Механизмы канальцевой реабсорбции и их регуляция: реабсорбция есть избирательный возврат веществ из первичной мочи в кровь. Механизмов четыре: Пассивный транспорт – по градиенту концентрации без затрат энергии, первично активный – с затратой энергии с помощью специальных переносчиков, вторично активный – когда одно вещество (чаще всего натрий) переносится по градиенту концентрации и при этом создаётся энергия, достаточная для переноса другого вещества, пиноцитоз – захват клеткой жидкости с растворёнными в ней веществами, идёт с затратой энергии.
Регуляция осуществляется с помощью вазопрессина (увеличивает реабсорбцию воды), натрийуретического гормона (снижает реабсорбцию натрия) и альдостерона (увеличивает реабсорбцию натрия)
Реабсорбция всяких веществ:



Нарушения канальцевой реабсорбции: Причины: врождённый дефект некоторых или даже всех специфических переносчиков на апикальной мембране клеток проксимального канальца или же повреждение клеток канальца при патологическом процессе. Показатели: глюкозурия, аминоацидурия, увеличение экскреции с мочой низкомолекулярных белков (типо альбумина), при повреждении клеток канальцев – появление различных внутриклеточных ферментов типо бета-N-ацетилглюкозаминидазы.
Механизмы канальцевой секреции: те же, что и при реабсорбции, только теперь транспортёры встроены не в апикальную мембрану, а в базальную. Секретируются анионы некоторых органических кислот, чужеродные вещества, включая и лекарства, ионы калия, протоны, аммиак.
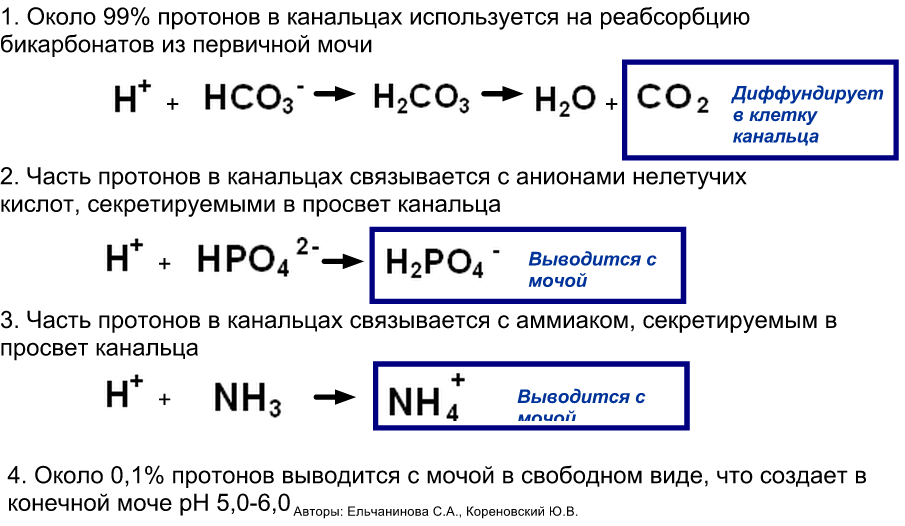
Дезинтоксикационная функция почек: в основном аммиак поступает в печень, где из него синтезируется мочевая кислота, но частично он поступает в почки, где соединяется с протонами водорода и в результате образуются соли аммония, которые выводятся с мочой. Также в мочу секретируются некоторые лекарственные вещества прямо из крови.
Роль почек в поддержании осмолярности плазмы крови: изменение реабсорбции воды и ионов натрия.
Механизм действия антидиуретического гормона: увеличивает количество пор для воды (аквапоринов) на мембране собирательных трубочек, что увеличивает реабсорбцию воды. Пептид, синтезируется в гипоталамусе, накапливается и секретируется в задней доле гипофиза.
Роль почек в поддержании объёма циркулирующей крови: тоже самое – изменение реабсорбции для воды и ионов натрия.
Ренин-ангиотензин-альдостероновая система: падает объём крови, падает АД, юкстагломерулярные клетки начинают вырабатывать ренин, ренин стимулирует превращение ангиотензиногена в ангиотензин 1, который в лёгких под воздействием ангиотензинпревращающего фермента превращается в ангиотензин 2. Ангиотензин 2 стимулирует констрикцию сосудов, что повышает АД, а также стимулирует выработку альдостерона корой надпочечников, который увеличивает реабсорбцию натрия в почках, вместе с натрием реабсорбируется и вода.
Натрийуретический пептид: синтезируется кардиомиоцитами сердца, увеличивает экскреция натрия (уменьшает реабсорбцию), а также повышает тонус приносящей артериолы, что увеличивает фильтрационное давление, что увеличивает количество первичной, а соответственно и вторичной мочи, а также уменьшает выработку ренина.
Роль почек в регуляции кислотно-щелочного равновесия: почки реабсорбируют в кровь бикарбонаты, что поддерживает бикарбонатную буферную систему, что позволяет поддерживать кислотно-щелочной баланс.
Механизм ресинтеза бикарбонатных анионов и секреции протонов:
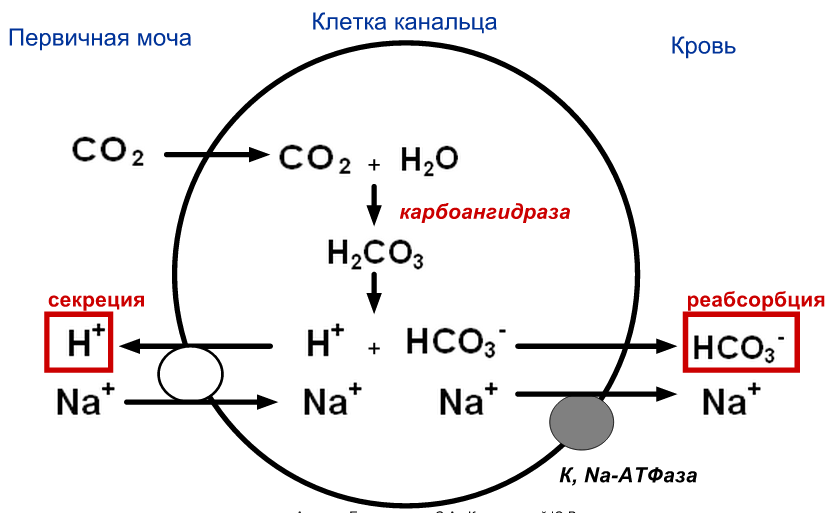
Пути утилизации протонов:
Биохимические процессы, влияющие на количество, прозрачность, цвет, относительную плотность, pH мочи. Нарушения, ведущие к отклонениям от нормы этих показателей:
Количество: на количество мочи влияет количество выпитой жидкости, гормональный фон, зависит от пола и возраста. Полиурия – физиологическая при большом потреблении мочи, патологическая – при гипергликемии (диабет)
Олигурия – физиологическая при малом поступлении жидкости, а также при обильном выделении воды через кожу (пот при интенсивных физ нагрузках), патологическая при лихорадках, почечной или сердечной недостаточности.
Анурия – мочекаменная болезнь, нефрит, опухоль сдавливающая мочевыводящие пути.
Прозрачность и цвет: цвет в норме соломенно-жёлтый из-за уробилина. Может изменятсья при патологических процессах – становиться красным (миоглобин при распаде мышц, гемоглобин и эритроциты при гемолизе и при патологических процессах в самих почках. Свёкла также может давать такой эффект), становиться цветом тёмного пива из-за прямого билирубина при обтурационной желтухе.
Относительная плотность: в норме 1,002 до 1,030. Зависит от содержания глюкозы и белков, которых в норме нет (на самом деле есть, но такое ничтожное количество. Что говорят «следы белков и глюкозы). При несахарном диабете (снижение выработки антидиуретического гормона) наблюдается полиурия с уменьшением относительной плотности мочи. При сахарном диабете или при патологических процессах в почках количество глюкозы и белков в моче увеличивается. Увеличивается и относительная плотность.
рН мочи: Закисление мочи (рН < 5,5) наблюдается при приеме белковой пищи, декомпенсированном сахарном диабете, лихорадочных состояниях, голодании, почечной недостаточности, лейкозах. Защелачивание мочи (рН > 7,0) наблюдается при длительном хранении мочи, при приеме растительной пищи, инфекциях мочевыводящих путей. pH определяется количеством секретируемых протонов в дистальных канальцах
Возможные причины увеличения экскреции с мочой глюкозы: превышение концентрации глюкозы свыше 10 млмоль/л (гипергликемия. вызванная диабетом или ещё чем) или уменьшение количества транспортёров для глюкозы (врождённый дефект или патологический процесс с разрушением клеток проксимальных канальцев)
Кетоновых тел: Кетонурия наблюдается при нарушениях углеводного, жирового или белкового обмена как следствие кетонемии (декомпенсированный сахарный диабет, голодание, лихорадка, алкогольная интоксикация, инфекционные заболевания, послеоперационные состояния и др.).
Аминокислот: нарушение целостности почечного фильтра, снижение количества транспортёров для аминокислот.
Гемоглобина: гемолиз
Белка: Протеинурия может быть преренальной (поступление в мочу из плазмы крови белков с низкой молекулярной массой через не поврежденный почечный фильтр - моноклональные гипергаммаглобулинемии, травматические, токсические, некротические миоглобинемии), ренальной (функциональная, обусловленная повышением проницаемости почечного фильтра вследствие нарушения кровотока в клубочках нефрона, - транзиторная, застойная, лихорадочная, ортостатическая; органическая, обусловленная повреждением клубочка нефрона, – гломерулонефрит, диабетическая нефропатия, пиелонефрит, нефроз, амилоидоз почек, почечная недостаточность), постренальной (поступление в мочу белков воспалительного экссудата, крови при воспалении мочевыводящих путей, повреждении при мочекаменной болезни).
Эритроцитов: гемолиз, нарушение целостности почечного барьера
Лейкоцитов: воспаления, инфекции.
Функции и связанные с этим биохимические особенности эпителия воздухоносных путей: основная функция – это конечно газообмен. Газообмен происходит в альвеолах легких и представляет собой диффузию углекислого газа из эритроцитов в альвеолы и кислорода из альвеол в кровь. Скорость диффузии газов определяется их парциальным давлением: pCO2 и pO2. Углекислый газ может находится в форме карбаниона (HCO3–) и растворенном состоянии в плазме крови, а также карбгемоглобина (HbCO2) в эритроцитах. Карбанион образуется при спонтанной диссоциации угольной кислоты (H2CO3). Направление реакции зависит от pCO2. Поэтому в периферических тканях, где высоко значение pCO2, реакция направлена в сторону синтеза угольной кислоты, а в легких из-за удаления CO2 при выдохе реакция направлена на образование углекислого газа и воды. Обратимое превращение молекулы углекислого газа и воды в угольную кислоту осуществляет фермент карбоангидраза. Карбоангидраза функционирует в эритроцитах, эндотелиоцитах и альвеоцитах I типа. Диффузия CO2 через мембраны альвеоцитов, эндотелиоцитов и эритроцитов осуществляется через водные каналы — аквапорины (AQP), поэтому для осуществления газообмена необходим постоянный ток жидкости через эти клетки. Наличие каналов для CO2 обусловливает высокую проницаемость клеток для этого газа, которая в 25 раз выше, чем для кислорода. Кислород пассивно диффундируют через фосфолипидные мембраны клеток.
Воздухоносные пути играют защитную, увлажняющую и согревающую роль.
Факторы, влияющие на мукоцилиарный клиренс (скорость движения слизи): кальций, протеогликаны и биение ресничек. Если кальция много, то слизь становится менее текучей, что снижает клиренс, тоже самое если мало протеогликанов. Если реснички эпителиоцитов дыхательных путей работают плохо, то слизь не будет перемешиваться, поверхностный слой будет слишком забит всякими инородными частицами, что также снизит клиренс. Также на мукоцилиарный клиренс влияет количество выделяющих и реабсорбирующих слизь клеток воздухоносных путей. В нижнем отделе воздухоносных путей большое количество клеток, выделяющих слизь, вверху – реабсорбирующих. Поэтому слизь и двигается снизу–вверх (а не из-за биения ресничек). Если имеется какой-то дефект этих клеток – клиренс нарушается.
Лизоцим – находится во всех жидкостях организма, преобладает в слюне и слезах. Лизирует клеточную мембрану, разрывает связи между М-ацетилмурамовой кислотой и N – ацетилглюкозамином. Действует на грам + (да да, из ответов по микре)
лактоферин– белок, конкурирует с микроорганизмом за железо
Интерферон-γ (IFN-γ)
Гликопротеин IFN-γ секретируется многими иммунными клетками, а также эпителием бронхов, инфицированным вирусом. Синтез IFN-γ регулируется на уровне транскрипции, а его секреция начинается одновременно с началом репликации вируса. IFN-γ индуцирует синтез и экспрессию на клеточной мембране соседних неинфицированных эпителиоцитов молекул клеточной адгезии (ICAM-1), синтез iNOS, а также множества интерлейкинов и белков теплового шока. Эта реакция обеспечивает защиту неинфицированных эпителиоцитов и адгезию Т-лимфоцитов. Некоторые парамиксовирусы для обхождения системы IFN-γ синтезируют белки сходные с IFN-γ. Такой вирусный белок (при соответствующей генетической предрасположенности у человека) чрезмерно активирует сигнальный каскад IFN-γ, нарушает адаптацию эпителиоцитов и неправильную дифференцировку стволовых эпителиальных клеток с формированием провоспалительного фенотипа, при котором доля реабсорбирующих/иммуномодулирующих поверхностных эпителиоцитов снижается, а доля секретирующих/провоспалительных слизистных и серозных клеток возрастает. Такое перепрограммирование фенотипа эпителия способно вызвать гиперреактивность бронхов и бронхиальную астму.
Про иммуноглобулин А почитайте где-то в сердечно-сосудистой системе.
Неспецифические элементы противовирусной защиты Помимо бактерий, против которых направлены выше перечисленные факторы защиты, дыхательная система вообще и эпителий дыхательных путей в частности из-
за своего стратегического положения постоянно контактирует с вирусами. Поэтому эволюцией выработались универсальные механизмы противовирусной защиты, к которым относятся система цитокинов RANTES и интерферона-γ.
RANTES
RANTES (пер. с англ. Regulated upon Activation, Normal T-cell Expressed, and Secreted — цитокин регулируемый при актиации, экспрессируемый и секретируемый нормальными T-лимфоцитами, chemokine (C-C motif) ligand 5, CCL5) секретируется многими эпителиоцитами (в том числе и поверхностным эпителием бронхов) при инфицировании вирусом. В норме эпителиоцит постоянно синтезирует мРНК RANTES и RANTES-РНКазу, поэтому синтеза белка RANTES не происходит. При инфицировании эпителиоцита вирусные белки РНК-содержащих респираторных вирусов блокируют РНКазы и мРНК RANTES транслируется в секретируемый гликопротеин RANTES, привлекающий Т- лимфоциты. Таким образом, регулируемый на посттранскрипционном уровне белок RANTES информирует иммунную систему о внедрении вируса еще до начала его репликации. Синтез и секрецию RANTES блокируют глюкокортикоиды.
Альвеоциты I типа имеют уплощенную форму и покрывают 95 % площади альвеол. Эти клетки осуществляют газообмен, не требующий затрат энергии, поэтому источником АТФ для этих клеток является анаэробный гликолиз. Альвеоциты I типа экспрессируют AQP1, облегчающий диффузию CO2. Плотные соединения альвеоцитов I типа обеспечивает асимметричное распределение мембранных протеинов и содержат ионоселективные каналы, которыми регулируют перенос ионов Na+ и Cl–. Проницаемость плотных соединений регулируется цитоскелетом и внутриклеточной концентрацией ионов Ca2+. Секреция осмотически активных ионов Na+ и Cl– способствует трансцеллюлярной диффузии воды через аквапорины
Главной функцией альвеоцитов II типа является реабсорбция ионов Na+ и Cl–. Такая работа требует больших затрат энергии, поэтому основным источником энергии для альвеоцитов II типа является процесс окисления глюкозы до CO2 и H2O в митохондриях с участием кислорода. Вслед на ионами Na+ парацеллюлярно транспортируются ионы Cl–, а трансцеллюлярно посредством аквапоринов транспорируется вода. Альвеоциты II типа имеют кубическую форму и апикальную щеточную каемку. В щеточной каемке экспрессируется эпителиальный Na+-канал (ENaC), а в базолатеральной мембране — 3Na+/2K+-АТФаза. Альвеоциты II типа синтезируют и секретируют сурфактант.
Адреналин: через аденилатциклазу и выработку цАМФ увеличивает количество эпителиальных натриевых каналов и калий-натриевой АТФазы, таким образом увеличивая реабсорбцию натрия и ,следовательно, воды.
Глюкокортикоиды: действую по ядерному механизму, то есть регулируют скорость транскрипции мРНК субъединиц ENaC и 3Na+/2K+-АТФазы.
Внутренняя поверхность дыхательных путей покрыта тонким слоем слизи. Слизь содержит растворенные в воде ионы Na+, Cl–, K+, Ca2+, муцины, сульфатированные протеогликаны, сурфактант, лизоцим, лактоферрин и секреторный IgA. Разные компоненты слизи синтезируются в разных отделах дыхательных путей и в респираторном отделе легких (вода, ионы, сурфактант), источником муцинов являются подслизистые железы.
Клиренс ингалируемых частиц
На клиренс ингалируемых частиц влияют:
● реология слизи;
● адгезивность слизи;
● биение ресничек реснитчатого эпителия.
Реология слизи
Реологические свойства (текучесть) слизи определяются соотношением между сульфатированными протеогликанами и концентрацией ионов Ca2+. Повышение содержания в слизи ионов Ca2+ снижает текучесть слизи. Синтез сульфатируемых протеогликанов регулируется ретиноевой кислотой, поэтому дефицит предшественника ретиноевой кислоты ретинола приводит к нарушению клиренса слизи, размножению бактерий и воспалению.
Адгезивность слизи
Адгезивность слизи прямо пропорциональна содержанию ионов Cl– и сурфактанта. Поверхностный эпителий тонко регулирует реологические и адгезивные свойство слизи благодаря избирательной реабсорбции ионов, секрецией сурфактанта и паракринной регуляции подслизистых желез.
Биение ресничек
Слизь постоянно перемешивается благодаря биению ресничек реснитчатого эпителия. Дыхательные пути следует рассматривать как реабсорбирующий участок (с максимумом реабсорбции в носоглотке), а респираторный отдел легких — как секретирующий. Поэтому направленный ток жидкости из нижних отделов в верхние обусловлен исключительно распределением секретирующих и реабсорбирующих элементов в нижних и верхних дыхательных путях.
Подслизистые железы
Подслизистые железы обнаруживаются в дыхательных путях содержащих хрящ. Они содержат клетки 4 типов: серозные клетки, мукоциты, поверхностные эпителиоциты и камбиальные клетки.
Серозные клетки
Фундальная часть железы представлена серозными клетками секретирующими ионы Cl– и Na+, воду, лизоцим, лактоферрин и секреторный IgA. Секреция начинается с открытия Cl–-канала дефектного при муковисцидозе (CFTR). Поступающий в просвет железы ионы Cl– обеспечивают трансэпителиальную разность потенциалов для парацеллюлярного транспорта ионов Na+. Вода поступает в просвет железы трансцеллюлярно. Функция CFTR не ограничивается транспортом ионов. CFTR регулирует синтез и секрецию серозными клетками сульфатированных протеогликанов. Степень сульфатирования также определяется ретиноевой кислотой. Серозные клетки секретируют фермент лизоцим, расщепляющий клеточную стенку бактерий, и гликопротеин лактоферрин, связывающий ионы железа. Ионы железа появляются в слизи при разрушении эпителиоцитов и бактерий, а поскольку свободное железо токсично для клеток, то лактоферрин необходим для его нейтрализации.
Мукоциты
Мукоциты синтезируют муцины конденсированные с ионами Ca2+. Секреция
муцинов регулируется CFTR. Таким образом, Cl–-канал CFTR сочетает в себе свойства анионного канала и внутриклеточного регулятора. CFTR активируется в ответ на внутриклеточный синтез цАМФ и повышение концентрации ионов Ca2+ в клетке.
Поверхностные эпителиоциты
Фенотипически сходны с альвеоцитами II типа. Поверхностные эпителиоциты экспрессируют ENaC, 3Na+/2K+-АТФазу и ферменты синтеза сурфактанта. Поверхностный эпителий регулирует ионный состав слизи, паракринно регулирует секрецию подслизистыми железами и выполняет иммуномодулирующую функцию.
Муковисцидоз – застой слизи. Наблюдается при снижении количества ионов хлора (они создают кислую pH среды для образования протеогликанов, которые обуславливают текучесть слизи. Нет протеогликанов – застой слизи), при нарушении биения ресничек (все частицы скапливаюстя на поверхностном слое, что снижает текучесть), а также при изменение количества секретирующих и/или реабсорбирующих слизь клеток. Диагностика: взятие слизи с дыхательных путей для проверки количества хлора, а также проверка количества хлора в поте. Если количество хлора в поте (или в поту, я не на экзамене) больше нормы – указывает на муковисцидоз.
Нейрон состоит из тела и отростков — дендритов и аксонов. Отростки формируют контакты (синапсы) с соседними нейронами или периферическими клетками. Дендриты передают возбуждение от периферии к телу нейрона, а аксоны — от тела нейрона к другим нейронам или эффекторным клеткам. Отростки нейронов представляют собой полые трубки, образованные мембраной и наполненные цитоплазмой. Ток жидкости цитоплазмы перемещает везикулы с ферментами из гранулярной эндоплазматической сети (грЭПС) в концевой пластике, где в везикулах синтезируются и запасаются нейромедиаторы.
Миелин Аксоны большинства нейронов имеют миелиновую оболочку. Участки цитоплазматической мембраны нейрона, в которых он не имеет миелиновой оболочки, называются перехватами Ранвье. Миелин является продуктом клеток Шванна (в периферической нервной системе) и олигодендроцитов (в центральной нервной системе). Состав миелина: липиды (галактоцереброзид) — 80 %, белки — 20 %. Протеины миелина регулируют процесс миелинизации нервных волокон, поэтому их дефект обусловливает нарушения проведения нервных импульсов по нервным волокнам (рассеянный склероз): ● основной белок миелина (myelin basic protein, MBP); ● миелиновый гликопротеин олигодендроцитов (myelin oligodendrocyte glycoprotein, MOG); ● протеолипидный протеин (proteolipid protein, PLP) взаимодействует с MOG. Миелиновая оболочка обеспечивает высокую скорость передачи нервного импульса в миелиновых волокнах, поскольку нервный импульс перемещается скачкообразно. Вдоль безмиелиновых нервных волокон скорость передачи нервного импульса существенно ниже, поскольку потенциал действия распространяется последовательно вдоль мембраны нейрона. Кроме того, миелиновая оболочка предотвращает перенос электрического импульса на соседние нейроны и формирует канал для роста аксона при его повреждении. Повреждение миелина (демиелинизация) и нарушение синтеза миелина (дисмиелинизация) снижает скорость передачи нервных импульсов вдоль аксона, что вызывает нарушение чувствительности, мышечную слабость и нарушение зрения. На миелиновую оболочку воздействуют компоненты ингаляционного наркоза, которые повышают текучесть мембран миелиновой оболочки и снижают возбудимость нервных клеток.
Химические синапсы — специализированные соединения между нейронами и другими клетками (мышцы, железы). Синапсы обеспечивают связь с другими нейронами и регуляцию нейронами других клеток. Количество синапсов снижается с возрастом. Термин «синапс» происходит от слова «синаптеин» от греч. «syn» — «вместе» и «haptein» — «скреплять». Структура синапса Химические синапсы функционально асимметричны и передают информацию от пресинаптических клеток к постсинаптическим мембранам. Пресинаптические терминалы (синаптические расширения) — специализированные области аксона, содержащие нейротрансмиттеры в мембранных пузырьках (везикулах). В пресинаптических терминалах синаптические везикулы прикрепляются к пресинаптической плазматической мембране, называемых активной зоной. На постсинаптической мембране расположены рецепторы нейротрансмиттеров. В случае синапсов между двумя нейронами постсинаптическая мембрана расположена на мембране дендрита. На постсинаптической мембране расположены белки постсинаптической плотности. Эти протеины обеспечивают заякоривание, перемещение и модуляцию активности рецепторов нейротрансмиттера. Между пре- и постсинаптическими мембранами располагается щель шириной 20 нм, что позволяет быстро повышать или снижать концентрацию нейромедиатора. Мембраны обеих клеток фиксированы белками клеточной адгезии, ограничивающими зону действия нейромедиатора областью синапса.
Высвобождение нейромедиатора
Высвобождение нейромедиатора включается при достижении нервного импульса пресинаптической мембраны (потенциал действия). Секреция нейромедиатора осуществляется посредством экзоцитоза. Потенциал действия вызывает вход в нейрон ионов Ca2+ через потенциал-чувствительные Ca2+-каналы. Ионы Ca2+ через кальмодулинподобные белки S100 включают биохимический каскад, вызывающий слияние везикулы с нейромедиатором с пресинаптической мембраной и выход нейромедиатора в синаптическую щель. Пустые везикулы возвращаются в пресинаптический терминал для повторного наполнения нейромедиатором.Ф
