
- •Биологическая роль белков и пептидов: ферментативная, интегративная, иммунологическая, структурная, сократительная, гемостатическая.
- •Методы разделения и очистки белков.
- •Ферменты – белки, выполняющие роль катализаторов.
- •Биологическая роль активных форм кислорода:
- •Гормональная регуляция уровня глюкозы в крови. Гипергликемические гормоны: адреналин, глюкагон, глюкокортикоиды. Гипогликемические: инсулин.
- •Концентрация глюкозы как интегральный показатель углеводного обмена в организме.
- •Липопротеины – транспортная форма липидов. Это комплекс из липидов и апобелков.
- •Липолиз. Бета-окисление высших жирных кислот:
- •Переваривание белков в желудке.
- •Основные пути использования аминокислот в организме.
- •Дезаминирование аминокислот.
- •Глютамин как транспортная форма аммиака. Система глутамин-глутаминаза в клетках печени и почечных канальцев, биороль, связь с образованием конечных продуктов обмена аммиака.
- •Образование катехоламинов. Роль гидроксилирования, декарбоксилирования и метилирования в этом процессе. Биологическая роль катехоламинов.
- •Понятие о нуклеопротеидах, их превращения в желудочно-кишечном тракте. Строение, биологическая роль, особенности обмена мононуклеотидов в организме человека.
- •Регуляция клеточного цикла и репликации. Роль циклинов и белка р53.
- •Вот что говорит Вика.
- •Механизмы регуляции транскрипции. Примеры воздействия на процессы биосинтеза белка лекарственными препаратами.
- •ВитаминВ1 (тиамин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •В2 (рибофлавин). Активная форма витамина. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин в5 (никотинамид). Активные формы витамина. Участие в биохимических реакциях. Проявление недостаточности. Фармакологическое действие витамина в5.
- •Витамин в6 (пиридоксин), Витамин в9 (фолиевая кислота) и в12 (цианокобаламин). Активные формы витаминов. Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин с (аскорбиновая кислота). Участие в биохимических реакциях. Проявление недостаточности.
- •Витамин а (ретинол). Роль в процессах светоощущения, обмена эпителия, эндотелия и соединительной ткани. Проявления недостаточности.
- •Белки межклеточных контактов и адгезии. Хемокины.
- •Гистогормоны (гистамин, серотонин, гастрин, секретин, холецистокинин, натрийуретический пептид). Клетки-продуценты, пути передачи сигналов, биологическая роль.
- •Инсулин. Глюкагон. Химическая природа, образование, ткани-мишени. Влияние инсулина на углеводный, белковый и липидный обмены.
- •Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
- •Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
- •Гормональная регуляция репродуктивной функции организма.
- •Основные компоненты внеклеточного матрикса соединительных тканей: коллагеновые волокна, эластиновые волокна, глюкозамингликаны, протеогликаны. Структура и роль.
- •Механизм синтеза и распада коллагена. Промежуточные продукты маркеры резорбции и образования костной ткани.
- •Костная ткань как твердая разновидность соединительной ткани, ее основные функции. Особенности структуры гидроксиапатита и их связь с биологической функцией костной ткани.
- •Понятие об остеомаляции и остеопорозе, возможных причинах их развития.
- •Участие печени в обмене белков.
- •Желчеобразующая функция печени. Состав и функции желчи. Гепатоэнтеральная циркуляция желчных кислот. Биосинтез желчных кислот и их роль.
- •Экзогенные и эндогенные субстраты детоксикации. Реакции гидроксилирования (микросомальная система окисления) и конъюгации.
- •Общая схема регуляции эндотелием адаптивных реакций сосудистой стенки. Роль эндотелия в регуляции структурных изменений сосудистой стенки, ангиогенезе, гемостаза.
- •Оксид азота и супероксид. Пути образования и инактивации. Эндотелин 1. Схема образования, эффекты на тонус сосудов в норме и при повышенной продукции.
- •Метаболические особенности миокарда: механизм сокращения миоцитов, основные энергетические субстраты и пути их утилизации. Роль миоглобина и креатинфосфата в энергетическом обмене миокарда.
- •Эритроциты, место образования и распада. Регуляция эритропоэза эритропоэтином. Особенности метаболизма эритроцитов и структуры их мембран.
- •Обмен железа. Лабораторные показатели дефицита железа в организме. Понятие о физиологической желтухе новорожденных.
- •Механизм адгезии и агрегации тромбоцитов. Фактор Виллебранда: структура, участие в гемостазе. Тромбоксан простациклин: схема синтеза, участие в гемостазе.
- •Связывание с рецептором
- •Модуляция синаптической нейротрансмиссии
- •Интеграция синаптических входов
- •Гамма-аминомасляная кислота
- •Гематоэнцефалический барьер
Метаболические особенности миокарда: механизм сокращения миоцитов, основные энергетические субстраты и пути их утилизации. Роль миоглобина и креатинфосфата в энергетическом обмене миокарда.
Ну эт кароч физа. Кароч, есть актиновые, миозиновые нити, тропонин и тропомиозин. Чтобы оскращение рпоизошло актин должен взаимодействовать с миозином, но активные участки актина в норме заняты тропомиозином. И вот как происходит сокращение. В мышцу приходит возбуждение, которое открывает кальциевые каналы. Кальций входит в клетку, но его недостаточно для сокращения. Кальций подходит к саркоплазматическому ретикулуму (СПР), связывается там с кальцийзависимыми кальциевыми каналами. Кальций выходит из СПР и теперь его достаточно для возбуждения. Он идёт к тропонину, активирует его, тропонин отодвигает тропомиозин, открывая активные участки актина для головок миозина, совершаются гребкообразные движения. Ну вот как-то так сокращается. А если тебе что-то не понравилось в моём объяснении, то открой физу, я тут между прочем ответы по бэхе делаю, не по физе.
Субстраты: ВЖК 60-70% энергии в покое (бета-окисление), лактат 90% при физической нагрузке (переходит в пируват и дальше в цикл Кребса), глюкоза 20-30% (аэробный гликолиз), кетоновые тела.
Миоглобин – содержится в кардиомиоцитах. Обладает большим сродством к кислороду, чем гемоглобин, выхватывает кислород у гемоглобина, обеспечивая тем самым запас кислорода. Креатинфосфат – низкомолекулярное макроэргическое соединение, обеспечивает синтез АТФ при дифиците энергии.
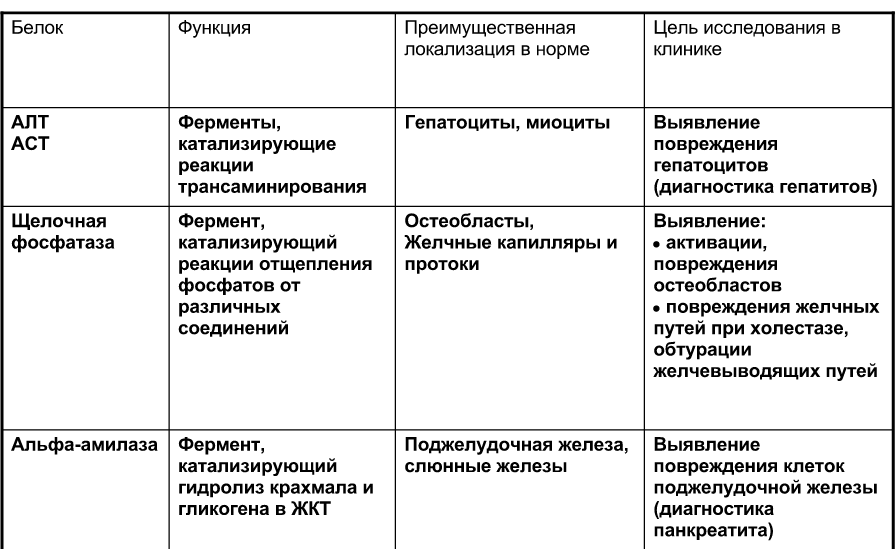
Лабораторные маркеры повреждения кардиомиоцитов (тропонин Т, креатинкиназа, миоглобин, лактатдегидрогеназа, аминотрансферазы).
Тропонин Т – тропонин, свойственный только для кардиомиоцитов, появляется в крови после повреждения в кардиомиоцитах спустся 1-2 часа, что делает его очень важным для тестирования ишемии и других болезней, сопровождающихся повреждением сердца. Поговаривают, что в западных странах даже есть специальные тест полоски, которые позволяют очень быстро определить - есть тропонин в крови или нет. Но так говорят люди, верить им или нет – решать тебе.
Креатинкиназа – участвует в превращениях креатинфосфата. Есть три изоформы креатинкиназы – ВВ (в мозгу), ВМ (в сердце) и ММ (в мышцах). Так что ищем либо общую креатинкиназу, но это не будет указывать именно на сердце, либо конкретную креатинкиназу ВМ.
Миоглобин – есть в кардиомиоцитах и в обычных мышцах, так что не специфичен для сердца, возрастает в крови спустя 3-4 часа после повреждения.
Лактатдегидрогеназа – 5 изоформ, 1 и 2 свойственна для сердца и почек, 4 и 5 для скелетных мышц и печени, 3 там для разных тканей. Либо ищем общий, либо конкретно 1 и 2 форму.
АСТ (аспартатаминотрансфераза) содержится во многих тканях, но больше всего в сердце, так что повышение в крови скорей всего указывает на сердце, хотя тот же эффект может иметься при некрозе гепатоцитов, так что неспецифичен. Возрастает спустя 6-12 часов.
Неорганические вещества плазмы крови (натрий, калий, кальций, фосфор). Общие закономерности обмена. Функции, нарушения при изменении концентрации в плазме крови.

Натрий:
При гипернатриэмии – дегидратация клеток, при гипонатриэмии – гипергидратация (отёки)
Калий:
Гиперкалиэмия – повышение возбудимости, гипо – понижение
Кальций – структурная основа костей, отвечает за возбудимость мышц. При гиперкальциэмии – повышенная возбудимость, судорги, при гипо – снижение возбудимости, утомление.
Фосфор: входит в состав костей и макроэргический элементов типо АТФ. Что при его изменении будет – не знаю.
Альбумин плазмы крови: функции, понятие о причинах и проявлениях гипоальбумиемии.

Образуются в печени.
Транспортные белки плазмы крови (белки, переносящие витамины, гормоны, ионы переходных металлов). Место синтеза. Зависимость эффекта лиганда от концентрации транспортного белка.

![]()
Синтез идёт в основном в печени, если он идёт ещё где-то – мне пофиг.
Зависимость эффекта лиганда от концентрации транспортного белка: кароч, когда у нас, скажем, тироксин связан с тироксинсвязывающим белком, то он не проявляет своего действия, а когда он в свободной форме – то проявляет.
Соответственно, если у нас мало транспортных белков, то действие тироксина будет сильнее выражено, что лежит в основе некоторых заболеваний.
Примечание: тироксин приведён здесь в качестве примера, я не знаю, происходит ли на самом деле с тироксином то, что я ему приписал. Но зато вы поняли механизм работы всего этого и сможете рассказать. Веселитесь.
Белки острой фазы воспаления, иммуноглобулины. Функции.

Иммуноглобулины это тоже что гамма-глобулины, что тоже самое, что антитела. Из микры мы знаем о них всё. Что? Что такое, мой юный друг? Ты не очень прилежно учил микру? Ну, вот очень краткое изложение, чтобы ты хотя бы что-то про них сказал.
IgM – вырабатывается самым первый, филогенетически более древний, самый большой иммуноглобулин, может связать 10 антигенов.
IgG – основное антитело иммунного ответа, двух валентно, самое большое количество в организме
IgA – тоже что и иммуноглобулин G, только его меньше. Имеется особый его подвид – секреторный IgA, который содержится во всех жидкостях организма и он может связать 4 антигена
IgE – опосредует аллергические реакции
IgD – пул этих антител возрастает при хронических заболеваниях.
Понятие о гипо-, гипер-, диспротеинемии. Электрофорез белков сыворотки крови: принцип метода, электрофоретические фракции белков сыворотки, входящие в состав фракций белки. Изменения протеинограммы при остром и хроническом воспалении.
В норме концентрация белков 65-85 г/л (это чтобы поразить препода наповал)
Гипопротеинэмия – белка мало в крови. Причины: Снижение синтеза в печени (недостаточное поступление белка с пищей, острые и хронические заболевания печени); увеличение потери из организма через кожу (при термических ожогах), почки (протеинурия при нефротическом синдроме, сахарном диабете), желудочно-кишечный тракт (острые кишечные инфекции, желудочно-кишечные кровотечения); усиление катаболизма (лихорадочные состояния, тиреотоксикоз); увеличение объема плазмы крови (массивные инфузии солевых растворов).
Гипер – много: почти никогда не встречается, только в случаях массивной потери воды (диарея, рвота и т.д.)
Диспротеинэмия – нарушение соотношения альбуминов и глобулинов плазмы крови. Вызвано обычно воспалением.
Есть анод, есть катод, отрицательно заряженные белки идут к аноду. А положительно заряженные – к катоду. Таким образом разные фракции белков находятся на разных местах, что обуславливается их суммарным зарядом. Или, если коротко, электрофорез позволяет разделить белки плазмы на основе их суммарного заряда.
Я
не знаю в каком объёме давать здесь
белки различных фракций. Но если я напишу
слишком много, то вы снова будете ныть,
что я понаписал лишнего. Так что я просто
приведу скрин слайда из медла, а если
хотите выучить больше белков – откройте
мою лабу по альбумину или же учебник на
685 странице.
Изменения протеинограммы при остром и хроническом воспалении: при остром альбумины в норме, повышаются фракции альфа 1 и 2 глобулинов, при хроническом альбумины и гамма-глобулины падают.
Небелковые органические вещества плазмы крови – метаболиты обмена белков (мочевина, креатинин), липидов (липопротеины), углеводов (глюкоза, лактат). Процессы образования, их органная локализация, пути выведения из организма (крови), возможные причины изменения концентрации в плазме крови, клинико-диагностическое значение определения концентрации.
:-(. Материал изложенный ниже был взят из частично из учебника и почти полностью из моей головы. Доверять ему или нет – судите сами.
Мочевина, образуется в орнитиновом цикле в печени, выделяется через почки, частично через потовые железы, увеличивается при увеличении катаболизма белков, уменьшается при нарушении работы орнитинового цикла, диагностируют для обнаружения болезней почек или печени.
Креатинин – получается при дефосфорилировании креатинфосфата, процесс происходит в мышцах, выводится через почки, Повышается при мышечных нагрузках, характеризует работу мышцы, что используется в спортивной медицине.
Глюкоза – образуется при глюконеогенезе, при распаде гликогена (оба в печени), при всасывании из ЖКТ, из крови выводятся транспортом в ткани а также могут выводитсья почками при дсотижении концентарции 10-12 млмоль на л. Увеличивается при болях, стрессах, употреблении пищи богатой углеводами, при диабете, при приёме глюкокортикоидов. Уменьшается при голодании, передозировке инсулином, физических нагрузках. Диагностируют диабет.
Лактат. Образуется при анаэробном гликолизе в мышцах, эритроцитах и др. Утилизируется в печени путём глюконеогенеза, Увеличивается при физической работе, диагностика гипоксий, а также в спортивной медицине.
Липопротеины… Вы серьёзно? Их же много! Эххххх
Образуются: хиломикроны образуются в энтероцитах из всосавшихся жиров, ЛПОНП в печени, ЛПНП в крови из ЛПОНП, ЛПВП в периферических тканях
Липопротеины не выводятся, они доставляют жиры к нужному месту и там либо переходят в другой липопротеид, либо разрушаются на остатки.
Могут повышаться при употреблении большого количества жирной пищи, уменьшатся при плохом синтезе в печени.
Диагностика атеросклероза.
Внутриклеточные белки и белки секретов в плазме крови. Клинико-диагностическое значение исследования.
Ну тут чисто сказать, что когда идёт разрушение белков, то их внутренности выходят в кровь, что важно в диагностике болезней (не знаем чё с пациентов, взяли кровь, а там тропонин Т, значит разрушение кардиомиоцитов, и любой врач уже знает, что его пациент умирает. Удобно) ну и для примеров вот вам принт скрин слайда.
Буферные системы тканей и крови: гемоглобиновая, фосфатная, бикарбонатная. Механизм и значение поддержания кислотно-основного равновесия в организме буферными системами. Понятие об ацидозе и алкалозе.
Гемоглобиновая – регулирует pH крови путём связывания кислорода, углекислого газа и водорода.
Фосфатная: Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов):
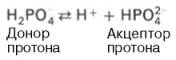
Бикарбонатная: Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
 От
себя добавлю что направление реакции
зависит от концентрации протонов, что
и позволяет регулировать кислотность.
От
себя добавлю что направление реакции
зависит от концентрации протонов, что
и позволяет регулировать кислотность.
Сохранять постоянно pH крови очень важно, так как это обеспечивает оптимальный обмен веществами между кровью и тканями, а также активность ферментов, действующих в крови. Смещение pH приводит к нарушениям выполнения кровью своих функций.
Ацидоз – смещение pH в кислую сторону (становится меньше), алкалоз – в щелочную (больше). Нужно понимать, что буферные системы крови очень эффективны, и должно произойти что-то прямо из ряда вон выходящее, чтобы кислотность сместилась. К слову, pH крови равен 7,4.
