
- •1. Квантовомеханические основы биоэнергетики
- •3.1.Основные понятия квантовой механики
- •3.2.Испускание и поглощение энергии атомами и молекулами
- •3.3. Квантовомеханические особенности строения биомолекул
- •3.4. Механизмы переноса энергии и заряда
- •2. Химические и биологические сенсоры
- •2.1. Полевые транзисторы
- •2.1.1Краткие сведения о полупроводниках
- •2.1.2 Контакт полупроводника с раствором
- •2.1.3 Полевой транзистор
- •2.2 Модифицированные электроды, тонкопленочные электроды и печатные электроды
- •2.2.1Толстопленочные печатные электроды
- •2.2.2 Микроэлектроды
- •2.2.3 Тонкопленочные электроды
- •2.3 Биологическое распознавание молекул
- •2.3.1 Ферменты
- •2.3.2Ткани
- •2.3.3 Микроорганизмы
- •2.3.4 Митохондрии
- •2.3.5 Антитела
- •2.3.6 Нуклеиновые кислоты
- •2.3.7 Рецепторы
- •2.4 Иммобилизация биологических компонентов
- •2.4.1 Адсорбция
- •2.4.2 Микрокапсулирование
- •2.4.3. Включение
- •2.4.4 Сшивка
- •2.4.5 Ковалентное связывание
- •2.5 Аналитические характеристики сенсоров
- •2.5.1 Селективность
- •2.5.2 Чувствительность
- •2.5.3. Временные характеристики
- •2.5.4. Прецизионность, точность и воспроизводимость
- •2.5.5 Факторы, влияющие на характеристики сенсоров
- •2.6 Электрохимические сенсоры и биосенсоры
- •2.6.1. Потенциометрические биосенсоры
- •2.6.2. Биосенсоры с аммиак-чувствительными электродами
- •2.6.3. Биосенсоры с со2-чувствительными электродами
- •2.6.4. Биосенсоры с иодид-селективными электродами
- •2.6.5. Биосенсоры с Аg2s-чувствительными электродами
- •2.6.6. Амперометрические биосенсоры
- •1) За счет его ферментативного гидролиза (под действием арилациламидазы) и последующего окисления п-аминофенола на печатном графитом электроде;
- •2) За счет прямого окисления парацетамола на угольно-пастовом электроде
- •2.7 Применение сенсоров на основе полевых транзисторов
- •2.7.1. Химически чувствительные полевые транзисторы (хчпт)
- •2.7.2 Ионоселективные полевые транзисторы
- •2.7.3 Ферментные полевые транзисторы (фпт)
- •3. Микроаналитические системы
- •3.1 Сенсоры как составная часть и один из базисных элементов микроаналитических систем
- •3.2 Принципы построения микроаналитических систем
- •3.3 Функциональные элементы микроаналитических систем и некоторые инженерные решения по их реализации
- •3.4 Технологии микроаналитических систем
- •3.5. Лаборатории-на-кристалле
- •3.5.1. Газовый хроматограф
- •3.5.2. Жидкостный хроматограф
- •3.5.3. Детектирующие устройства микролабораторий
- •3.6 Эволюция сенсорной системы для определения альдегидоксидазы
- •4. Проектирование элементов микросистемной техники
- •4.1. Язык описания элементов микросистем vhdl-ams
- •4.2. Проектирование элементов мст в сапр Tanner Pro
- •4.2.1. Библиотека memsLib
- •4.2.2. Схемный редактор s-Edit
- •4.2.3. Редактор топологии l-Edit
- •4.2.4. Подсистема схемотехнического моделирования t-Spice
- •4.3. Проектирование элементов мст в сапр CoventorWare
- •4.3.1. Программа Architect
- •4.3.2. Программа Designer
- •4.3.3. Программа System Builder
- •4.3.4. Программа Analyser
- •4.4. Программа конечно-элементного моделирования ansys
- •4.4.1. Режимы работы программы ansys
- •4.4.2. Маршрут моделирования элементов мст в ansys
- •4.5 Перспективы развития микроаналитических систем
2.6.4. Биосенсоры с иодид-селективными электродами
Определение глюкозы. Как уже говорилось, в присутствии глюкозооксидазы глюкоза окисляется с образованием перекиси водорода. Если в смеси при этом присутствуют пероксидаза и йодид-ионы, то перекись водорода идет на окисление последних с образованием йода.
![]()
По скорости потребления иодид-ионов, измеряемой с помощью иодид-селективного электрода, можно судить о концентрации Н202, а значит, и глюкозы.
Определение фенилаланина. В биосенсоре для определения фенилаланина на поверхности йопид-селективного электрода в полиакриламидном геле иммобилизована L-аминооксидаза (L-AO) и пероксидаза. Принцип работы этого биосенсора сходен с предыдущим.
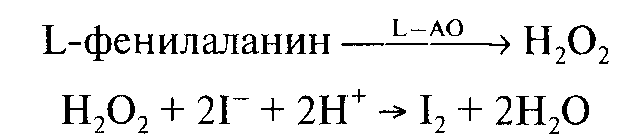
Впрочем, он менее селективен, чем биосенсор на основе аммиакчувствительного электрода.
Определение эстрадиола. Определение эстрадиола проводят с помощью конкурентного иммуноанализа с применением йодид-селективного электрода. На поверхности электрода адсорбирована желатиновая мембрана с иммобилизованными в ней антителами против 17(3-эстрадиола. Электрод помещают в раствор, в котором присутствует смесь свободного эстрадиола и эстрадиода, меченного пероксидазой (рис. 5.5а). Чем меньше концентрация свободного эстрадиола, тем больше меченного эстрадиола связывается с мембраной. При добавлении в раствор Н202 и I- в качестве субстрата пероксидазы в мембране электрода происходит ферментативное окисление йодид-ионов с образованием йода. При этом возникающий на йодид-селективном электроде потенциал пропорционален количеству связанной пероксидазы, а значит, обратно пропорционален логарифму концентрации эстрадиола (рис. 2.19).

Рис. 2.19. Определение 17-эстрадиола с помощью йодид-селективного электрода:
а) схема анализа;
б) калибровочная кривая, отражающая зависимость электродного потенциала от концентрации аналита
2.6.5. Биосенсоры с Аg2s-чувствительными электродами
Определение цистеина. Определение цистеина с помощью Ag2S-чувствительных электродов может быть основано на неферментативном восстановлении цистеина и цистин, который образует с ионами Ag+ нерастворимый сульфид.
![]()
Более специфичное определение цистеина основано на его восста- новлении под действием р-цианоаланинсинтетазы:
![]()
Однако в этом случае цианидионы создают помехи на электроде.
2.6.6. Амперометрические биосенсоры
Определение глюкозы. Примерно в половине статей, посвященных разработке биосенсором, описываются биосенсоры для определения глюкозы. Дело тут не только в клинической значимости подобного анализа. Накопленный опыт позволяет на примере определения глюкозы сравнивать разные типы сенсоров и оценивать новые разработки.
Основные способы получения аналитического сигнала в глюкозных биосенсорах суммированы на рисунке 2.20. Все они основаны наиспользовании глюкозооксидазы.

Рис. 2.20 Способы получения аналитического сигнала при окислении глюкозы глюкозооксидазой (GOD)
I. В качестве продукта реакции окисления глюкозы образуется глюконовая кислота, что дает возможность в качестве аналитического сигнала использовать изменение рН:
![]()
2. В некоторых типах электродов может происходить реокисление восстановленной формы глюкозооксидаз:
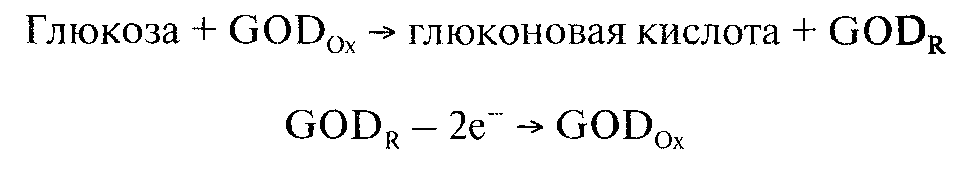
Это позволяет использовать в качестве аналитического сигнала величину анодного тока.
3. В ходе окисления глюкозы потребляется кислопод:

По уменьшению его концентрации, определяемой с помощью элек- трода Кларка, можно определять концентрацию глюкозы.
4. Если катод в электроде Кларка сделать анодом, поменяв поляр- ность включения электрода-трансдьюсера, то при потенциале +0,6 В будет происходить окисление перекиси водорода:
![]()
5. Образующаяся при окислении глюкозы перекись водорода в присутствии пероксидазы (РО) окисляет йодид-ион до йода. В этом случае концентрацию глюкозы можно определять, измеряя концентра- цию йодид-иона с помощью йодид-селективного электрода:
![]()
6. В качестве окислителя можно использовать не кислород, а меди- итор, например, ферроцен (Fc):
![]()
Определение лактата. Содержание лактата в крови — важный показатель интенсивности мышечной деятельности. В основе определения лактата биосенсорами могут лежать четыре разные реакции. В двух из приведенных ниже примеров в качестве окислителя лактата выступает кислород, а в двух другихмедиаторы.

Определение холестерина. Полагают, что повышенный уровень холестерина в крови коррелируетс риском ишемической болезни сердца.
Биосенсоры на холестерин могут быть основаны на использовании именно таких пар ферментов. В одном из них (рис. 2.21) задействована система сопряжения, включающая NAD+/NADH, диафоразу и ферро цен в качестве медиатора. В другом (рис. 2.22) используется система е пероксидазой и ферроценом. Наконец, в третьем биосенсоре используется тонкая электрохимическая ячейка, в которой происходит прямой перенос электронов с холестериноцсидазы на ферроцен.

Рис. 2.21. Система сопряжения в биосенсоре на холестерин, включающая NAD+/NADH, диафоразу и ферроцен в качестве медиатора:
1) холестеринэстераза;
2) холестериндегидрогеназа

Рис. 2.21. Система сопряжения в биосенсоре на холестерин, включающая окисление холестерина кислородом с образованием перекиси водорода, пероксидазу и ферроцен:
1) холестеринэстераза;
2) холестериноксидаза
Определение фосфата. Для определения фосфата также можно воспользоваться глюкозным биосенсором. В основе метода лежит тот факт, что фосфат ингибирует щелочную фосфатазу (АР) - фермент, катализирующий превращение глюкозо-6-фосфата в глюкозу.
![]()
Таким образом, сравнивая количество образующейся глюкозы в отсутствие и в присутствии ингибитора, можно определить концентрацию фосфата.
Определение крахмала. Разработан биосенсор для определения крахмала, схема которого представлена на рисунке 2.23.

Рис. 2.23. Схема работы двухмембранного биосенсора для определения крахмала с элиминацией свободной глюкозы: аА — а-амилаза; GOD — глюкозооксидаза; С — каталаза; GA — глюкоамилаза
Сенсор основан на измерении концентрации перекиси водорода, образующейся при окислении глюкозы кислородом в присутствии глю- козооксидазы. Для того чтобы понять, как работает биосенсор, рас- смотрим показанные на рисунке ферментативные процессы. Под дей- ствием а-амилазы крахмал разрушается с образованием декстринов и мальтозы. Мальтоза же под действием иммобилизованной в биосенсо- ре глюкоамилазы превращается в глюкозу, которая затем и окисляется глюкозооксидазой с образованием перекиси водорода.
Биосенсор сконструирован таким образом, чтобы устранить помехи, создаваемые глюкозой, присутствующей в качестве примеси в опре- деляемом растворе. Для этого в биосенсоре имеются две мембраны. Глюкоамилаза и глюкозооксидаза иммобилизованы с внутренней сто- роны первой мембраны в приэлектродном пространстве. С внутренней стороны второй мембраны иммобилизованы глюкозооксидаза и ката- лаза. Первый из ферментов катализирует окисление глюкозы, попада- ющей в межмембранное пространство, а второй — окисление перекиси водорода с образованием кислорода. Таким образом, ни глюкоза, ни перекись водорода в качестве примесей не попадают в приэлектродное пространство.
Определение этанола. Для определения уровня этанола в крови разработано несколько типов биосенсоров.
В одном из них в качестве биологического материала используется суспензия бактерий — Acetobacter xylinium или Trichosporon brassicae. Оба вида бактерий катализируют аэробное окисление этанола в уксусную кислоту:
![]()
За реакцией следят с помощью кислородного электрода. В биосен- сорах описанного типа, разработанных в Японии, бактерии иммобили- зованы методом капсулирования. Линейный диапазон подобных биосенсоров составляет 5—72 мМ.
В биосенсорах другого типа окисление этанола в уксусную кислоту происходит под действием алкогольдегидрогеназы (ADH), а электроны переносятся на электрод через систему сопряжения, включающую пары NAD'/NADH и [Fe(CN)6]37[Fe(CN)6]4 (рис. 2.24).

Рис. 2.24. Схема сопряженных реакций в биосенсоре для определения этанола, включающая алкоголь- дегидрогеназу, систему NAD+/NADH и [Fe(CN)6]3-/4-
Определение аспирина. Аспирин оказывает терапевтический эффект, когда его концентрация и крови составляет 1,1 —1,2 мМ.
Традиционно уровень аспирина контролируют спектрофотометры по образованию окрашенного комплекса салициловой кислоты с Fe3+. (В салициловую кислоту аспирин превращается в организме под действием эстераз печени).
Однако этот метод неспецифичен. Другой метод определения сали циловой кислоты основан на ее специфическом окислении в катехол п присутствии бактериального фермента — NADH-зависимой салит i латгидроксилазы. На основе этого метода автором данной книги разра батывается биосенсор, в котором катехол окисляется на печатном грл фитовом электроде.

Рис. 2.25. Гидролиз ацетилсалициловой кислоты (аспирина) и последующее превращение салициловой кислоты в катехол под действием салицицилатгидроксилазы
Определение парацетамола (н-ацетил-п-аминофенола). Парацетамол сегодня широко употребляют в качестве обезболивающегоЦ| средства. Однако его передозировка ведет к необратимому поражению печени. По этой причине необходимо иметь метод быстрого опре- деления концентрации парацетамола в крови, для чего очень удобно было бы использовать биосенсор. В принципе парацетамол может лег- ко окисляться на угольно-пастовом электроде, но такой электрод сам но себе неселективен. Для придания ему селективности можно исполь- юпать фермент арилациламидазу, который катализирует превращение парацетамола в п-аминофенол. Последний может окисляться на элек- троде в хинонимин при значительно меньшем потенциале, чем сам па- рацетамол. В качестве электрода в этом случае можно использовать пе- чатный графитовый электрод. Схема реакций, иллюстрирующая оба способа определения парацетамола, представлена на рисунке 2.26.

Рис. 2.26. Определение парацетамола:
