
- •Внешний фотоэффект, законы Столетова
- •Формула Эйнштейна. Вах фотоэффекта
- •Запирающее напряжение и его зависимость от длины волны
- •Красная граница фотоэффекта
- •Строение атома, опыт Резерфорда
- •Постулаты Бора, радиус электронной орбиты
- •Энергия электронов в атоме
- •Гипотеза де Бройля
- •Соотношение неопределенностей Гейзенберга
- •Уравнение Шредингера, волновая функция
- •Решение уравнения Шредингера для потенциальной ямы
- •Уравнение Шредингера для электрона в атоме, квантовые числа
- •Спектры излучения атомов, правила отпора
- •Распределение электронов по уровням
- •Закон Мозли
- •Формулировка закона Мозли
- •Рентгеновское излучение
- •Физика твердого тела
- •Распределение Ферми-Дирака
- •Собственные полупроводники
- •Примесные полупроводники
- •Основные и неосновные носители зарядов
Уравнение Шредингера для электрона в атоме, квантовые числа
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного литияLi++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1),
![]() (223.1)
(223.1)
где r — расстояние между электроном и ядром. Графически функция U(r) изображена жирной кривой на рис. 302. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера (217.5), учитывающему значение (223.1):
![]() (223.2)
(223.2)
где т — масса электрона, Е — полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения (223.2) обычно используют сферическую систему координат: r, q, j. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 доn-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
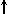 и
и 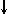 .
.
Спектры излучения атомов, правила отпора
Излучение
оптических спектров показало,
что сложные вещества (состоящие из
разных атомов) при нагреве испускают
электромагнитные волны всех длин в
видимом диапазоне (Например: солнце,
лампы накаливания).
![]() Однако
чистые вещества, многоатомные, имеют
спектры испускания, состоящие из
отдельных длин волн.
Однако
чистые вещества, многоатомные, имеют
спектры испускания, состоящие из
отдельных длин волн.
Эмпирически
(путём подбора чисел) было установлено,
что длины волн в видимой части
электромагнитных волн для водородного
газа определялись λ
= λ0n2 /
(n2 -
4), где n -
целое число, которое отсчитывается от
цифры 3. Так как ν
= c/λ или λ
= c/ν, то подставив это
в эмпирическую формулу, получим ν
= ν0*(n2 -
4) / n2 = ν0*(1
- 4/n2)
= 4ν0*(1/22 -
1/n2).
![]() –
это формула, впервые найденная Бальмером
для определения частоты испускания
электромагнитного излучения атомарным
водородом.
–
это формула, впервые найденная Бальмером
для определения частоты испускания
электромагнитного излучения атомарным
водородом.
Спектр
излучения атомарного водорода состоит
из отдельных спектральных линий,
расположенных в определенном порядке.
Спектральные линии образуют серии,
линии которых могут быть представлены
в виде обобщенной (сериальной) формулы
Бальмера:
![]() где m и n –
номера состояний, R – постоянная
Ридберга. При заданном m число n принимает
все целочисленные значения, начиная
с m+1.
где m и n –
номера состояний, R – постоянная
Ридберга. При заданном m число n принимает
все целочисленные значения, начиная
с m+1.
m = 1 – серия Лаймана (для ультрафиолетовой области);
m = 2 – серия Бальмера;
m = 3 – серия Пашена;
m = 4 – серия Брэкета;
m = 5 – серия Пфунда.
Если в обобщенной формуле Бальмера n>m, то спектр испускания; если m>n, то спектр поглощения. Таким образом, эмпирически ещё до введения теорий Планка и Эйнштейна анализ спектров излучения чистых веществ, проведённый Бальмером, предвосхитил осмысление положения об электромагнитном излучении как о потоке дискретных порций энергии, не отрицая в то же время проявления волновых свойств электромагнитного излучения.
Правилами отбора в спектроскопии называют ограничения и запрет на переходы между уровнями квантомеханической системы с поглощением или излучением фотона, наложенные законами сохранения и симметрией.
Гармонический осциллятор
Разрешенные переходы гармонического осциллятора удовлетворяют правилу отбора:
![]() ,
,
где nf и ni — квантовые числа конечного и начального состояния соответственно. То есть, переходы могут происходить только между соседними состояниями. Учитывая то, что состояния гармонического осциллятора эквидистантны, это приводит к существованию в спектре излучения или поглощения единой линии.
Магнитное квантовое число
Для магнитного квантового числа
![]() .
.
Свет,
который испускается при переходе с ![]() ,
линейно поляризован.
При переходах с
,
линейно поляризован.
При переходах с ![]() испускается
циркулярно поляризованный свет.
испускается
циркулярно поляризованный свет.
Квантовое число полного момента
Для квантового числа полного момента многоэлектронной системы
![]() .
.
Кроме того, запрещены переходы между состояниями, в которых оба квантовых числа полного момента равны нулю.
Орбитальное квантовое число
Для орбитального квантового числа
![]() .
.
