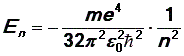- •Внешний фотоэффект, законы Столетова
- •Формула Эйнштейна. Вах фотоэффекта
- •Запирающее напряжение и его зависимость от длины волны
- •Красная граница фотоэффекта
- •Строение атома, опыт Резерфорда
- •Постулаты Бора, радиус электронной орбиты
- •Энергия электронов в атоме
- •Гипотеза де Бройля
- •Соотношение неопределенностей Гейзенберга
- •Уравнение Шредингера, волновая функция
- •Решение уравнения Шредингера для потенциальной ямы
- •Уравнение Шредингера для электрона в атоме, квантовые числа
- •Спектры излучения атомов, правила отпора
- •Распределение электронов по уровням
- •Закон Мозли
- •Формулировка закона Мозли
- •Рентгеновское излучение
- •Физика твердого тела
- •Распределение Ферми-Дирака
- •Собственные полупроводники
- •Примесные полупроводники
- •Основные и неосновные носители зарядов
Энергия электронов в атоме
|
(10) |
Уравнение (10) определяет разрешенные значения энергии электрона в атоме водорода. Число n принимает целые значения n = 1,2,3, …¥ . Таким образом, энергия электрона в атоме водорода может иметь не любые значения, а только дискретный набор значений, определяемых числом n, или, как говорят, энергия электрона квантуется.
Подставляя
значения массы
и заряда электрона, постоянных
![]() в
уравнение (10) и выражая энергию
в электронвольтах
(эВ) (1эВ
= 1,6.10-19 Дж), получим
формулу
в
уравнение (10) и выражая энергию
в электронвольтах
(эВ) (1эВ
= 1,6.10-19 Дж), получим
формулу
|
(11) |
Энергия основного состояния (при n = 1), равна E1= - 13,6 эВ. На рис. 1 приведена диаграмма энергетических уровней электрона в атоме водорода, на которой горизонтальными прямыми отмечены разрешенные значения энергии. Все состояния с величиной n= 1 … ¥ являются связанными. При увеличении числа n энергетические уровни сближаются все больше и больше. При n ® ¥ E ® 0. Энергетические состояния с энергией E ³ 0 соответствуют тому, что электрон становится свободным (не связанным с ядром).
Гипотеза де Бройля
Гипотеза де Бройля заключается в том, что французский физик Луи де Бройль выдвинул идею приписать волновые свойства электрону. Проводя аналогию между квантом, де Бройль предположил, что движение электрона или какой-либо другой частицы, обладающей массой покоя, связано с волновым процессом.
Гипотеза де Бройля устанавливает, что движущейся частице, обладающей энергией E и импульсом p, соответствует волновой процесс, частота которого равна:
![]()
а длина волны:
![]()
где p - импульс движущейся частицы.
Соотношение неопределенностей Гейзенберга
В 1927 г. В. ГЕЙЗЕНБЕРГ установил, что при наличии у частиц волновых свойств существует связь между неопределенностями координат и соответствующими неопределенностями компонент импульса частицы. Эта связь имеет вид неравенств:
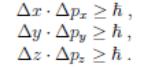
Эти соотношения играют важную роль, позволяя очертить границы применимости классической механики, в которой, в отличие от квантовой механики, пренебрегают волновыми свойствами частиц.
Из соотношений Гейзенберга (??) следует, что из-за наличия у частицы волновых свойств нельзя одновременно точно измерить координату частицы, например x, и соответствующую проекцию импульса ∆px. Действительно, при одновременном точном измерении этих величин ∆x → 0 и ∆px → 0. Но это противоречит неравенствам (??). Отсюда следует, в частности, что в квантовой механике для описания движения частицы нельзя использовать представление о движении частицы по определённой траектории, так как такое движение предполагает возможность одновременного точного определения и координат, и импульса (скорости)частицы.
Аналогичные соотношения неопределённостей в квантовой механике записываются и для других пар физических величин. Так, например, энергия системы, существующей в течение промежутка времени ∆t, имеет неопределённость ∆E, причём
∆E · ∆t > ~ (2.21)
Ограничения на информацию о движении частицы и её состоянии, вытекающие из соотношений неопределённостей, оказываются несущественными для лабораторных макроскопических масштабов. Однако эти ограничения становятся существенными для малых масштабов расстояний, импульсов, энергий и времён жизни частиц, с которыми мы сталкиваемся в атомной и ядерной физике и в физике элементарных частиц.