
kossitsky
.pdf
небольшой ответ; по мере усиления раздражения амплитуда потенциала возрастает, достигая максимальной величины, и затем остается постоянной, несмотря на дальнейшее увеличение силы раздражителя (рис. 47). Объясняется это тем, что электрический ответ целого нервного ствола является алгебраической суммой потенциалов действия отдельных его волокон. В каждом волокне амплитуда потенциала действия не зависит of силы раздражения в соответствии с законом «все или ничего». Пороги раздражения отдельных волокон отличаются друг от друга. При слабой силе стимула возбуждение возникает в наиболее возбудимых поверхностно расположенных нервных 'волокнах. Усиление стимула приводит к увеличению числа возбужденных волокон, поэтому суммарный ответ на раздражение увеличивается до тех пор, пока все волокна не вовлекаются в реакцию.
Такую картину можно наблюдать, если отводящие электроды расположить на нерве вблизи раздражающих электродов. При увеличении расстояния между этими двумя парами электродов суммарный потенциал действия начинает расчленяться на несколько отдельных колебаний, которые становятся наиболее отчетливо выраженными при удалении отводящих электродов на 10—15 см от места раздражения (рис. 48). Впервые это явление было подробно изучено Эрлангером и Гассером (1937). Они показали, что причиной расчленения суммарного потенциала действия на компоненты является неодинаковая скорость проведения возбуждения по разным волокнам, вследствие чего к отводящим электродам нервные импульсы поступают по этим волокнам неодновременно.
В настоящее время нервные, волокна по скорости проведения возбуждения, длительности различных фаз потенциала действия и строению принято подразделять на три основных типа, обозначаемых буквами А, В и С (рис. 49).
Волокна типа А делятся на четыре подгруппы: ос, (5, у, б. Они покрыты миелиновой оболочкой. Наиболее толстые их них α-волокна (Аα), у теплокровных животных и человека они имеют диаметр 12—22 мкм и характеризуются значительной скоростью проведения возбуждения — 70—120 м/с. Такие волокна проводят возбуждение от моторных нервных центров спинного мозга к скелетным мышцам (двигательные волокна) и от определенных рецепторов мышц к соответствующим нервным центрам. Пик потенциала действия волокна Аα у теплокровных длится 0,4—0,5 мс. После его окончания развивается следовая деполяризация, которая продолжается 15—20 мс и переходит в следовую гиперполяризацию длительностью около 40—60 мс.
Три другие группы волокон типа А: Ар, Аγ и Аδ — имеют меньший диаметр, меньшую скорость проведения и более длительный потенциал действия. Это преимущественно чувствительные волокна, проводящие возбуждение от различных рецепторов (тактильных, некоторых болевых, температурных и рецепторов внутренних органов) в ЦНС.
71

Исключение составляют лишь γ-волокна, значительная часть которых проводит возбуждение в центробежном направлении от клеток спинного мозга к так называемым интрафузальным мышечным волокнам, входящим в состав рецепторов мышц — мышечных веретен (см. рис. 51, А).
К волокнам типа В относятся миелинизированные, преимущественно преганглионарные, волокна вегетативной нервной системы. Скорость проведения возбуждения в этих волокнах у теплокровных животных составляет 3—18 м/с. Продолжительность потенциала действия волокон типа В (1—2 мс) примерно в 3 раза превышает длительность потенциала действия волокон типа А. Отличительной особенностью этих волокон является то, что в них не обнаруживается фаза следовой деполяризации: нисходящее колено пика непосредственно переходит в следовую гиперполяризацию, которая в ряде случаев продолжается более 100 мс.
К волокнам типа С относят безмякотные нервные волокна очень малого диаметра (примерно 1 мкм). Скорость проведения возбуждения в этих волокнах не более 3 м/с. Большинство волокон типа С — это постганглионарные волокна симпатической нервной системы.
К волокнам типа С относят также те нервные волокна, которые участвуют в проведении возбуждения от болевых рецепторов и некоторых рецепторов холода, тепла и давления.
Потенциалы действия волокон этого типа характеризуются наибольшей продолжительностью (2 мс у теплокровных животных)., Они имеют длительную фазу следовой деполяризации (50—80 мс), сопровождающуюся еще более продолжительной (300 — 1000 мс) следовой гиперполяризацией. Все эти данные суммированы в табл. 3.
72
ИССЛЕДОВАНИЕ СКОРОСТИ ПРОВЕДЕНИЯ ВОЗБУЖДЕНИЯ ПО НЕРВНЫМ ВОЛОКНАМ У ЧЕЛОВЕКА
Скорость проведения возбуждения по нервным волокнам может быть определена у человека сравнительно несложным путем. Для определения скорости проведения по двигательным волокнам используется электрическая стимуляция нерва через кожу в тех местах, где он расположен неглубоко. Используя электромиографическую методику, записывают электрический ответ мышцы на это раздражение. Латентный период ответа в основном зависит от скорости проведения по нерву. Измерив его, а также расстояние между стимулирующими и отводящими электродами, можно рассчитать скорость проведения. Более точно ее можно определить по разности латентного ответа при раздражении нерва в двух точках. Для определения скорости проведения по чувствительным волокнам наносят кожное электрическое раздражение, а ответ отводится от нерва.
В связи с тем что высокая скорость проведения по нервным волокнам обусловлена миелиновой оболочкой, нарушения ее, наблюдающиеся при ряде заболеваний нервной системы, сопровождаются снижением скорости проведения возбуждения. Поэтому методика определения скорости проведения по нервным волокнам широко используется в неврологических клиниках для диагностических целей. .
ХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В НЕРВЕ В ПОКОЕ И ПРИ ПРОВЕДЕНИИ ВОЗБУЖДЕНИЯ
Нерв в состоянии покоя потребляет' кислород и выделяет углекислоту. Если один участок нерва поместить в атмосферу азота, а другой оставить в воздухе, то уже через несколько минут можно обнаружить, что поверхность нерва, лишенная кислорода, приобретает электроотрицательный заряд. Объясняется это тем, что в бескислородной среде вследствие изменения обменных процессов нарушается работа натрий-калиевого насоса, в результате чего происходит прогрессирующая деполяризация мембраны нервных волокон. Примерно через l'/2 ч потенциал покоя падает настолько, что проведение нервных импульсов на этом участке нерва полностью прекращается. При возвращении нерва в атмосферу кислорода потенциал покоя быстро восстанавливается и даже на некоторое время становится больше исходной величины. Одновременно восстанавливается и проведение возбуждения.
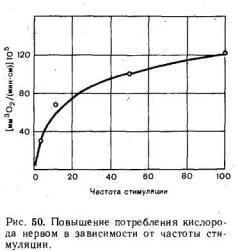
Возбуждение нерва сопровождается повышением потребления кислорода, причем по мере увеличения частоты раздражения поглощение кислорода возрастает (рис. 50). Вместе с тем отмечаются увеличение распада богатых энергией фосфорных соединений — аденозиктрифосфата и креатинфосфата и повышенное образование молочной кислоты (за счет анаэробного расщепления глюкозы и гликогена).
При возбуждении усиливается также белковый обмен в нервных волокнах, о чем свидетельствует, в частности, выделение значительных количеств аммиака. Предполагают, что аммиак образуется в результате расщепления глутамина. Интенсивное раздражение нерва вызывает, кроме того, усиление обмена нуклеиновых кислот и фосфолипидов.
При раздражении большинства мякотных нервных волокон из них высвобождается ацетилхолин, из безмякотных симпатических нервных волокон — норадреналин.
Наличие ацетилхолина в одних нервных волокнах и норадреналина в других свидетельствует о химической-гетерогенности разных типов нервных волокон.
В нервных окончаниях ацетилхолин и норадреналин являются химическими передатчиками нервного импульса — медиаторами.
7
3
Синтезируемые в соме нервных клеток медиаторы диффундируют вдоль этих волокон к нервным окончаниям, из которых они и" выделяются при возбуждении.
ТЕПЛОПРОДУКЦИЯ НЕРВА
О динамике обмена веществ нерва в покое и при возбуждении можно судить по его теплопродукции, которую впервые удалось зарегистрировать Хиллу в 1926 г. при помощи специально сконструированных высокочувствительных термоэлементов.
Теплообразование седалищного нерва лягушки, измеренное в покое, составляет 4,14*10-3 кал на 1 г нерва в минуту при 20 ˚ С. Теплообразование безмякотного нерва краба несколько выше: 1 • 10-2 кал на 1 г в минуту при 20 °С. Это согласуется с данными о значительно большем потреблении кислорода безмякотными нервами в покое. Если поместить нерв в атмосферу азота, теплообразование покоя резко снижается.
При раздражении нерва теплообразование значительно возрастает. Так же как и в мышце, тепло выделяется в две фазы, которые обозначаются как начальное и запаздывающее теплообразование.
Новейшие исследования, проведенные при помощи высокочувствительной и малоинерционной аппаратуры, показали, что начальное теплообразование непосредственно связано с процессом генерации потенциала действия. Так установлено, что подъем потенциала действия сопровождается выделением небольшой порции тепла, а окончание пика — его поглощением. Запаздывающее теплообразование после ритмического раздражения нерва продолжается десятки минут.
УТОМЛЕНИЕ НЕРВА
Впервые Н. Е. Введенский установил, что нерв в атмосфере воздуха сохраняет способность к проведению возбуждений даже при многочасовом (около 8 ч) непрерывном раздражении. Это свидетельствует о том, что нерв в атмосфере воздуха практически не утомляем или малоутомляем.
Относительная неутомляемость нерва отчасти зависит от того, что он тратит при своем возбуждении сравнительно мало энергии. Так, 1 г нерва лягушки выделяет при максимальном раздражении только на 20—100 % больше тепла, чем в покое. Такой прирост очень незначителен по сравнению с наблюдаемым при возбуждении мышцы. Благодаря этому процессы ресинтеза в нерве в состоянии покрывать его относительно малые расходы энергии при возбуждении даже в том случае, если оно длится много часов.
Энергетические траты при возбуждении нервных волокон связаны главным образом с работой натрий-калиевого насоса, который активируется поступлением внутрь цитоплазмы Na+. В условиях нормального кровоснабжения нерва натрий-калиевый насос обеспечивает устойчивое поддержание ионного состава цитоплазмы, так как число ионов Na+, поступающих внутрь волокна, и К+, покидающих волокно при каждом импульсе, очень мало по сравнению с общим их содержанием в цитоплазме и межклеточной жидкости. Если принять, что число ионов, пересекающих единицу площади мембраны, в различных волокнах одинаково, то в этом случае изменение концентрации этих ионов в цитоплазме должне быть обратно пропорционально диаметру волокна. Поэтому волокно диаметром 0,5 мкм при каждом импульсе должно терять '/1000содержания К+ вместо '/1 0 0 0 0 0 0 , как это наблюдается в гигантских аксонах кальмара. Этим, по-видимому, и объясняется тот факт, что тонкие нервные волокна утомляются значительно быстрее, чем толстые.
НЕРВНО-МЫШЕЧНАЯ ПЕРЕДАЧА
Впредыдущих разделах было показано, что проведение возбуждения в нервных
имышечных волокнах осуществляется при помощи электрических импульсов, распространяющихся по поверхностной мембране. Передача возбуждения с нервного волокна
74

на мышечное основана на совершенно ином механизме. Она происходит в результате выделения нервными окончаниями химических соединений — медиаторов (передатчиков) нервного импульса. У человека, как и у всех позвоночных, роль медиатора в скелетных мышцах играет ацетилхолйн.
Предположение, что в передаче возбуждения в нервно-мышечном соединении принимают участие какие-то химические агенты, впервые было высказано А. Ф. Самойловым в 1924 г. Позднее Дейл (1936) показал, что при раздражении двигательного нерва в его окончаниях в скелетной мышце происходит выделение ацетилхолина. Наконец, было установлено, что ацетилхолйн, подведенный к области нервно-мышечного соединения, деполяризует мембрану мышечного волокна и при достаточно высокой концентрации вызывает распространяющееся возбуждение и сокращение мышцы.
НЕРВНО-МЫШЕЧНОЕ СОЕДИНЕНИЕ (СИНАПС)
Структурное образование, обеспечивающее переход возбуждения с нервного волокна на иннервируемую им клетку — мышечную, нервную или железистую, получило название синапса.
Электронно-микроскопические исследования выявили, что так же как в ЦНС, на периферии синапсы состоят из трех основных элементов: пресинаптической мембраны,
постсинаптической мембраны и синаптической щели (рис. 52).
75
Пресинаптической называется мембрана, покрывающая нервное окончание, которое представляет собой своеобразный нейросекреторный аппарат. Здесь содержится и выделяется медиатор, оказывающий возбуждающее или тормозящее действие на иннервируемую клетку.
В скелетной мышце позвоночных двигательное миелиновое нервное волокно разветвляется веерообразно на концевые безмякотные волокна диаметром около 1,5 мкм. На всем этом концевом участке нервное волокно (пресинаптическое окончание) образует синаптическое соединение с мышечным волокном. Вся область мышечного волокна, в которой расположены синапсы, образованные двигательным нервным волокном, называют концевой пластинкой (бляшкой; пуговкой).
В пресинаптических окончаниях медиатор ацетилхолин содержится в «пузырьках» диаметром около 50 нм. При достижении распространяющегося потенциала действия области пресинаптичёского окончания ацетилхолин освобождается из «пузырьков» и выходит в синаптическую щель. В механизме этого нейросекреторного процесса важную роль играют ионы Са2+: они поступают внутрь окончания из внеклеточной жидкости по электровозбудимым кальциевым каналам, активируемым при деполяризации пресинаптической мембраны приходящим потенциалом действия. При этом наблюдается следующая цепь процессов: деполяризация пресинаптической мембраны при проведении нервного импульса → открывание кальциевых каналов → вхождение ионов Са2+ внутрь окончания→ выделение медиатора в синаптическую щель. Ширина
последней примерно 50 нм; она заполнена межклеточной жидкостью, которая по составу приближается к плазме крови. Медиатор быстро диффундирует через щель, воздействуя на мембрану иннервируемого мышечного волокна. Та часть мембраны этого волокна, которая непосредственно граничит с нервным окончанием, называется постсинаптической. От мембраны, покрывающей остальную часть мышечного волокна, постсинаптическая мембрана отличается тем, что не содержит электрически возбудимых ионных каналов и потому не способна к генерации потенциала действия. Постсинаптическая мембрана обладает, однако, химической возбудимостью: на действие ацетилхолина она отвечает местным изменением проницаемости для ионов Na+ и К+, что приводит к развитию так называемого потенциала концевой пластинки (ПКП). По своей природе он аналогичен возбуждающим постсинаптическим потенциалам, возникающим при передаче возбуждения с одной нервной клетки на другую. ПКП порождает генерацию потенциала действия в мышечном волокне. Наличие химического звена в механизме нервно-мышечной передачи делает понятным два общих свойства синапсов: 1) возбуждение проводится через синапс только в одном направлении — с нерва на мышцу; 2) возбуждение проводится через синапс значительно медленнее, чем по нервному волокну.
Односторонность проведения обусловлена наличием относительно широкой синаптической щели, препятствующей проведению импульса с помощью локальных токов с мышцы на нерв. Замедление проведения через синапс объясняется тем, что это проведение является многоэтапным процессом: время затрачивается на секрецию медиатора, его диффузию к постсинаптической мембране, активацию последней, рост ПКП до пороговой величины.
Механизмы возникновения ПКП и ПД в мышечном волокне. Хемовозбудимые
каналы. ПКП обусловлен активацией ацетилхолином хемовозбудимых ионных каналов, имеющихся в постсинаптической мембране скелетного мышечного волокна. Так же как электровозбудимые, хемовозбудимые каналы образованы макромолекулами белка, пронизывающими липидный бислой мембраны. Функциональная структура хемовозбудимого канала схематически показана на рис. 53. Канал состоит из транспортной системы, воротного механизма и участка связывания — «холинорецептора», обладающего высоким сродством к медиатору ацетилхолину. В отсутствие ацетилхолина канал закрыт. Взаимодействие медиатора с рецептором приводит к активации канала. В открытом состоянии канал имеет проводимость порядка 30 пк Смс, что примерно в 4 раза превышает проводимость одиночного электровозбудимого натриевого канала. Судя по величине
76

наибольшего катиона, проникающего через рассматриваемые хемовозбудимые каналы, размер их «пор» составляет примерно 0,65 нм, т. е. существенно превышает размер «пор» в электровозбудимых натриевых и калиевых каналах. Соответственно ионная селективность хемовозбудимых каналов значительно ниже, они хорошо проницаемы и для ионов Na+ и для ионов Са2+, К+. Эти ионы движутся через открытые каналы по концентрационному и электрическому градиентам, и, поскольку внутреннее содержимое мышечного волокна заряжено электроотрицательно по отношению к наружному раствору, поток положительно, заряженных ионов Na+ внутрь клетки превышает противоположно направленный поток ионов К+- В результате мембрана деполяризуется. Эта деполяри-- зация постсинаптической мембраны имеет, однако, нерегенеративный характер, поскольку хемовозбудимые каналы не обладают электровозбудимостью: порция ацетилхолина, поступившая к постсинаптической мембране, активирует определенное число хемовозбудимых каналов. Это вызывает деполяризацию мембраны, но такая деполяризация не способствует дальнейшему увеличению числа активируемых каналов. Поэтому значение ПКП зависит от концентрации ацетилхолина, действующего на мембрану: чем больше эта концентрация, тем выше до определенного предела ПКП. Таким образом, ПКП в отличие от потенциала действия градуален. В этом отношении он сходен с локальным ответом, хотя имеет иной механизм.
Между деполяризованной ацетилхолином постсинаптической мембраной и соседними с ней участками электровозбудимой мембраны скелетного мышечного волокма возникают местные токи, вызывающие генерацию потенциала действия, распространяющегося по всему мышечному волокну. Условием возникновения этого потенциала действия является критическая деполяризация электровозбудимой мембраны, происходящая при достижении ПКП пороговой величины.
Процесс передачи возбуждения с нервного волокна на скелетное мышечное может быть схематически изображен в виде следующей цепи явлений: нервный импульс→ поступление ионов Са2+ внутрь нервного окончания→ освобождение из окончания ацетилхолина→ взаимодействие ацетилхолина с холинорецептором → активация хемовозбудимых каналов постсинаптической мембраны в результате взаимодействия медиатора с холинорецепторами → возникновение потенциала концевой пластинки → критическая деполяризация околосинаптической электровозбудимой мембраны → генерация потенциала действия.
77
Миниатюрные постсинаптические потенциалы
Ацетилхолин секретируется двигательными нервными окончаниями не только при возбуждении, но и в покое. Различие состоит лишь в том, что влокое выделяются малые порции — «кванты» — ацетилхолина, а под влиянием нервного импульса в синаптическую щель одновременно выбрасывается значительное количество таких «квантов». «Квант» представляет собой «пакет» молекул медиатора в единичном пузырьке нервного окончания, изливающем свое содержимое в синаптическую щель. В концевой пластинке различных животных в каждом «кванте» /содержится до 2000 молекул ацетилхолина. Выделение отдельных квантов в синаптическую щель в состоянии покоя вызывает кратковременную слабую деполяризацию постсинаптической мембраны мышечнбго волокна. Такая деполяризация получила название миниатюрного потенциала, поскольку она по своей амплитуде (0,5 мВ) в 50—80 раз меньше ПКП, вызываемого одиночным нервным импульсом. Миниатюрные потенциалы возникают обычно с частотой примерно один в секунду, они зарегистрированы не только в нервно-мышечных соединениях, но и в синапсах нервных клеток ЦНС.
Влияние кураре на нервно-мышечное соединение
Существует ряд веществ, также обладающих сродством к холинорецептору, но образующих с ним более прочную связь, чем ацетилхолин. К числу таких веществ относятся кураре и некоторые другие соединения (д-тубокурарин, диплацин, флакседил). После их воздействия на мышцу холинорецептор оказывается заблокированным и ни нервный импульс, ни искусственно введенный ацетилхолин не способны вызвать возбуждение мышечного волокна.
Многие годы изучение действия кураре на нервно-мышечную передачу представляло только теоретический интерес, и физиологи были очень далеки от мысли, что этот препарат может когдалибо найти применение в медицинской практике. Однако в связи с развитием хирургии возникла необходимость изыскания средств, которые позволили бы проводить оперативные вмешательства в условиях выключения естественного дыхания. И здесь кураре и его производные оказали большую помощь. В настоящее время многие полостные операции проводят в условиях искусственного дыхания на фоне нервно-мышечной блокады препаратами, действующими подобно кураре.
Исключительно прочную связь с холинорецептором образует токсин из яда змеи — а-бунга- ротоксин. Этот токсин, снабженный радиоактивной меткой, позволил выделить холинорецептор из мембраны. Химический анализ холинорецептора показал, что холинорецептор является липопротеидом с молекулярной массой около 300 000.
Холинэстераза и ее роль в процессах нервно-мышечной передачи
Установлено, что в области нервно-мышечного соединения в больших концентрациях присутствует фермент холинэстераза, способная быстро расщеплять ацетилхолин, выделяющийся в нервном окончании. Значение этого процесса становится ясным, если учесть, что в естественных условиях к мышце поступают быстро следующие друг за другом нервные импульсы и постсинаптическая мембрана, деполяризованная предшествующей порцией ацетилхолина, становится малочувствительной к действию следующей порции. Чтобы идущие друг за другом нервные импульсы могли осуществлять нормальное возбуждающее действие, необходимо к моменту прихода каждого из них «убрать» предшествующую порцию медиатора. Эту функцию и выполняет холинэстераза. Холин, освобождающийся при расщеплении молекул ацетилхолина, переносится обратно в нервное окончание специальной транспортной системой, существующей впресинаатической мембране.
Существует ряд фармакологических агентов, обладающих способностью резко угнетать активность холинэстеразы. Их называют ингибиторами. К числу таких веществ
78

относятся эзерин, простигмин, гулантамин. Если на нервно-мышечное соединение действует какое-либо из этих веществ, постсинаптический потенциал увеличивается по своей амплитуде и резко растягивается по времени.
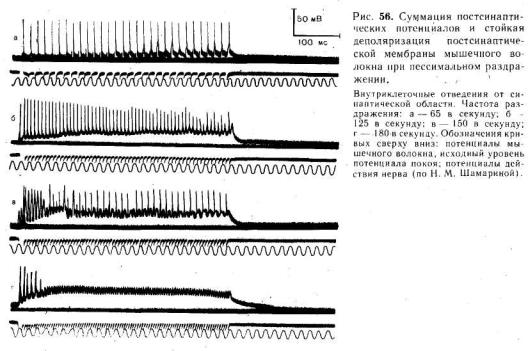
Иллюстрацией этого является приведенная на рис. 54 запись ПКП, зарегистрированного в нервно-мышечном соединении лягушки до (а) и после (б) воздействия на мышцу вещества, угнетающего активность холинэстеразы.
При действии ингибитора холинэстеразы ритмическое раздражение нерва вызывает выраженную суммацию ПКП, что ведет к стойкой деполяризации постсинаптической мембраны и блоку проведения импульсов с нервного волокна на мышечное. При этом стойкая деполяризация постсинаптической мембраны приводит соседние участки мышечного волокна в состояние угнетения, обусловленное инактивацией натриевой и стойким повышением калиевой проводимости мембраны (состояние «катодической депрессии»).
Следует отметить, что и в отсутствие ингибиторов холинэстеразы при условии очень частого раздражения нерва постсинаптические потенциалы (ПКП), вызываемые каждым нервным импульсом, суммируются, поскольку в межимпульсный интервал холинэстераза не успевает полностью расщепить выделяющийся в нервном окончании ацетилхолин. В результате суммации потенциалов портсинаптическая мембрана все более и более деполяризуется.
ПЕССИМАЛЬНОЕ ТОРМОЖЕНИЕ
Деполяризация постсинаптической мембраны при очень частом следовании друг за другом нервных импульсов лежит в основе открытого Н. Е. Введенским пессимального торможения. Это явление часто называют торможением Введенского. Сущность его состоит в следующем. Величина тетанического сокращения скелетной мышцы в ответ на ритмические раздражения нерва возрастает с увеличением частоты стимуляции. При некоторой оптимальной частоте раздражения тетанус достигает наибольшей величины. Если продолжать увеличивать частоту стимуляции нерва, то тетаническое сокращение мышцы начинает резко ослабевать и при некоторой большой пессимальной частоте раздражения нерва мышца, несмотря на продолжающееся раздражение, почти полностью расслабляется. Уменьшение частоты стимуляции тотчас приводит к восстановлению высокого уровня тетанического сокращения (рис. 55).
В нервно-мышечном препарате лягушки торможение Введенского возникает при частоте раздражения, близкой к 100 стимулам в секунду, т. е. при значительно меньших
79
частотах, чем те, которые может воспроизводить нерв (порядка 500) или мышца (порядка 200).
На рис. 56 приведена запись изменения мембранного потенциала мышечного волокна в области концевой пластинки при раздражении нерва ритмическими импульсами оптимальной и пессимальной частот. При редком (оптимальном) ритме каждый импульс попадает в фазу убывания постсинаптического потенциала, вызванного предыдущим импульсом, и в мышечном волокне возникают полноценные потенциалы действия. При частом раздражении постсинаптические потенциалы суммируются, что приводит к стойкой деполяризации постсинаптической мембраны и развитию блока проведения. На важную роль ацетилхолина в развитии пессимума Введенского указывает тот факт, что яды, инактивирующие холинэстеразу и тем самым способствующие накоплению в области синапса ацетилхолина, способствуют возникновению пессимума.
Следует подчеркнуть, что рассмотренный механизм блокирования нервно-мышеч- ного соединения при частом ритме раздражения нерва не является единственным. В тех случаях, когда частота стимулов очень высока, проведение возбуждения с нерва на мышцу может быть блокировано еще на пути к синапсу, в тонких пресинаптических разветвлениях нервных волокон — пресинаптических терминалях, обладающих более низкой лабильностью, чем толстые нервные волокна. Нарушение проведения в этих тонких нервных волокнах ведет к прекращению поступления нервных импульсов к нервному окончанию и тем самым к прекращению выделения ацетилхолина. В данном случае вместо стойкой деполяризации постсинаптической мембраны обнаруживается значительное ослабление или даже полное выпадение постсинаптнческих потенциалов при неизменном уровне потенциала покоя мышечного волокна.
Нарушение нервно-мышечной передачи при утомлении
При длительном раздражении нерва нарушение нервно-мышечной передачи развивается задолго до того, как мышца, а тем более нерв в силу утомления утрачивают способность к проведению возбуждения. Объясняют это тем, что в нервных окончаниях при длительном раздражении
80 •
