
- •Техническая термодинамика
- •Глава 1. Основные понятия и определения
- •§ 1. Предмет и метод термодинамики
- •§ 2. Работа и теплота
- •§ 3. Термодинамическая система
- •§ 4. Термодинамические параметры. Термическое уравнение состояния
- •§ 5. Термодинамические процессы
- •§ 6. Внутренняя энергия. Энтальпия
- •Контрольные вопросы и примеры к 1-й главе
- •Первый закон термодинамики
- •§ 7. Закон сохранения энергии
- •§ 8. Определение работы процесса
- •§ 9. Определение теплоты процесса. Теплоемкость
- •§ 10. Аналитические выражения первого закона термодинамики
- •§ 11. Энтропия
- •§ 12. Тепловая диаграмма
§ 9. Определение теплоты процесса. Теплоемкость
Теплообмен системы с окружающей средой в общем случае сопровождается изменением температуры, поэтому количество теплоты в каком-либо процессе часто выражают через изменение температуры тел в этой системе.
Количество теплоты, которое нужно подвести (или отвести) в данном процессе для изменения температуры тела на 1 К, называют теплоемкостью. В технической термодинамике удобнее всего использовать понятие удельной теплоемкости: массовой сx, отнесенной к 1 кг вещества и измеряемой в Дж/(кг∙К); молярной μсx, отнесенной к 1 молю вещества и измеряемой в Дж/(моль∙К); объемной с'x, отнесенной к 1 м3 вещества при нормальных физических условиях и измеряемой в Дж/(м3∙К). Связь между указанными удельными теплоемкостями определяется соотношением
![]()
где μ - молярная масса, кг/моль; v0 - удельный объем при нормальных физических условиях, м3/кг.
(В дальнейшем будем пользоваться преимущественно понятием массовой теплоемкости).
Теплоемкость является функцией процесса, т. к. для изменения температуры тела на 1 К в различных процессах требуется разное количество теплоты. Числовое значение теплоемкости в различных процессах может изменяться от - ∞ до = + ∞. Индекс х в обозначении теплоемкости в каждом конкретном случае указывает на условия протекания процесса. Например, теплоемкость процесса постоянного давления обозначается cp теплоемкость процесса постоянного объема - cv. Теплоемкости этих двух процессов наиболее изучены и чаще всего используются в расчетах.
Теплоемкости реальных процессов изменяются в зависимости от параметров процесса. Чаще всего эту зависимость выражают в переменных p и Т: cx = f(p, T). Теплоемкость в данной точке процесса называют истинной теплоемкостью и определяют по изменению температуры в элементарном процессе
![]()
Следовательно, теплота процесса является его функцией и может быть выражена через истинную теплоемкость этого процесса

Истинные теплоемкости реальных газов сp; cv; μcp; μcv; c'p; c'v определяются экспериментально; их значения приводятся в специальных таблицах.
Для интегрирования уравнения (2.17) необходимо знать, как изменяется в данном процессе теплоемкость сx в зависимости от температуры. Эту зависимость иногда трудно выразить аналитически, поэтому на практике для определения теплоты пользуются понятием средней теплоемкости процесса сxm в заданном интервале изменения температуры
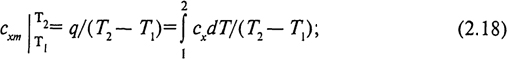
Если известна средняя теплоемкость процесса, то
![]()
Значение средних теплоемкостей сpm; cvm; (μcp)m; (μcv)m; c'pm; c'vm; для реальных газов также определяются экспериментально и приводятся в специальных таблицах для интервала температур от 0 °С до t°C - сxm|
t |
0 |
. Тогда теплоту процесса можно выразить через табличные значения средних теплоемкостей
![]()
§ 10. Аналитические выражения первого закона термодинамики
Для возможности исследования различных термодинамических систем уравнение первого закона в общем виде (2.4) необходимо преобразовать с учетом термодинамической классификации видов энергии и определения работы процесса. Такое преобразование осуществляют в двух вариантах: для открытой и закрытой термодинамических систем.
В условиях открытой термодинамической системы (см. рис. 1, б) при установившемся движении потока изменение его энергии будет складываться в общем случае из изменения внутренней энергии, внешней потенциальной энергии давления, внешней потенциальной энергии положения и кинетической энергии. Для единичного массового расхода
![]()
Под внешней работой понимается техническая работа
![]()
В результате подстановки (2.21) и (2.22) в уравнение (2.4) с использованием соотношений (1.8) и (2.13) получим развернутое уравнение первого закона термодинамики, справедливое для обратимых и необратимых процессов:
30
![]()
Сумма первых двух слагаемых в правой части уравнения (2.23) представляет собой изменение энтальпии: du + d(pv) = d(u + pv) = di, сумма остальных трех слагаемых в соответствии с (2.14) - располагаемую работу δl0. Поэтому уравнение первого закона термодинамики для открытой системы можно представить в более простой форме:
![]()
Таким образом, теплота, подведенная к потоку, в общем случае расходуется на изменение его энтальпии и на располагаемую работу.
Для обратимых процессов δl0 = - vdp, поэтому
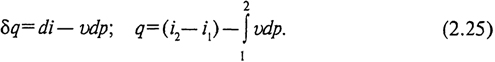
Это уравнение является наиболее удобным при анализе процессов в открытых системах.
Для закрытых систем (рис. 1, а) уравнение первого закона термодинамики удобнее представить через изменение внутренней энергии. Если в (2.23) три последних слагаемых представить как располагаемую работу, то для обратимых процессов можно записать
![]()
Поскольку d(pv) = pdv + vdp, окончательно получим
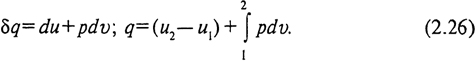
Второе слагаемое в (2.26) представляет собой работу изменения объема. Следовательно, в общем случае теплота, подведенная к системе, расходуется на изменение внутренней энергии и на работу изменения объема:
![]()
