
- •Применение
- •Химические свойства
- •2 Атома с → этан → этен; 3 атома с → пропан → пропен и т.Д.
- •Промышленное использование этилена
- •Гидратация
- •Гидрогалогенирование
- •6) Полимеризация алкенов
- •Реакции с участием подвижного водорода алкинов
- •Способы получения
- •Химические свойства сопряженных диенов
- •1. Гидрирование
- •2. Галогенирование
- •3. Диеновый синтез (реакция Дильса-Альдера)
- •Природный каучук
- •[Править]Синтетические каучуки
- •14) Арены (ароматические углеводороды)
- •1. Галогенирование
- •2. Нитрование
- •18) Классификация реагентов и реакций
- •Классификация реакций по изменениям углеродного скелета
- •20) Гидроксипроизводные углеводородов
- •Осно́вные свойства спиртов
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Получение
- •26) Химические свойства альдегидов и кетонов
- •Классификация
- •Номенклатура
- •Получение
- •30) Получение
- •Насыщенные дикарбоновые кислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •40) Химические свойства
- •Некоторые важнейшие -аминокислоты общей формулы
- •Классификация [править]По радикалу
- •[Править]По функциональным группам
- •[Править]По классам аминоацил-тРнк-синтетаз
- •[Править]По путям биосинтеза
- •[Править]По способности организма синтезировать из предшественников
- •[Править]По характеру катаболизма у животных
- •[Править]«Миллеровские» аминокислоты
- •Незаменимые (Обязательные) аминокислоты
- •43) Химические свойства аминокислот
- •Первичная структура
- •[Править]Вторичная структура
- •[Править]Третичная структура
- •[Править]Четвертичная структура
Первичная структура
Основная статья: Первичная структура
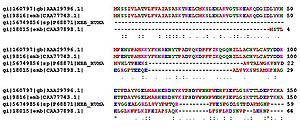
Пример выравнивания аминокислотных последовательностей белков (гемоглобинов) из разных организмов
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.
Важными особенностями первичной структуры являются консервативные мотивы — устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках. Консервативные мотивы сохраняются в процессеэволюции видов, по ним часто удаётся предсказать функцию неизвестного белка[20]. По степени гомологии (сходства) аминокислотных последовательностей белков разных организмов можно оценивать эволюционное расстояние между таксонами, к которым принадлежат эти организмы.
Первичную структуру белка можно определить методами секвенирования белков или по первичной структуре его мРНК, используя таблицу генетического кода.
[Править]Вторичная структура
Основная статья: Вторичная структура
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков[19]:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[21] (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина,аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали;
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,34 нм на аминокислотный остаток[22]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
π-спирали;
310-спирали;
неупорядоченные фрагменты.
[Править]Третичная структура
Основная статья: Третичная структура
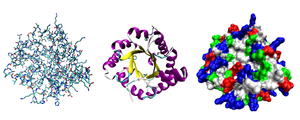
Разные способы изображения трёхмерной структуры белка на примере триозофосфатизомеразы. Слева — «стержневая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине — мотив укладки. Справа — контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Исследования принципов укладки белков показали, что между уровнем вторичной структуры и атомарной пространственной структурой удобно выделять ещё один уровень — мотив укладки (архитектура, структурный мотив). Мотив укладки определяется взаимным расположением элементов вторичной структуры (α-спиралей и β-тяжей) в пределах белкового домена — компактной глобулы, которая может существовать или сама по себе или входить в состав более крупного белка наряду с другими доменами. Рассмотрим для примера один из характерных мотивов строения белков. Изображённый на рисунке справа глобулярный белок,триозофосфатизомераза, имеет мотив укладки, который называется α/β-цилиндр: 8 параллельных β-тяжей формируют β-цилиндр внутри ещё одного цилиндра, сложенного из 8 α-спиралей. Такой мотив обнаруживается примерно в 10 % белков[23].
Известно, что мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков (такой как CATH или SCOP)[23].
Для определения пространственной структуры белка применяют методы рентгеноструктурного анализа, ядерного магнитного резонанса и некоторые виды микроскопии.
