
- •Применение
- •Химические свойства
- •2 Атома с → этан → этен; 3 атома с → пропан → пропен и т.Д.
- •Промышленное использование этилена
- •Гидратация
- •Гидрогалогенирование
- •6) Полимеризация алкенов
- •Реакции с участием подвижного водорода алкинов
- •Способы получения
- •Химические свойства сопряженных диенов
- •1. Гидрирование
- •2. Галогенирование
- •3. Диеновый синтез (реакция Дильса-Альдера)
- •Природный каучук
- •[Править]Синтетические каучуки
- •14) Арены (ароматические углеводороды)
- •1. Галогенирование
- •2. Нитрование
- •18) Классификация реагентов и реакций
- •Классификация реакций по изменениям углеродного скелета
- •20) Гидроксипроизводные углеводородов
- •Осно́вные свойства спиртов
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Получение
- •26) Химические свойства альдегидов и кетонов
- •Классификация
- •Номенклатура
- •Получение
- •30) Получение
- •Насыщенные дикарбоновые кислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •40) Химические свойства
- •Некоторые важнейшие -аминокислоты общей формулы
- •Классификация [править]По радикалу
- •[Править]По функциональным группам
- •[Править]По классам аминоацил-тРнк-синтетаз
- •[Править]По путям биосинтеза
- •[Править]По способности организма синтезировать из предшественников
- •[Править]По характеру катаболизма у животных
- •[Править]«Миллеровские» аминокислоты
- •Незаменимые (Обязательные) аминокислоты
- •43) Химические свойства аминокислот
- •Первичная структура
- •[Править]Вторичная структура
- •[Править]Третичная структура
- •[Править]Четвертичная структура
Получение
Окисление спиртов
![]()
Окисление альдегидов
![]()
Гидролиз тригалогеналканов
![]()
Карбоксилирование металлорганических соединений
![]()
![]()
Гидролиз сложных эфиров
![]()
Гидролиз нитрилов
![]()
![]() Катализируется
кислотой или основанием; первоначально
образуется амид, который гидролизуется
до кислоты; лишь в редких случаях амид
устойчив к гидролизу; удобный лабораторный
метод (если нитрил доступен)
Катализируется
кислотой или основанием; первоначально
образуется амид, который гидролизуется
до кислоты; лишь в редких случаях амид
устойчив к гидролизу; удобный лабораторный
метод (если нитрил доступен)
Реакция Арндта-Эйстерта
![]()
![]() Используется
для получения высших гомологов кислот
из низших.
Используется
для получения высших гомологов кислот
из низших.
Изомерия карбоновых кислот
Cтруктурная изомерия
- изомерия скелета в углеводородном радикале (начиная с C4).
- межклассовая изомерия, начиная с C2. Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений.
Пространственная изомерия
- Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Пример:
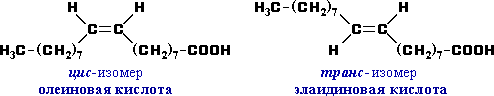
- Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мяразличными заместителями). Например, 2-метилбутановая кислота C2H5CH(CH3)COOH существует в виде двух оптических изомеров
Строение карбоксильной группы
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга. Это влияние передается по системе сопряжения sp2-атомов O–C–O.
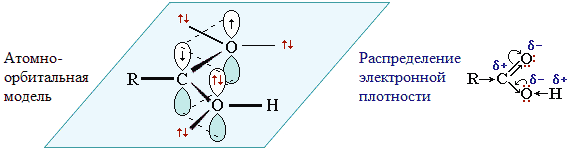
Электронное строение группы –СООН придает карбоновым кислотам характерные химические и физические свойства.
Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную (по сравнению со спиртами и фенолами) поляризацию связи О–Н, что определяет подвижность водородного атома (кислотные свойства).
В водном растворе карбоновые кислоты диссоциируют на ионы:
![]()
Однако карбоновые кислоты в целом – слабые кислоты: в водных растворах их соли сильно гидролизованы. Видеоопыт "Карбоновые кислоты – слабые электролиты".
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы -ОН.
Группа -СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале, т.е. является по отношению к нему электроноакцепторным заместителем. В случае предельных кислот карбоксильная группа проявляет -I-эффект, а в непредельных (например,CH2=CH-COOH) и ароматических (С6Н5-СООН) – -I и -М-эффекты.
Карбоксильная группа, являясь электроноакцептором, вызывает дополнительную поляризацию связи С–Н в соседнем (α-) положении и увеличивает подвижностьα-водородного атома в реакциях замещения по углеводородному радикалу.
30) Получение
Окисление спиртов
Окисление альдегидов
Гидролиз тригалогеналканов
Карбоксилирование металлорганических соединений
Гидролиз сложных эфиров
Гидролиз нитрилов
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
Реакция Арндта-Эйстерта
Используется для получения высших гомологов кислот из низших.
Гидролиз
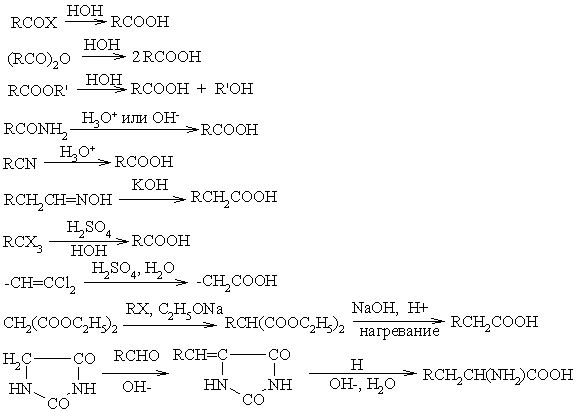
Окисление
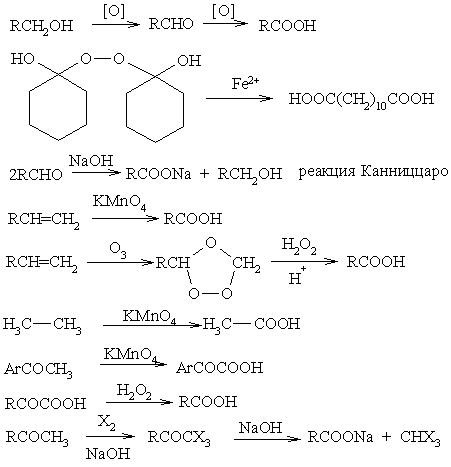
Карбоксилирование и карбоксиметилирование металлорганических соединений
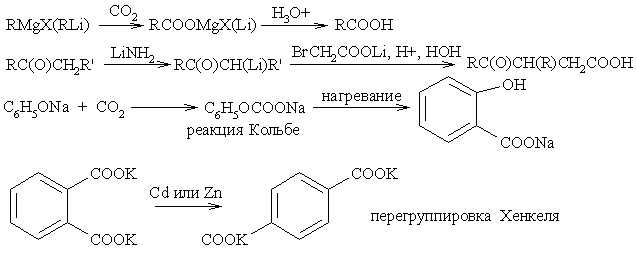
Конденсация
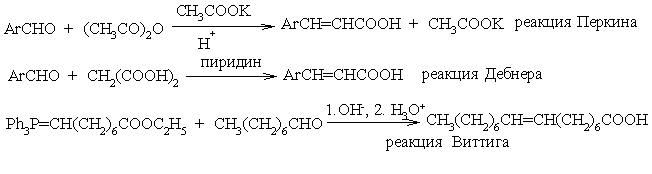
Щелочное расщепление
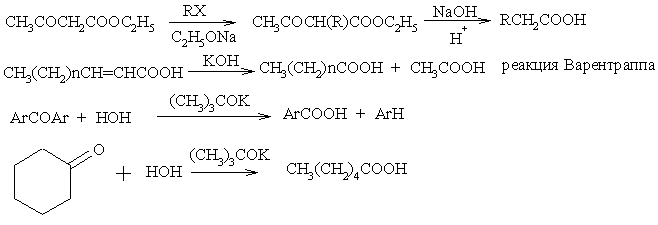
Замещение и присоединение
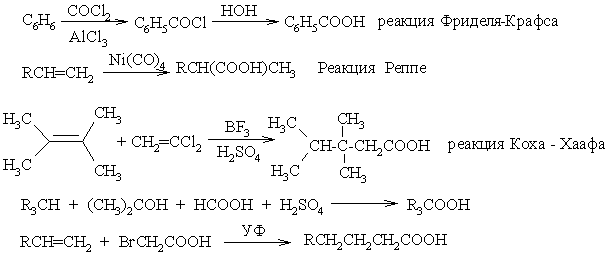
Перегруппировки
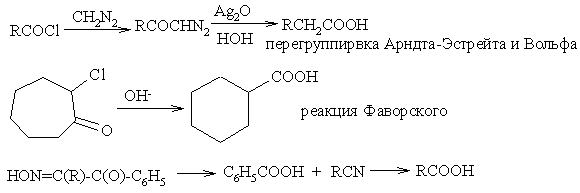
еакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакцияВагнера):
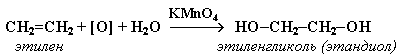
Полное уравнение реакции:
![]()
(см. схему электронного баланса этой реакции).
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены. Видеоопыт "Взаимодействие этилена с раствором перманганата калия".
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
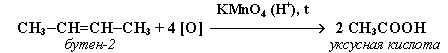
3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
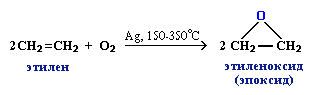
4. Полное окисление (горение):
![]()
Газообразные гомологи алкенов образуют с воздухом взРеакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко.
При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
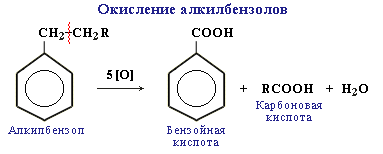
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи.
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
![]()
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
31) Методы получения сложных эфиров
Сольволиз
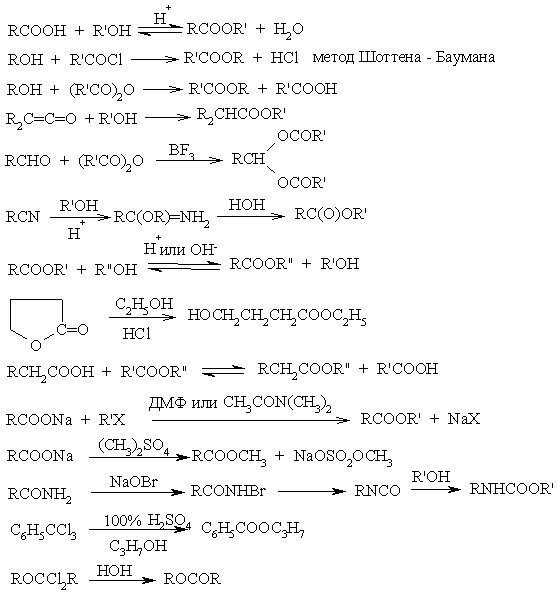
Реакции электрофильного типа
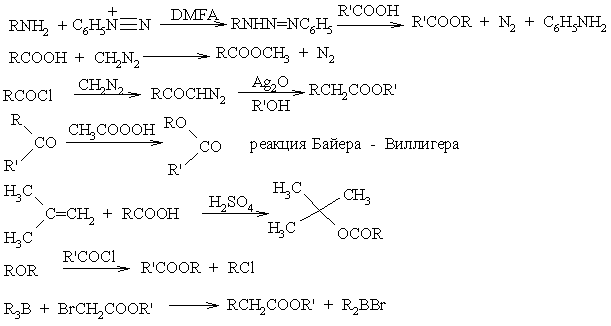
Нуклеофильные реакции
Реакция Кляйзена |
Реакция Штоббе |
Реакция Дикмана |
Реакция Кновенагеля |
Реакция Михаэля |
Реакция Реформатского |
Реакция Дарзана |
Реакция Фаворского |
Альдольная конденсация |
Окисление и восстановление
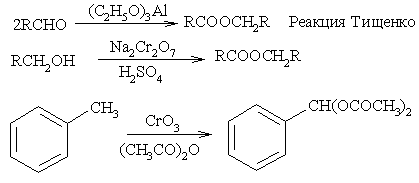
33) Жирные кислоты — алифатические одноосновные карбоновые кислоты с открытой цепью, содержащиеся в этерифицированной форме в жирах, маслах и восках растительного и животного происхождения. Жирные кислоты, как правило, содержат неразветвленную цепь из четного числа атомов углерода (С4-24, включая карбоксильный углерод) и могут быть как насыщенными, так и ненасыщенными[1].
Пальмитиновая кислота (Гексадекановая кислота) CH3(CH2)14COOH – наиболее распространенная в природе одноосновная насыщенная карбоновая кислота (жирная кислота).
Соли и эфиры пальмитиновой кислоты называются пальмитатами
Стеариновая кислота (октадекановая кислота) — одноосновная карбоновая кислота алифатического ряда, отвечающая формуле C18H36O2, или CH3(CH2)16COOH. Белые кристаллы, нерастворимые в воде и растворимые в диэтиловом эфире. Стеариновая кислота была открыта в свином сале в 1816 году французским химиком Шеврелем.
Олеиновая кислота (цис-9-октадеценовая кислота) СН3(СН2)7СН=СН(СН2)7СООН — мононенасыщенная жирная кислота.
Линолевая кислота — одноосновная карбоновая кислота с двумя изолированными двойными связями CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH.
Линоленовая кислота — одноосновная карбоновая кислота с тремя изолированными двойными связями, CH3(CH2CH=CH)3(CH2)7COOH
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции.
Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами — так же, как и сливочное масло.
Масло — собирательное название ряда химических веществ или смесей веществ, не растворяющихся в воде.
Основных групп «масел» три:
некоторые «масла» являются жирами,
минеральные масла являются продуктами переработки нефти,
выделяется также важная группа — эфирные масла.
Также маслами нередко именуют смеси разных липофильных веществ (синтетические технические масла, некоторые косметические продукты).
Для природных триглицеридов лучше использовать более однозначные термины — жиры и растительные масла.
Слово липиды имеет несколько иной смысл.
34) Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.
