
- •Запорожская государственная инженерная академия
- •9. Тугоплавкие металлы и их сплавы.
- •1. Информатика и информация.
- •2. Виды программного обеспечения
- •4. Описание алгоритмов
- •5. Свойства алгоритма
- •6 Структура алгоритма (линейная разветвляющаяся)
- •Линейная структура
- •Разветвляющаяся структура
- •7 Структура алгоритма (циклическая)
- •Циклическая структура
- •8. Текстовый файл. Редакторы текстов программ и документов.
- •Редакторы документов
- •9. Электронные таблицы. Quattro Pro, SuperCalc, Microsoft Excel
- •10. Текстовый редактор Word
- •1. Менеджмент и предпринимательство. Определение менеджмента
- •Новая парадигма управления
- •2. Функции, принципы и методы организации
- •3. Современные организационные структуры
- •4. Этапы принятия управленческого решения
- •5. Качества руководителя
- •6. Стратегия преодоления конфликта
- •7. Правовые основы предпринимательской деятельности
- •1. Понятие и виды себестоимости.
- •2. Понятие и определение рентабельности производства
- •3. Экономический эффект и эффективность инвестиций
- •5. Распределение прибыли на предприятии
- •6. Понятие оборотных средств и пути улучшения их использования
- •7. Понятие основных фондов и пути улучшения их использования
- •8. Понятие и определение рентабельности производства
- •9. Экономическое значение подготовки лома и
- •10. Формы и системы заработной платы
- •11. Смета затрат на производство. Общие и отличительные черты сметы
- •12. Понятие прибыли. Формирование балансовой прибыли
- •13. Понятия заработной платы. Элементы входящие в заработную плату
- •14. Факторы, влияющие на изменение себестоимости продукции
- •2. Теория риска. Индивидуальный и групповой риск
- •3. Требования пожарной безопасности к производственным
- •4. Огнегасительные вещества и первичные средства пожаротушения. Типы огнетушителей, область их применения
- •5. Категории помещений по пожарной и взрывопожарной опасности
- •6. Защита от вибрации. Защита от общей и локальной вибрации.
- •7. Защита от шума. Средства коллективной и индивидуальной защиты
- •8. Защита от тепловых воздействий: теплоизоляция, экранирование,
- •10. Искусственное освещение, его виды, системы, нормирование
- •11. Вентиляция. Ее назначения, виды
- •12. Воздушная среда. Микроклимат и чистота воздуха
- •13. Технические нормативы: конструктивные,
- •14. Гигиенические нормативы. Санитарные нормы
- •15. Проведение работ. Система допусков, когда применяется,
- •16. Организационные, санитарные, технические методы,
- •17. Вредные и опасные факторы производства. Последствия
- •19. Требования охраны труда к территории предприятия. Санитарно-защитная зона. Ее размеры для различных классов предприятия
- •1. Характеристика железных руд и их месторождений в Украине
- •2. Методы загрузки доменной печи
- •3. Маркировка доменных чугунов и ферросплавов
- •4. Строение и оборудование кислородного конвертера
- •5. Сырьё и периоды плавки в кислородном конвертере
- •6. Конвертерный процесс с донной и комбинированной продувкой
- •7. Способы раскисления стали. Донное и диффузионное раскисление.
- •8. Строение и оборудование мартеновской печи. Регенераторы, перекидные и регулирующие устройства, форсунки и горелки
- •9. Сырьё и периоды плавки в мартеновской печи.
- •10. Преимущества и возможности электрометаллурии.
- •11. Классификация и разновидности электрических печей.
- •12. Основные периоды электроплавки, их предназначение
- •13. Окисление углерода в электропечи, механизм и условие удаления пузырька со
- •14. Дефосфорация металла в окислительный период
- •15. Механизм и условия десульфурации металла по периодам плавки.
- •16. Легирование стальной ванны, порядок и условия ввода легирующих, степень усвоения.
- •17. Внепечные способы обработки стали
- •18. Специальные способы электроплавки стали
- •1. Окускование мелких материалов при производстве цветных металлов. Окатывание, брикетирование, агломерация: сущность процессов, их преимущества и недостатки (привести схему агломерации)
- •2. Шихтоподготовка в цветной металлургии. Требования к качеству шихт. Бункерный и штабельный способы приготовления шихты, их сущность и применение (привести схемы приготовления шихты)
- •3. Металлургические газы и пыли, их классификация и характеристика. Технологические и топочные газы, грубые и тонкие пыли цветной металлургии (привести примеры)
- •8. Рафинировочные плавки в цветной металлургии, их виды и назначение. Огневое, ликвационное, сульфидирующее, хлорное, карбонильное, цементационное рафинирование (привести примеры химических реакций)
- •9. Рудные плавки в цветной металлургии. Плавка на штейн, восстановительная, электролитическая, металлотермическая, реакционная плавка (укажите назначение и приведите примеры химических реакций)
- •10. Обжиг в цветной металлургии. Кальцинирующий, окислительный, агломерирующий, восстановительный, хлорирующий и фторирующий (дайте определение и приведите примеры химических реакций)
- •Качественная схема обогащения руды
- •16. Обогащение руд цветных металлов. Задачи обогащения руд. Концентрат, промежуточный продукт, хвосты (дайте определение и приведите примеры). Способы обогащения руд
- •18. Руды и минералы цветных металлов (дайте определение и приведите примеры). Классификация руд и минералов. Сульфидные, окисленные, смешанные, самородные, моно- и полиметаллические руды
- •19. Классификация цветных металлов. Легкие, тяжелые, редкие, благородные металлы. Основные свойства и области применения цветных металлов
- •20. Принципиальная схема получения титана из ильменитового концентрата. Приведите химические реакции, протекающие на основных стадиях производства титана
- •1. Диаграмма состояния «Железо – цементит» (метастабильное состояния), и влияние углерода и постоянных примесей на свойства стали
- •2. Классификация чугунов в зависимости от формы графита и условий его образования. Влияние углерода и постоянных примесей на структуру и механические свойства чугунов
- •3. Фазовые превращения в сплавах железа (теория термической обработки)
- •4. Основные виды и технологические операции термической обработки, различно изменяющие структуру и свойства стали
- •5. Влияние основных видов химико-термической обработки стали на структуру и химико-механические свойства поверхностного слоя сталей
- •6. Титан и сплавы на его основе. Термическая обработка титановых сплавов
- •7. Алюминий и сплавы на его основе. Термическая обработка алюминиевых сплавов
- •8. Структура и свойства меди и ее сплавы. Латуни и бронзы
- •9. Тугоплавкие металлы и их сплавы
- •1.Испарение влаги и разложение карбонатов в доменной печи.
- •3. Закономерности углетермических восстановительных процессов
- •4. Фазовые равновесия в двухкомпонентных системах.
- •5.Энтропийный метод расчёта константы равновесия
- •7. Химическое равновесие и константа равновесия металлургических
- •8. Основы теории металлотермии
- •9. Подвижность химического равновесия. Принцип Ле Шателье.
- •10. Восстановление окислов металлов с помощью со и н2
- •11. Закономерности восстановительных процессов в системах с
- •12. Основы теории окислительного рафинирования металлов от
- •13.Теоретические основы процессов раскисления стали
- •Практическое задание
Практическое задание
Для заданной реакции и температуры:
а) вычислить константу равновесия и рассчитать равновесные концентрации;
б) выбрать состав восстановительной газовой фазы.
Для решения практического задания воспользуемся энтропийным методом расчёта константы равновесия химических реакций.
Для расчета химических реакций используют понятие о химическом потенциале:
![]() (1)
(1)
Энтропийный метод расчета основан на следующем:
Изменение энтальпии и энтропии реакции вычисляем по формулам:
Приведенные уравнения показывают, как может изменяться внутренняя энергия и энтропия произвольного вещества при изменении его температуры. В реакции участвуют разные вещества и для каждого из них, в зависимости от наличия или отсутствия модификационных и агрегатных превращений, зависимость внутренней энергии или энтропии от температуры может выражаться разными уравнениями. Например, если какое-либо вещество не претерпевает никаких изменений в интервале температур от 298 до Т, то для такого вещества:
соответственно
В случае, если вещества претерпевают изменения в интервале температур от 298 до Т, величины можно найти так:
Рассмотрим качественный пример:
Итак, видим, что только одно вещество-участник реакции претерпевает превращение при , значит весь интервал расчета разбиваем на два промежутка: от до и от до искомой температуры. Получаем:
Так как теплоемкость у каждого вещества зависит от температуры, следующим образом , то и находятся для каждого температурного интервала с учетом тех значений и коэффициентов , которые справедливы для веществ в заданном интервале:
где
где
Подинтегральные выражения в уравнениях и в общем случае берутся так:
находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.
Если в реакции участвует простое вещество, то теплота его образования
находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.
Итак, вычисляем и , затем по уравнению (1) находим , а потом из уравнения
Находим константу равновесия.
Значение константы равновесия зависит только от природы веществ и температуры и не зависит от исходного состава системы. Величина константы равновесия показывает, насколько сильно смещается в ту или иную сторону состояние системы, после протекания процесса: каких веществ будет много, каких мало, или содержания их в системе окажутся сопоставимыми.
Для заданной реакции константа равновесия выражена:
![]() ;
;
![]()
![]()
откуда:
![]() ;
;
![]() .
.
Для выбора состава восстановительной газовой смеси руководствуемся простым правилом: восстановительная смесь для соответствующего оксида должна содержать более высокую долю газа-восстановителя (СО или Н2) , чем та, которая соответствует равновесному состоянию при заданной температуре.
ПРИМЕР.
Дана реакция
![]() Т = 1100 К
Т = 1100 К
РЕШЕНИЕ. Воспользуемся справочными данными и представим термодинамические свойства веществ-участников реакции в виде табл. 1
Таблица 1 – Термодинамические свойства веществ-участников реакции
Вещество |
Фаза |
|
|
|
|
|
||
|
|
|
||||||
Н2 |
Г |
- |
130,58 |
27,72 |
3,39 |
- |
- |
- |
Н2О |
Ж |
286,03 |
69,9 |
46,9 |
30,02 |
- |
373 |
40,90 |
|
Г |
- |
- |
90,9 |
- |
- |
- |
- |
Fe3O4 |
ТВ |
1122 |
146,6 |
51,83 |
6,78 |
- 1,59 |
1870 |
- |
FeO |
ТВ |
266,7 |
54,0 |
38,81 |
20,10 |
- |
1641 |
31,4 |
|
Ж |
- |
- |
60,7 |
- |
- |
2700 |
230,0 |
Константу равновесия и равновесные концентрации находим с
помощью уравнений
![]()
Вычисляем
![]() по уравнению
по уравнению
![]()
Как показывают табличные данные, с одним из веществ в указанном интервале температур происходит агрегатное превращение – вода при 373 К переходит из жидкого в парообразное состояние. Поэтому формулы для расчета изменения энтальпии и энтропии реакции принимают вид:
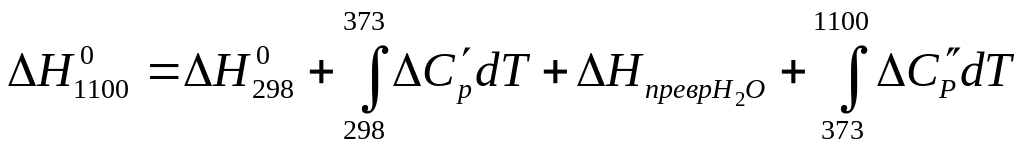
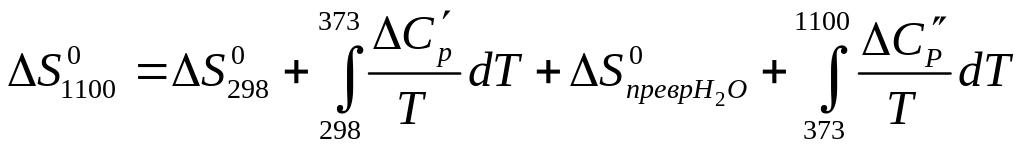
Тепловой эффект при 298 К вычисляем как разность теплот образования веществ продуктов и веществ вступающих в химическую реакцию:

Величину
![]() находим как разность абсолютных энтропий
веществ участников реакции
находим как разность абсолютных энтропий
веществ участников реакции
![]()
Вычисляем разность теплоемкостей для реакции
![]()
Интервал температур: 298 – 373 К:
![]()
![]()
![]()
Интервал температур 373-1100 К:
![]()
![]()
Находим
тепловой эффект реакции:
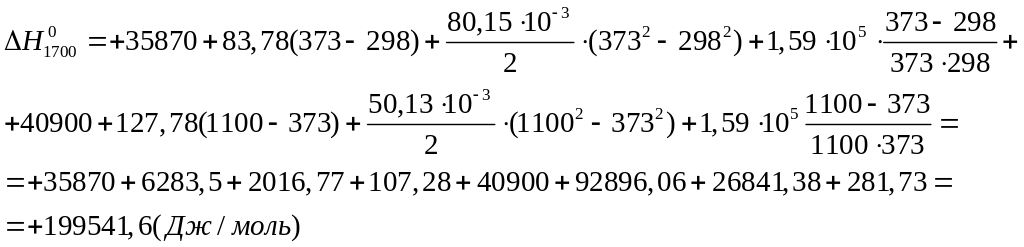
Вычисляем изменение энтропии реакции:

Определяем изменение энергии Гиббса для заданной реакции:
![]()
Вычисляем константу равновесия
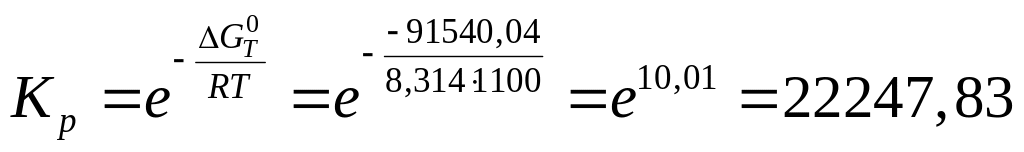
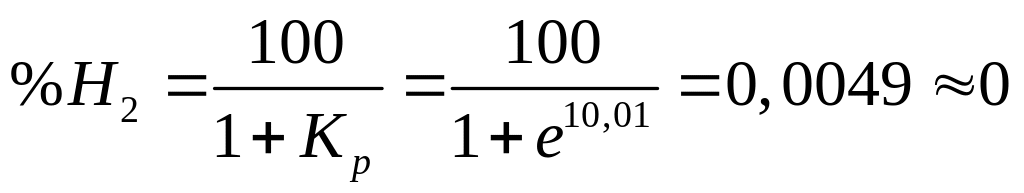
![]()
Выбираем
газовую смесь для восстановления, в
которой содержание восстановителя выше
чем в равновесии и составляет 40% Н2
и 60% Н![]() О.
О.
