
- •Лекция 6. Спектроскопические методы. Фотометрические методы анализа.
- •Спектроскопические методы анализа, классификация, характеристика и особенности методов.
- •1.3. Происхождение молекулярных спектров
- •1.4. Классификация методов спектроскопии
- •1.4.1. Атомная спектроскопия
- •1.4.2. Молекулярно - спектроскопические методы
- •1.4.3. Молекулярная абсорбционная спектроскопия
- •1.5.1. Закон Бугера - Ламберта - Бера
- •1.5.2. Ограничения и условия применимости закона Бугера - Ламберта - Бера
- •1.5.3. Закон аддитивности
- •1.6. Спектры поглощения
- •1.7. Типы спектров поглощения
- •1.7.1. Вращательные спектры
- •1.7.2. Колебательные спектры
- •1.7.2.1. Простые молекулы
- •1.7.2.2. Многоатомные молекулы
- •1.7.3. Электронные спектры
- •1.8. Аппаратура в абсорбционной спектроскопии
- •1.8.1. Блок - схема приборов
- •1.8.2. Источники излучения
- •1.8.3. Монохроматизация излучения
- •1.8.4. Приемники излучения
- •Устройство а принципы работы спектрофотометра сф - 46
- •Фотометр фотоэлектрический кфк-3
- •1. Описание прибора
- •1.9.2. Спектроскопия в ультрафиолетовой и видимой областях
- •1.10. Количественный анализ методами абсорбционной спектроскопии
- •1.10.1. Реакции в фотометрическом анализе
- •1.10.2. Основные этапы количественного анализа в фотометрии
- •1.10.3. Метрологические характеристики метода
- •Основные методы определения концентрации одного светопоглощающего вещества
- •1.13 Количественный анализ по инфракрасным спектрам
- •1.14. Другие области применения молекулярной абсорбционной спектроскопии
1.7.1. Вращательные спектры
Вращение молекул проявляется у веществ лишь в газообразном состоянии, в конденсированных состояниях (жидком и твердом) вращение затруднено. Вращение молекул газа может вызвать излучение с частотой 10 - 10 Гц (волновое число
V ~10 - 10 cм ); энергия квантов в этой области спектра равна 1,2 кДж / моль и меньше ( по другим сведениям она составляет 0,01 - 0,4 кДж / моль). Это значение соизмеримо с энергией теплового движения. Вращательные спектры наблюдают при помощи микроволновой техники (тяжелые молекулы) или методов инфракрасной спектроскопии (более легкие молекулы). Для аналитических целей они имеют небольшое значение, их применяют главным образом для исследования строения молекул.
1.7.2. Колебательные спектры
Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области ( v ~ 10 -^5-10 см -1), что соответствует энергии квантов от 3 до 60 кДж / моль (согласно другим данным, 0,4 + 15 кДж / моль), поэтому при обычной температуре энергетическое состояние молекулы характеризуется основным колебательным уровнем. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
1.7.2.1. Простые молекулы
Молекула как осциллятор. Колебательное движение атомов можно приближенно описать закономерностями классической физики, используя модель гармонического осциллятора при рассмотрении колебаний двухатомной молекулы. Каждое смещение атомного ядра из равновесного положения приводит к повышению потенциальной энергии молекулы. Кривая потенциальной энергии обычно аппроксимируется параболой; вершина ro соответствует положению равновесия (рис.1.7.1., кривая 1).
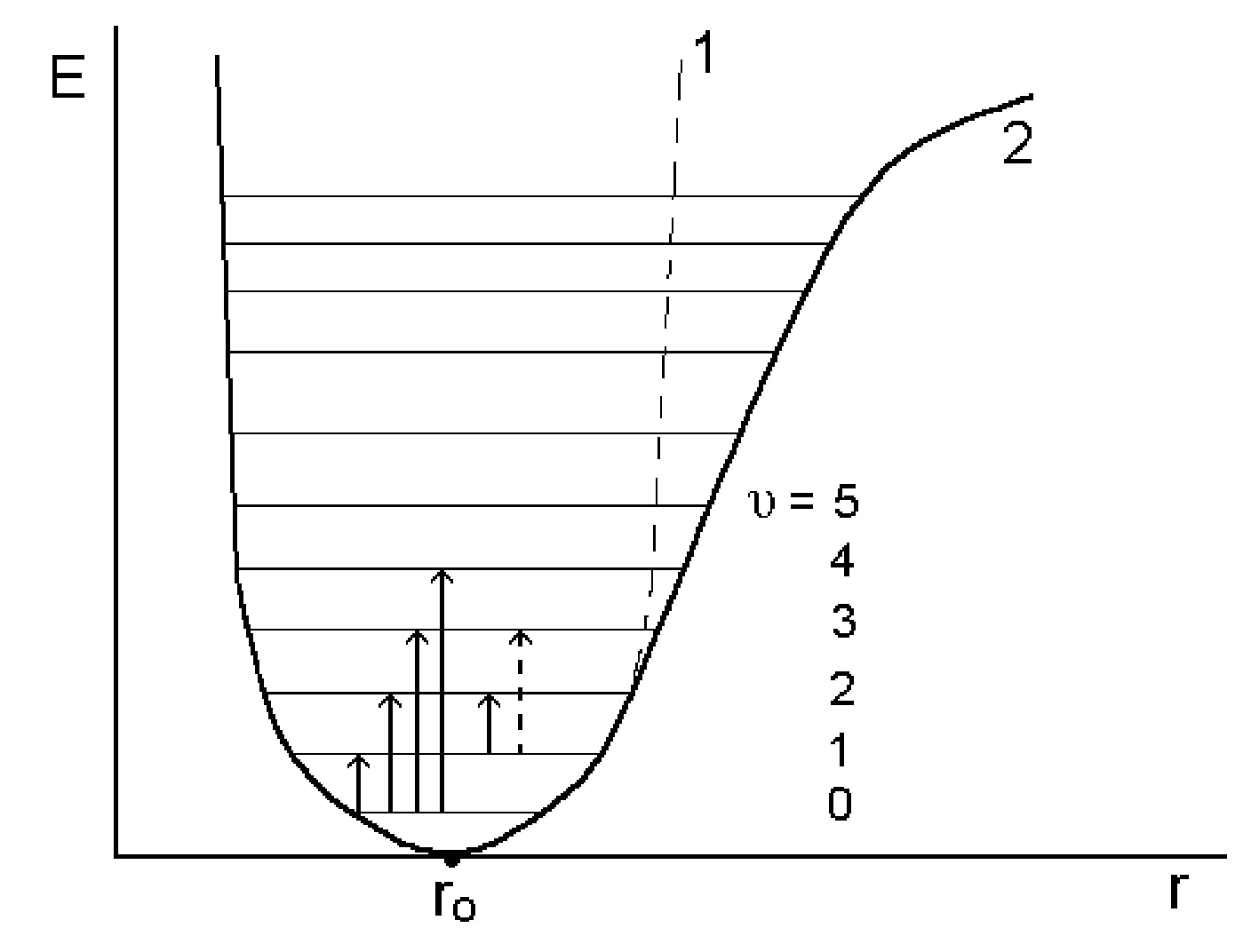
Рис.1.7.1. Кривые потенциальной энергии и уровни энергии двухатомной молекулы.
Собственное значение энергии определяется выражением:
![]() (1.7.1.) где
ϑ
- колебательное квантовое число,
принимающее значение
0,1,2,3… Отметим,
что при υ
= 0 (основное состояние) величина
энергии Е >
0 (нулевая колебательная энергия).
(1.7.1.) где
ϑ
- колебательное квантовое число,
принимающее значение
0,1,2,3… Отметим,
что при υ
= 0 (основное состояние) величина
энергии Е >
0 (нулевая колебательная энергия).
Правилами отбора в таких системах разрешены переходы, для которых
![]() (1.7.2.).
(1.7.2.).
Из сравнения уравнений (1.7.1.) и (1.7.2.) видно, что расстояние между соседними энергетическими уровнями гармонического осциллятора постоянно и равно hνo. Это означает, что при всех разрешенных переходах будут излучаться или поглощаться кванты энергии только частоты νо, и в спектре, таким образом, будет наблюдаться одна полоса с частотой:
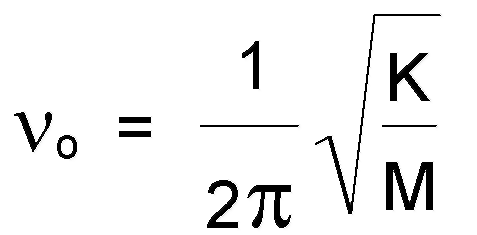 ,
(1.7.3.)
,
(1.7.3.)
где М - приведенная масса, определяемая как
( m1
и m2
- массы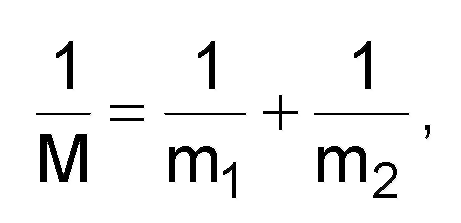 колеблющихся
ядер); К - силовая постоянная. Силовую
постоянную связывают с прочностью связи
в молекуле.
колеблющихся
ядер); К - силовая постоянная. Силовую
постоянную связывают с прочностью связи
в молекуле.
Реальную молекулу можно представить в виде гармоничного осциллятора только при малых колебаниях А r. С увеличением амплитуды колебания ангармоничность делается все заметнее. Связи в молекуле не могут растягиваться беспредельно, и после достижения этого предела молекула начинает диссоциировать. Сжатию связи молекула сопротивляется сильнее, чем растяжению.
Кривые потенциальной энергии реальной молекулы имеют более сложный характер (рис.1.7.1., кривая 2). Энергия ангармо-ничного осциллятора описывается уравнением:
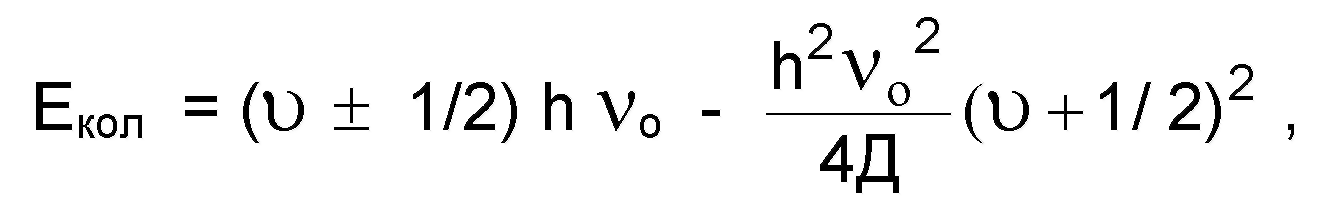 (1.7.4.)
(1.7.4.)
где Д - энергия диссоциации молекул, h - постоянная Планка.
Ангармоничность проявляется в следующем: 1) в «нарушении» правила отбора, так что могут осуществляться переходы с
![]() (их
называют обертонами); 2) в изменении
расстояния между уровнями, они
располагаются плотнее при увеличении
квантового числа и.
(их
называют обертонами); 2) в изменении
расстояния между уровнями, они
располагаются плотнее при увеличении
квантового числа и.
Интенсивность поглощения. Наиболее интенсивной в спектре является первая полоса, возникающая при переходе с и = 0 на и = 1. Этой полосе соответствует основная, или фундаментальная, частота - vо. Менее интенсивные полосы дают обертоны с частотами 2vо и 3vо.
Колебательные спектры способны давать лишь те молекулы, у которых во время колебаний изменяется электрический диполь-ный момент (например, HCl, HBr и др., но не H2, O2 и т.п.). Интегральная интенсивность поглощения численно равна площади основной полосы поглощения:
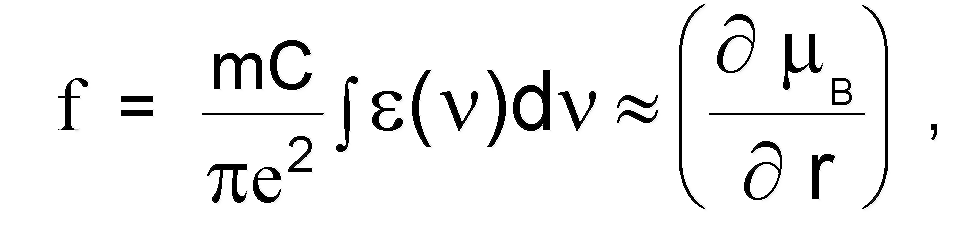 (1.7.5.)
(1.7.5.)
где m, e - масса и заряд электрона, С - скорость света, jiв - ди-польный момент молекулы, а j"s(v)dv называют интегралом по-
глощения. Если производная ----- = 0, то соответствующий вид
колебаний неактивен в инфракрасном спектре, поэтому интенсивность поглощения является мерой полярности связи.
