
- •Химическая термодинамика
- •Основные понятия и определения
- •Ι Закон термодинамики
- •Частные случаи ι Закона термодинамики
- •Стандартные теплоты образования простых веществ равны нулю!
- •Зависимость теплового эффекта химической реакции от температуры.
- •Виды теплоемкости:
- •Закон Кирхгоффа
- •Методы расчета тепловых эффектов химических реакций при различных температурах.
- •II Закон Термодинамики
- •Анализ II Закона Термодинамики
- •Расчет изменения энтропии в некоторых процессах
- •III Закон Термодинамики
- •Свойства энергии Гельмгольца
- •Свойство энергии Гиббса
- •Применение термодинамических потенциалов к химическим реакциям. Уравнение Гиббса-Гельмгольца.
- •Термодинамическое описание закрытых систем с переменным составом
- •Химический потенциал идеального газа
- •Уравнение изотермы системы. Связь энергии Гиббса с химическим потенциалом компонентов реакции
- •Закон действующих масс. Стандартная константа равновесия.
- •Практические константы равновесия
- •Химическое равновесие в гетерогенных системах
- •Химическое сродство. Уравнение изотермы химической реакции
- •Уравнение изобары. Влияние температуры на химическое равновесие
- •Приближенное интегрирование уравнения изобары
- •Точное интегрирование уравнения изобары. Уравнение Темкина-Шварца
- •Расчет констант равновесия по приведенным энергиям Гиббса
- •Расчет равновесной степени превращения и состава реакционной смеси
- •Влияние внешних факторов на смещение равновесия
- •Химическая термодинамика реальных систем
- •Понятие активности
- •Теория сильных электролитов Дебая-Хюккеля
- •Фазовое равновесие Основные понятия
- •Условие фазового равновесия
- •Однокомпонентные системы. Уравнение Клапейрона-Клаузиуса
- •Диаграмма состояния однокомпонентных систем
- •Бинарные гомогенные системы
- •Закон Рауля
- •Диаграммы кипения в двухкомпонентных системах. Виды диаграмм и их анализ
- •Диаграмма расслоения
- •Теоретические основы перегонки
- •Диаграммы плавкости
- •Уравнение Шредера
- •Теория построения диаграмм плавкости
- •Основы термического анализа Кривые охлаждения
- •Диаграммы плавкости с образованием устойчивых химических соединений
- •Диаграмма плавкости с образованием неустойчивого химического соединения
- •Диаграммы плавкости двухкомпонентных систем с образованием твердых растворов
- •Электрохимия. Термодинамика гальванического элемента
- •Основное уравнение электрохимии – уравнение Нернста
- •Равновесные и стандартные электродные потенциалы
- •Классификация электродов. Электродные процессы
- •Классификация гальванических элементов
- •Основы потенциометрии.
Диаграмма расслоения
![]()

Кривая расслоения отделяет диаграмме гомогенную от гетерогенной области (гетерогенная область заштрихована косой чертой).
К – критическая точка.
Особенность системы в критической точке – равенство состава двух равных фаз.
Теоретические основы перегонки
Всю перегонку делят на два вида:
1. простая перегонка (отгонка). В этом случае чаще всего отделяется жидкая часть от растворенных в ней твердых веществ. Пример: дистилляция воды.
2. Фракционная перегонка, в которой происходит разделение двух жидкостей.
Любая перегонка основана на первом законе Коновалова, который гласит:
пар, обогащается более легколетучим компонентом, входящим в состав кипящей жидкости.
Фракционная перегонка включает в себя несколько стадий:
1. Кипячение исходного раствора для получения пара определенного состава.
2. Конденсация полученного пара.
3. Кипячение полученного пара для получения пара, ещё более обогащенного легколетучим компонентом.
4. Конденсация полученного пара.
Количество подобных операций зависит от необходимости получить чистые вещества.
Основная проблема при подобной перегонки – изменение состава кипящей жидкости и получающегося пара в результате кипения.

Если система образует азеотропную смесь, то разделить ее на чистые компоненты невозможно (даже теоретически).
Второй закон Коновалова гласит:
В точках азеотропа состав кипящей жидкости и пара совпадают, поэтому в результате перегонки бинарного раствора, образующего азеотропную смесь, одним из продуктов перегонки будет являться азеотроп.

Лекция № 10
План лекции:
1. Диаграммы плавкости.
2. Уравнение Шредера.
3. Теория построения диаграмм плавкости.
4. Основы термического анализа. Кривые охлаждения.
Диаграммы плавкости
Полное название подобных диаграмм – диаграмма состояния двухкомпонентной системы температура – состав, содержащих твердую и жидкую фазы двух неограниченно смешивающихся друг с другом жидкостей и твердых веществ, образующих твердые растворы и химические соединения.
В данном случае фазовое равновесие
можно рассматривать как псевдохимическую
реакцию
![]() .
Очевидно, что в условиях равновесия,
химические потенциалы двух реагентов
будут равны.
.
Очевидно, что в условиях равновесия,
химические потенциалы двух реагентов
будут равны.
![]()
![]()
В случае однокомпонентной системы
![]() - растворимость вещества при данной
температуре.
- растворимость вещества при данной
температуре.
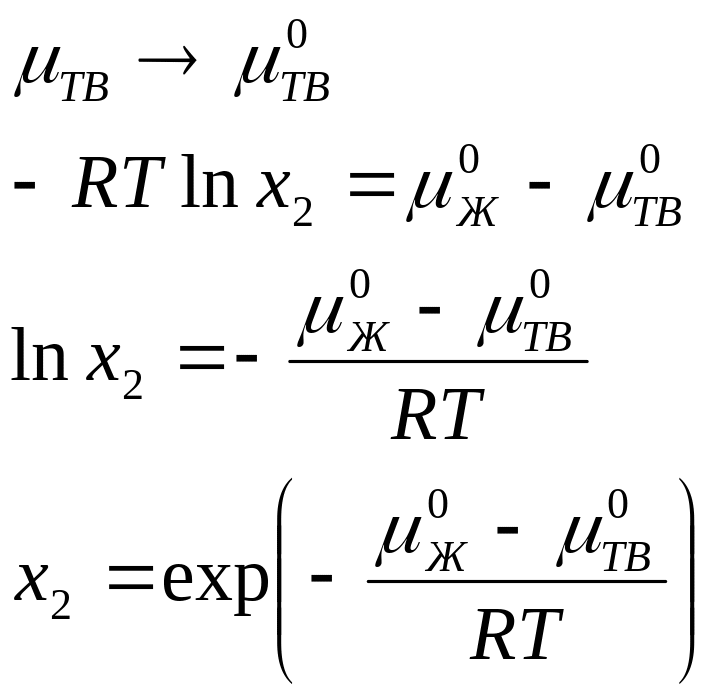
В данном случае растворимость вещества будет численно равна константе равновесия процесса плавления. В том случае, если образующийся состав будет идеальным.
Уравнение Шредера
Данное уравнение является аналогом уравнения изобары, записанным для процесса плавления:
![]() - дифференциальная форма уравнения
Шредера.
- дифференциальная форма уравнения
Шредера.
Если образующийся расплав обладает идеальными свойствами:
![]()
![]() - теплота плавления.
- теплота плавления.
Если раствор неидеальный, вместо
растворимости используют константу
равновесия, а вместо теплоты плавления
![]()
![]() - теплота, равная теплоте смешения двух
жидкостей: расплавленного компонента
А и идеального раствора.
- теплота, равная теплоте смешения двух
жидкостей: расплавленного компонента
А и идеального раствора.
Величина
![]() будет аналогична полезной теплоте
смешения, то есть тепловыделение или
теплопоглощение в процессе перехода
данного моль твердого вещества в
состояние насыщенного раствора.
будет аналогична полезной теплоте
смешения, то есть тепловыделение или
теплопоглощение в процессе перехода
данного моль твердого вещества в
состояние насыщенного раствора.
Анализ уравнения Шредера аналогичен анализу уравнения изобары.
1. Идеальный раствор:
![]()
![]()
2. Неидеальный раствор:
![]()
![]()
![]()
Поэтому, влияние температуры на растворимость веществ может быть различная. Уравнение Шредера служит основой для теоретического построения диаграмм плавкости.
