
- •Химическая термодинамика
- •Основные понятия и определения
- •Ι Закон термодинамики
- •Частные случаи ι Закона термодинамики
- •Стандартные теплоты образования простых веществ равны нулю!
- •Зависимость теплового эффекта химической реакции от температуры.
- •Виды теплоемкости:
- •Закон Кирхгоффа
- •Методы расчета тепловых эффектов химических реакций при различных температурах.
- •II Закон Термодинамики
- •Анализ II Закона Термодинамики
- •Расчет изменения энтропии в некоторых процессах
- •III Закон Термодинамики
- •Свойства энергии Гельмгольца
- •Свойство энергии Гиббса
- •Применение термодинамических потенциалов к химическим реакциям. Уравнение Гиббса-Гельмгольца.
- •Термодинамическое описание закрытых систем с переменным составом
- •Химический потенциал идеального газа
- •Уравнение изотермы системы. Связь энергии Гиббса с химическим потенциалом компонентов реакции
- •Закон действующих масс. Стандартная константа равновесия.
- •Практические константы равновесия
- •Химическое равновесие в гетерогенных системах
- •Химическое сродство. Уравнение изотермы химической реакции
- •Уравнение изобары. Влияние температуры на химическое равновесие
- •Приближенное интегрирование уравнения изобары
- •Точное интегрирование уравнения изобары. Уравнение Темкина-Шварца
- •Расчет констант равновесия по приведенным энергиям Гиббса
- •Расчет равновесной степени превращения и состава реакционной смеси
- •Влияние внешних факторов на смещение равновесия
- •Химическая термодинамика реальных систем
- •Понятие активности
- •Теория сильных электролитов Дебая-Хюккеля
- •Фазовое равновесие Основные понятия
- •Условие фазового равновесия
- •Однокомпонентные системы. Уравнение Клапейрона-Клаузиуса
- •Диаграмма состояния однокомпонентных систем
- •Бинарные гомогенные системы
- •Закон Рауля
- •Диаграммы кипения в двухкомпонентных системах. Виды диаграмм и их анализ
- •Диаграмма расслоения
- •Теоретические основы перегонки
- •Диаграммы плавкости
- •Уравнение Шредера
- •Теория построения диаграмм плавкости
- •Основы термического анализа Кривые охлаждения
- •Диаграммы плавкости с образованием устойчивых химических соединений
- •Диаграмма плавкости с образованием неустойчивого химического соединения
- •Диаграммы плавкости двухкомпонентных систем с образованием твердых растворов
- •Электрохимия. Термодинамика гальванического элемента
- •Основное уравнение электрохимии – уравнение Нернста
- •Равновесные и стандартные электродные потенциалы
- •Классификация электродов. Электродные процессы
- •Классификация гальванических элементов
- •Основы потенциометрии.
Лекция №1
План лекции:
Введение в физическую химию
Физическая термодинамика
Основные понятия и определения
Ι Закон термодинамики
Практическое применение Ι закона
Физическая химия – наука о закономерностях химических процессов и явлений.
Химическая термодинамика
Химическая термодинамика – раздел общей термодинамики, применяющий термодинамические закономерности к описанию химических реакций.
Объектами исследования в термодинамике являются только макроскопические системы, т.е. системы, состоящие из очень большого числа частиц. Следовательно, и оперирует она
макрохарактеристиками веществ и систем:
температура (Т), объем(V),
давление(P), плотность
(![]() ),
концентрация (С), и т.д.
),
концентрация (С), и т.д.
Мерой количества вещества является
[моль] (![]() частиц). Химическая термодинамика не
интересуется механическим протеканием
процесса, а оперирует понятиями состояния
системы в начальный и конечный момент
времени.
частиц). Химическая термодинамика не
интересуется механическим протеканием
процесса, а оперирует понятиями состояния
системы в начальный и конечный момент
времени.
С помощью её можно решить задачи:
1. Составить энергетический баланс системы
2. Предсказать направление протекания процесса
3. Предсказать глубину протекания процесса
Основные понятия и определения
Система – тело или группа тел, реально или мысленно выделенная из окружающей среды и находящаяся в постоянном взаимодействии с окружающей средой.
Системы разделяются на:
а) Открытые – взаимодействующие с окружающей средой одновременно веществом и энергией.
б) Закрытые – обменивающиеся только энергией, но не веществом.
в) Изолированные – не обменивающиеся ни тем и ни другим. Данные системы являются самыми простыми по математической зависимости, но на практике чаще всего не реализуются.
Параметры – характеристики, описывающие состояние системы.
Параметры подразделяются на:
а) Экстенсивные – т.е. зависящие от массы и пропорциональны ей ( объем, масса, теплоемкость, вязкость и т.д.)
б) Интенсивные – т.е. не зависящие от массы (температура, молярная теплоемкость, молярный объем, и т.д.
Если система описывается постоянными параметрами, которые сохраняют свою неизменность бесконечно долгое время, говорят, система находиться в состоянии равновесия.
Если на подобную систему подействовать из вне, она выйдет из состояния равновесия и перейдет в новое состояние. Подобное изменение называется процессом.
Процессы можно разделить на:
Равновесные (Квазистатические)
Не равновесные
При равновесном процессе изменение хотя бы одного из параметров, описывающих систему, протекает бесконечно долго, через бесконечно большое число состояний равновесия. Данные процессы на практике не реализуются.
Ближе всего к ним относятся квазиравновесные процессы.
Пример такого процесса – расширение газа под поршнем:
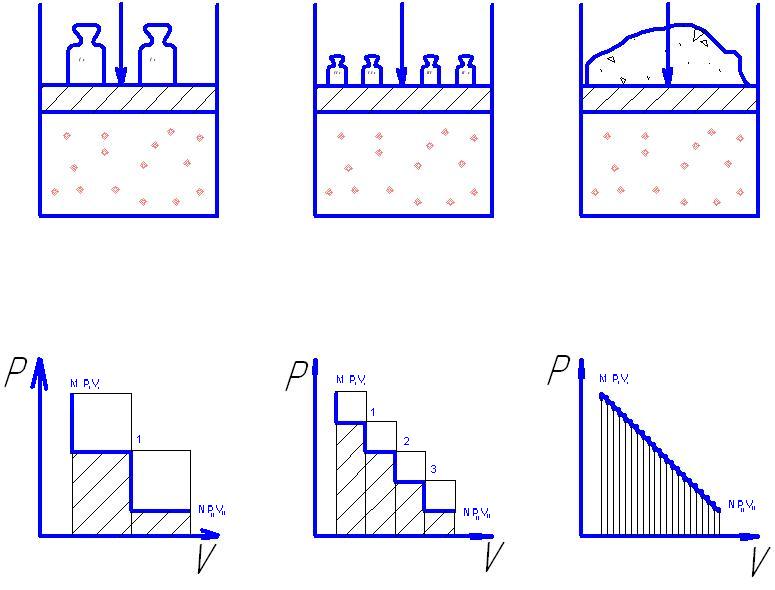
В равновесном процессе система должна совершать максимальную работу. При этом путь, совершаемый системой в прямом и обратном направлении будет совпадать только в равновесном процессе.
Внутренняя энергия – общий запас энергии системы, за вычетом кинетической энергии движения тела как единого целого и потенциальной энергии тела, находящегося во внешнем силовом поле.
Любая передача энергии к телу совершается двумя способами:
С помощью хаотического движения частиц составляющих тело. Такой способ передачи энергии называется теплотой. Передача энергии в данном случае хаотического столкновения частиц, принадлежащих разным телам

Упорядоченное движение частиц, составляющих тело в одном и нескольких направлениях. Такая форма передачи энергии называется работой
 .
Элементарная работа
.
Элементарная работа
 =
= - произведение силы на элементарное
перемещение.
- произведение силы на элементарное
перемещение.
Подобные величины , не являющиеся параметрами системы, но характеризующие различные процессы в системе, называются термодинамическими функциями.
Термодинамические функции делятся на:
Функции состояния, изменение которых не зависит от пути перехода системы. К ним относится внутренняя энергия (U)
Функции процесса, изменение которых зависит от пути процесса. К ним относится теплота и работа (Q и W)
У функций процесса сумма бесконечно малых изменений есть величина не постоянная
![]()
У функций состояния изменение будет всегда одним и тем же.
![]()

![]()
Основной задачей термодинамики считается предсказание направления протекания процесса. Процессы можно разделить на:
Самопроизвольные, которые протекаю самопроизвольно, без внешних воздействий.
Не самопроизвольные, которые не протекают без внешних воздействий.
Если в изолированной системе протекает самопроизвольный процесс, в конце его устанавливается равновесие, которое может существовать бесконечно долго, если на систему ничем не действовать.
