
- •2.5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •2.5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •2.5.3. Редокс-буферность природных вод
- •2.5.4. Особенности окислительно-восстановительных процессов в озерах
- •2.5.5. Особенности окислительно-восстановительных процессов в океане
- •2.5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •2.5.7. Окислительно-восстановительные условия и миграция элементов
2.5. Окислительно-восстановительные процессы в гидросфере
Окислительно-восстановительные реакции играют исключительно важную роль в описании процессов, протекающих в природных водоемах. Предыстория и качество природных вод в значительной степени зависят от вида окислительно-восстановительных реакций, их кинетических характеристик и величины окислительно-восстановительного потенциала, который соответствовал бы данной системе при установлении равновесия.
Прежде чем перейти к рассмотрению конкретных примеров, подчеркнем две особенности, характерные для редокс-реакций в природных водах. Во-первых, большинство наиболее важных редокс-реакций катализируется микроорганизмами (окисление органического вещества молекулярным кислородом, восстановление Fe(III) в Fe(II) и т. д.). Во-вторых, инициирование процессов окисления, протекающих в природных водах, в большинстве случаев, несмотря на крайне низкие значения концентраций, связано с присутствием в природных водах таких окислителей, как свободные радикалы, пероксид водорода, озон, и некоторых других сильных окислителей.
В данном учебном пособии будут обсуждены только общие подходы и рассмотрены лишь физико-химические основы окислительно- восстановительных процессов, протекающих в природных водах.
2.5.1. Окислительно-восстановительное равновесие
В общем виде окислительно-восстановительный процесс можно представить следующим уравнением:
Окисленные формы + пе− ↔восстановленные формы, (2.65)
где пе− — количество (n) электронов, принимающих участие в данной окислительно-восстановительной реакции.
Константа равновесия этого процесса может быть записана в виде:
![]() (2.66)
(2.66)
где Паi (восстан.форм) и Паi (окисл.форм) — произведения активности восстановленных и окисленных форм соответственно; п — количество электронов, участвующих в процессе; а (электронов) — активность электронов.
Под активностью электронов понимается способность системы поставлять электроны для окислительно-восстановительного процесса. Разумеется, следует отдавать себе отчет в том, что раствор свободных электронов в воде, также как и раствор свободных несольватированных протонов, — это не более чем удобная абстракция, которую широко используют при описании кислотно-основных равновесий в природных водах. Так, например, активность ионов водорода может характеризовать кислотно-основные свойства воды. Поэтому воду шахтных выработок с большой величиной ан+ называют кислой. По аналогии, вода с высокой активностью свободных электронов а (электронов) (которую в дальнейшем будем обозначать как ае-) называется восстановительной (сероводородные воды Черного моря, «мертвая» вода из народных сказок), а с низкой — окислительной (хлорированная или озонированная вода, «живая» вода).
Устойчивые водные системы, как будет показано ниже, могут характеризоваться величинами ае-, различающимися на 20 порядков, поэтому удобным путем выражения активности свободных электрону является шкала ре−. По аналогии с величиной pH величина ре− определяется соотношением:
ре− = - lg(аe−). (2.67)
Величина активности электронов и значение ре удобны для выражения окислительно-восстановительного потенциала системы. Эти понятия широко используются в настоящее время наряду с хорошо известным способом выражения окислительно-восстановительного потенциала в вольтах. Покажем связь между двумя этими способами выражения окислительновосстановительного потенциала системы.
Выразим ре− из общего уравнения для константы равновесия окислительно-восстановительного процесса [из уравнения (2.66)]:
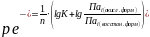 (2.68)
(2.68)
Строгое термодинамическое обоснование концепции ре базируется на рассмотрении реакции:
2Н+ (вода) + 2е− ↔ Н2 (газ). (2.69)
Величина АС реакции (2.69) принимается равной нулю и является базой для определения изменения свободной энергии Гиббса в ходе окислительно-восстановительных реакций в воде. Потенциал, измеренный по отношению к стандартному водородному электроду (СВЭ), называется величиной Eh раствора (Н — символ стандартного водородного электрода). Величина Eh, может быть положительной или отрицательной в зависимости от того, будет ли активность электронов в исследуемом растворе выше или ниже их активности в СВЭ. Величина Eh считается положительной, если активность электронов в растворе меньше, чем в СВЭ.
По термодинамическим конвенциям, относящимся к стандартному водородному электроду, стандартная свободная энергия образования электрона в растворе, как и стандартная свободная энергия образования протона в растворе, принимается равной нулю.
В
стандартных условиях значение энергии
Гиббса для окислительно-восстановительной
реакции можно представить в
виде: ![]() (2.70)
(2.70)
где ∆G° — значение энергии Гиббса в стандартных условиях; п — число электронов, участвующих в процессе; F — число Фарадея; Eоh — окислительно-восстановительный потенциал, измеренный в стандартных условиях относительно стандартного водородного электрона.
Уравнение (2.70) верно только в том случае, когда в записи полу реакции электроны расположены в правой части уравнения.
Подставив это выражение в уравнение зависимости значения логарифма константы равновесия от температуры, получим:
lg К° = nFE°h/(2,3RT). (2.71)
Уравнение (2.68) теперь можно представить в виде:
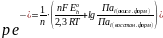 (2.72)
(2.72)
Разделив левую и правую части этого уравнения на дробь вида P/(2,3RT), получим:
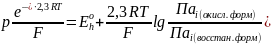 (2.73)
(2.73)
В то же время из основ электрохимии известно, что обобщенное уравнение Нернста имеет вид:
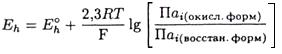 (2.74)
(2.74)
Поскольку правые части уравнений (2.73) и (2.74) равны между собой, то равны и левые части этих уравнений:
ре− = FEh/(2,3RT). (2.75)
При подстановке соответствующих величин получим:
ре− = Еh·104/(1,98Т). (2.76)
Параметр (ре−)° связан с величиной стандартного электродного потенциала E°h соотношением:
(ре−)° = 16,9E°h. (2.77)
Необходимо отметить, что Eh и ре− являются вполне определенными величинами, когда оба члена данной редокс-пары присутствуют вместе в растворе или в контакте с ним. В то же время в реальных природных водах практически всегда содержится более одной редокс-пары. Каждая пара будет определять присущее ей значение ре− (или Eh), однако для разных пар эти две величины могут оказаться неодинаковыми, поскольку для природы характерно скорее отсутствие равновесия каждой из форм со всеми другими формами, чем его наличие. Если не все редокс-пары находятся в равновесии, нельзя говорить о ре− (или Eh) раствора. Можно говорить лишь о значении ре− (или Eh), определяемом отдельной парой в растворе.
Таблицы стандартных электродных потенциалов (ре−)° и E°h приведены в литературе, их значения могут быть также легко вычислены из стандартных свободных энергий образования соединений.
Величины (ре−)° для некоторых окислительно-восстановительных реакций, играющих важную роль в природных химических процессах, приведены в табл. 10 Приложения.
