
- •Внутренняя баллистика
- •Перечень
- •А. Основные положения
- •Глава 1
- •Баллистические характеристики пороха
- •2. Теоретические основы внутренней баллистики
- •2.1. Основные сведения из термодинамики
- •Смесь газов
- •Термодинамические процессы
- •Теплоемкость газа
- •Внутренняя энергия газа
- •Внешняя работа
- •Закон сохранения энергии. Потенциал эквивалентности теплоты и работы
- •Первый закон термодинамики
- •Энтальпия газа
- •Политропический процесс
- •Внешняя работа при термодинамических процессах
- •Процессы обратимые и необратимые
- •3. Общая пиростатика
- •4.Закон газообразования.
- •4.1.Определение
- •4.2. Быстрота газообразования .
- •4.4 Двухчленная формула для зависимости ,
- •5.Закон скорости горения .
- •6.Закон изменения давления в функции от времени
- •7.Баллистический анализ порохов на основе физического закона горения.
- •7.2 Опытная характеристика прогрессивности горения пороха "г".
- •Причины быстрого убывания интенсивности газообразования в последней стадии горения .
- •Особенности горения пороха с узкими каналами .
- •7.6.Интегральные кривые I и как характеристики горения пороха.
- •7.7.Применение интегральных кривых к определению скорости горения .
- •8.1 Характеристики комбинированного заряда .
- •8.2 Закон развития давления пороховых газов при горении комбинированного заряда в постоянном объеме .
- •8.21 Горение одного пороха .
- •8.2.2 Горение комбинированного заряда .
- •Раздел 2 .
- •9.3 Методы увеличения скорости снаряда
- •Плотность заряжания.
- •9.4 Коэффициент учета второстепенных работ – коэффициент фиктивности - .Учет теплоотдачи и прорыва пороховых газов .
- •11.2 Решение задачи Лагранжа .
Теплоемкость газа
Кроме параметров состояния газа (р, w, и Т) большую роль в термодинамических процессах играет физическая величина, называемая теплоемкостью. Теплоемкость газа представляет собой количество тепла – q, сообщаемое единице веса газа в данном процессе при изменении его температуры на 1 ºС. Как видно из определения, характер процесса оказывает существенное влияние на величину теплоемкости. Теплоемкость – С измеряется в ккал/кг·град. Различают истинную и среднюю теплоемкость.
Истинная теплоемкость
![]()
где: q – количество тепла;
t – температура газа в ºС, соответствует бесконечно малому изменению температуры газа в ходе конкретного термодинамического процесса. Теплоемкость газа существенно зависит от температуры. Для пороховых газов зависимостью теплоемкости от давления пренебрегают. В диапазоне температур 2000 – 3500 ºС. Теплоемкость можно принять изменяющуюся от температуры по линейному закону.
С = а + вt º
Где а и в – числовые коэффициенты, зависящие от физико-химических свойств газа и характера протекающего в нем термодинамического процесса.
Средняя
теплоемкость -
![]() - среднее значение в диапазоне температур
t1º
и t2º,
которое определяется из соотношения
- среднее значение в диапазоне температур
t1º
и t2º,
которое определяется из соотношения
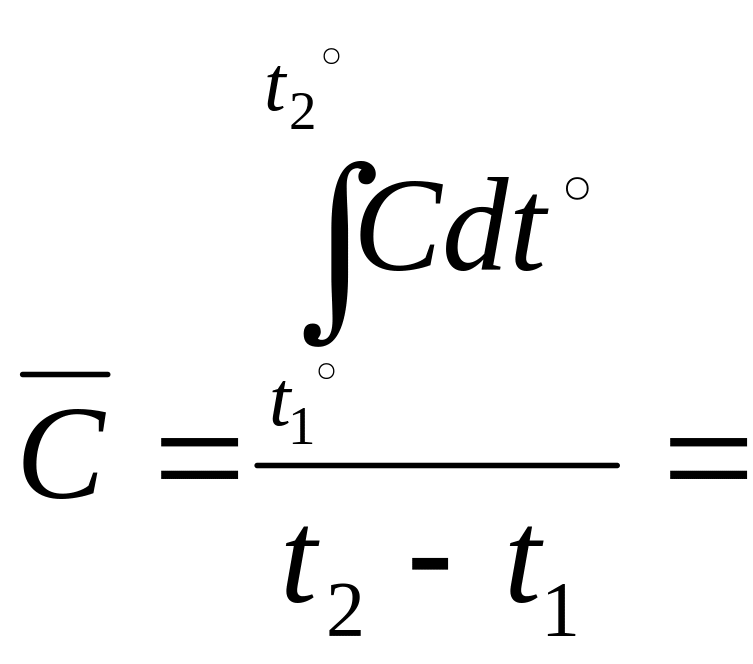
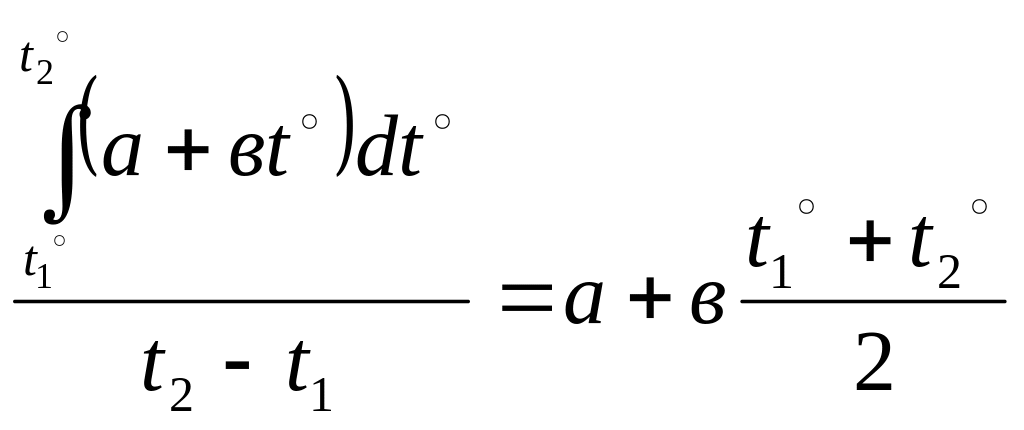 (2.13.)
(2.13.)
В термодинамических расчетах широко применяются теплоемкости изохорного (Сw) и изобарного (Ср) процессов, а также отношение этих теплоемкостей
![]()
Коэффициент
К называется показателем адиабаты. Для
идеальных газов К является величиной,
зависящей лишь от числа степеней свободы.
По данным кинетической теории для
одноатомных газов
![]() ,
для двухатомных
,
для двухатомных
![]() ,
для трехатомных
,
для трехатомных
![]() .
.
В баллистике чаще применяется разность между К и 1 и обозначается буквой θ
![]()
Величины К и θ являются функциями температуры. Значение Q убывает с увеличением температуры.
Из физики известно, что μ Ср - μ Сw = А·Rμ= 2
Где μ С – молярная теплоемкость, ккал/кмоль·град
![]()
![]()
![]()
![]()
Для смеси газов теплоемкость C определяется по формуле (2.14.)
![]() (2.14.)
(2.14.)
где: Сi – теплоемкость i-го компонента смеси;
qi – весовая доля i-го компонента смеси.
Внутренняя энергия газа
Увеличение температуры газа приводит к увеличению ее внутренней энергии. Под внутренней энергией подразумевается сумма его внутренней кинетической энергии молекул и внутренней потенциальной энергии молекул. Внутренняя энергия газа обозначается в термодинамике буквой “u” для единицы веса (1 кг) газа и через “U” для произвольного количества газа и измеряется в тепловых единицах “u” в ккал/кг, “U” в ккал.
Внутренняя энергия реального газа определяется значениями двух термодинамических параметров при использовании уравнения состояния внутреннюю энергию газа можно представить как функцию, зависящую от 2-х параметров из 3-х. u = f1 (T, w), u = f2 (T, p), u = f3 (p, w).
Отсюда следует, что изменение внутренней энергии газа не зависит от характера процесса перехода его от одного состояния к другому и определяется начальным и конечным состоянием газа, т.е. является однозначной функцией его состояния. На рис. 4 представлены различные процессы перехода газа из начального состояния (точка 1) в конечное состояние (точка 2). Процессы обозначены кривыми “a”, “в” и “c”.
![]()
Идеальный газ не обладает силами взаимодействия молекул. Его внутренняя энергия состоит лишь из кинетической энергии молекул.
![]()
Таким образом, для идеального газа его внутренняя энергия является только функцией температуры u = f (T). Пороховой газ при выстреле из баллистического орудия для расчета внутренней энергии рассматривается
 Р
Р
 1
1

 Р1
a
Р1
a
в
с
Р2 2

w1 w2 w
Рис. 4
как идеальный, например, для изохорного процесса (w = const). Тепло, подведенное к газу q = Сw (t2º - t1º). Т.к. газ в этом процессе не совершает работу, все подведенное тепло идет на увеличение его внутренней энергии, т.е. Δu = q Δu = Сw (t2º - t1º) и ΔU = ω·Сw (t2º - t1º) = u2 – u1
