
- •3.2. Обмен липидов
- •3.2.1. Синтез глицеролфосфата и жирных кислот
- •3.2.2. Синтез ацилглицеринов
- •3.2.3. Синтез фосфолипидов
- •3.2.4. Распад жиров
- •От образовавшегося b-оксиацил-КоА-производного жирной кислоты отщепляется водород. Эту реакцию катализирует фермент 3-оксоацил-КоА-дегидрогеназа (1.1.1.35), содержащий в активном центре кофермент над:
- •3.2.5. Превращение жирных кислот в углеводы
- •3.2.6. Распад фосфолипидов
- •3.2.7. Синтез и превращения других липидов
- •3.3. Обмен азотистых веществ
- •3.3.1. Синтез аминокислот
- •3.3.2. Превращение и распад аминокислот
- •3.3.3. Связывание избыточного аммиака
- •3.3.4. Синтез аминокислот с использованием нитратной формы азота
- •3.3.5. Синтез аминокислот при восстановлении молекулярного азота
- •3.3.6. Нуклеиновые кислоты
3.3.5. Синтез аминокислот при восстановлении молекулярного азота
Известны группы растений, способные за счёт симбиоза с клетками микроорганизмов использовать для синтеза азотистых веществ молекулярный азот, который содержится в большом количестве в земной атмосфере. Этот процесс в биологии называют симбиотической азотфиксацией. У таких растений в специальных структурных образованиях на корнях или в листьях осуществляют жизнедеятельность микроорганизмы-симбионты: клубеньковые бактерии, актиномицеты, цианобактерии (синезелёные водоросли).
Большинство растений, способных к симбиотической азотфиксации, образуют на корнях или листьях утолщённые выросты, называемые клубеньками, в которых находятся видоизменённые клетки микроорганизмов- симбионтов. Такие микроорганизмы, находящиеся в клубеньках, питаются растительными метаболитами, которые образуются из поступающих в клу-беньки фотоассимилятов, а продукты их жизнедеятельности, синтезируемые за счёт связывания молекулярного азота атмосферы, используются растениями для новообразования азотистых веществ.
На корнях многих древесных и кустарниковых растений (ольха, облепиха, восковница и др.) формируются клубеньки, образуемые актиномицетами. На корнях некоторых австралийских цикадовых растений в качестве симбионтов развиваются цианобактерии, фиксирующие молекулярный азот. На рисовых полях в южных странах разводят водяной папоротник Azolla, в листьях которого осуществляют жизнедеятельность симбиотические азотфиксирующие цианобактерии. За счёт его культивирования рисовые поля обогащаются азотом.
С бобовыми растениями в симбиоз вступают бактерии рода Rhizobium. С их участием бобовые культуры могут фиксировать в год от 50 до 600 кг молекулярного азота на 1 га, практически полностью обеспечивая свои потребности в азотном питании. Кроме того, в результате минерализации пожнивных остатков этих культур происходит существенное обогащение почвы доступным для усвоения последующими культурами азотом. Особенно много азота могут накапливать за счёт симбиотической азотфиксации люцерна (300–500 кг × га–1), клевер (200–300 кг × га–1), люпин (100–200 кг × га–1).
Восстановление молекулярного азота в аммиачный катализирует ферментный комплекс нитрогеназы (1.18.2.1), состоящий из двух белков. Один из них, высокомолекулярный, осуществляет непосредственно восстановление молекул азота. Он представляет собой тетрамер, состоящий из двух типов субъединиц, входящих поровну в состав тетрамерного белка (a2b2). В молекуле тетрамера содержится два атома Mo, с каждым из которых взаимодействуют три 4Fe4S-кластера, образуя каталитический центр. С ним связываются молекулы азота и подвергаются восстановлению. Белковый компонент нитрогеназы, катализирующий восстановление молекулярного азота, называют Mo,Fe-белком.
В составе нитрогеназы содержится также низкомолекулярный белок, состоящий из двух одинаковых полипептидных субъединиц. Он включает в качестве активной группировки 4Fe4S-кластер и выполняет функцию восстановления Mo,Fe-белка посредством переноса электронов от вос-становленного ферредоксина. Поскольку низкомолекулярный компонент нитрогеназы содержит железосерную группировку, его называют Fe,S-белком. Следует отметить, что перенос электронов от Fe,S-белка на Mo,Fe-белок сопряжён с гидролизом АТФ. С помощью молекулярных расчётов определено, что перенос каждой пары электронов в ферментном комплексе нитрогеназы сопряжен с гидролизом 4–5 молекул АТФ.
Молекулярная масса Fe,S-белка клубеньков бобовых растений составляет ~65 тыс., Mo,Fe-белка – порядка 200 тыс. По-видимому, восстановление азота происходит в три стадии. Вначале молекула азота, акцептируя два электрона и два протона, превращается в диимид. Затем к атомам азота диимида в составе ферментного комплекса присоединяются ещё два электрона и два протона с образованием гидразина. На конечной стадии в результате присоединения двух электронов и двух протонов гидразин восстанавливается в аммиак, который высвобождается из ферментного комплекса и используется далее для синтеза аминокислот. Последовательность восстановительных реакций в активном центре нитрогеназы может быть представлена в виде следующей схемы:
Mo®NºN¬Mo
2ē,2H⁺
2ē,2H⁺
2ē,2H⁺ \
∕
¾®
HN+=
N+H
¾®
H2N+
– N+H2
¾®
Mo Mo + 2NH3
фермент
| |
| |
\ /
(Ф)
Mo Mo Mo
Mo Ф
\
/ \ /
Ф
Ф
молекула азота
последовательные стадии
восстановления в
активном центре молекулярного
азота
нитрогеназы
Нитрогеназа, катализирующая симбиотическую азотфиксацию, локализована в клетках клубеньков растения-симбионта. Наиболее хорошо изучен процесс азотфиксации в клубеньках бобовых растений. Бактерии рода Rhizobium проникают в ткани коры корней бобового растения и инициируют в них интенсивное деление клеток, что приводит к образованию на корнях утолщений в виде клубеньков. Возникновение клубеньков – результат довольно сложного взаимодействия растения с клубеньковыми бактериями на генетическом и молекулярном уровнях.
Инициаторами такого взаимодействия являются бобовые растения, которые выделяют в ризосферу корней специфические флавоноиды, под действием которых в клетках бактерий инициируется синтез так называемых Nod-факторов, представляющих собой олигосахариды из 3–6 остатков N-ацетилглюкозамина, соединённые через атом азота с радикалом ненасыщенной жирной кислоты (специфичной для каждого вида бактерий). В свою очередь бактериальные Nod-факторы оказывают воздействие на клет-ки корневых волосков бобового растения, вызывая деформацию клеточной стенки и плазмалеммы.
В результате взаимодействия мембранных компонентов раститель-ной и бактериальной клеток формируется особая структура – инфекционная нить, которая проникает в кортикальные клетки коры корня и инициирует там образование мембран, отделяющих бактериальные клетки от цитоплазмы клеток растения, формирующих ткани клубеньков. Бактериальные клетки в клубеньках увеличиваются в размерах и превращаются в особые структуры, предназначенные для азотфиксации, – бактероиды. В них синтезируются ферментные системы нитрогеназы, электронтранспортной цепи, синтеза АТФ, катализирующие реакции цикла Кребса, а также осу-ществляющие транспорт в бактероид растительных метаболитов и выводящие из него в растительную клетку продукты восстановления молекулярного азота (рис. 3.6).
В бактероидах основной источник электронов и энергии для восстановления молекулярного азота – реакции цикла Кребса, субстратами для которых служат главным образом дикарбоновые кислоты (янтарная и яблочная), поступающие в бактероид из растительных клеток клубеньков. Указанные субстраты, питающие бактероид, образуются в клетках клубеньков из фотоассимилятов растения по известным нам механизмам в соответствии со следующей схемой:
Сахароза, поступающая по флоэмной системе ® моносахариды ®
® гликолиз ® фосфоенолпировиноградная кислота
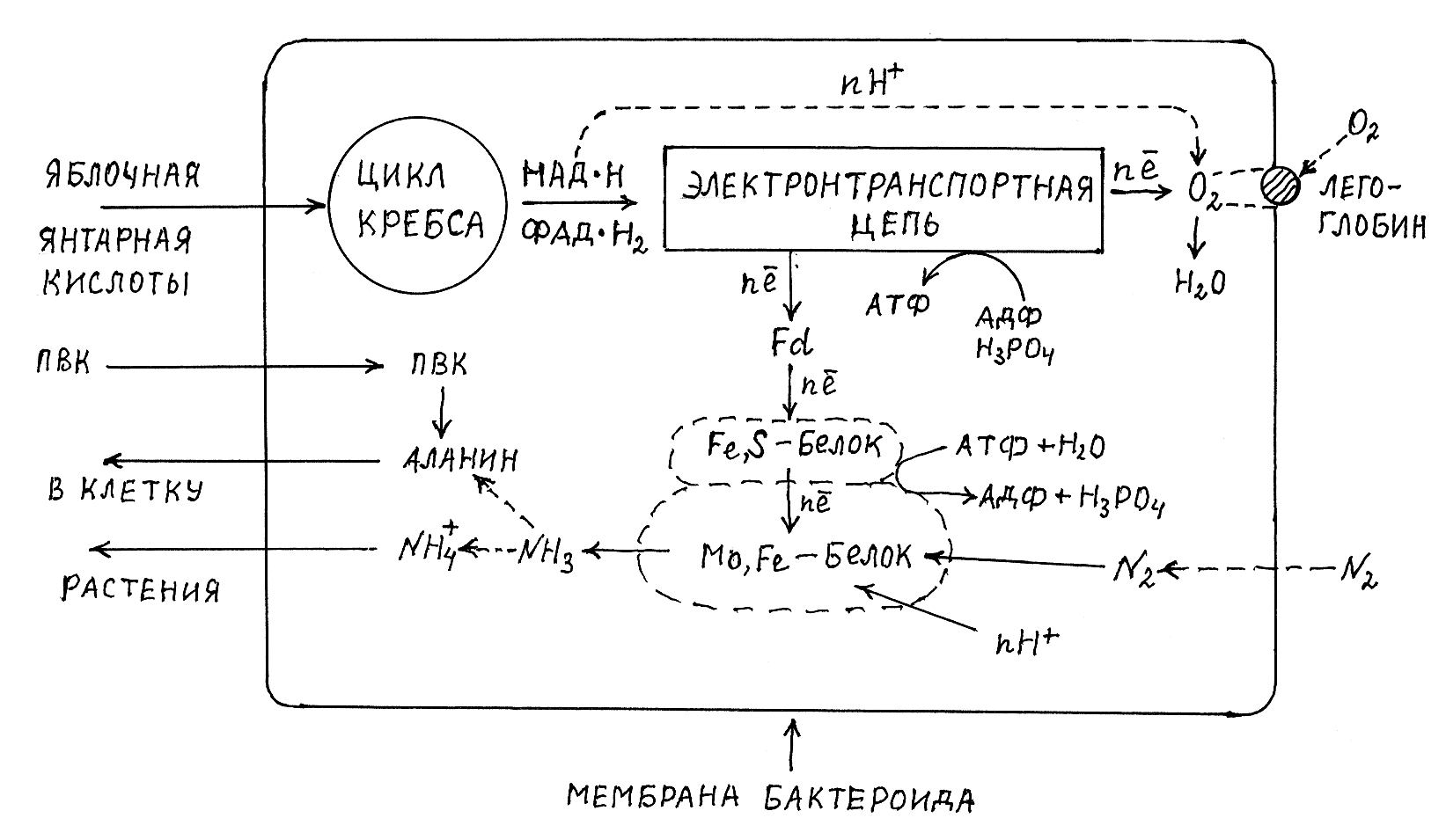
Рис. 3.6. Схема биохимических процессов, происходящих в бактероидах клубеньков бобовых растений
CH2
CH2–СООН
СН2–СООН
║
| НАД
× Н
+ Н+
|
CO~Ⓟ
+ CO2
+ H2O
¾®
CO–COOH ¾¾¾®
CHOH–COOH
| ↓
щавелевоук- ↓
яблочная кислота
COOH
H3РO4
сусная кислота НАД+
фосфоенол-
пировиноградная
кислота
В мембране, окружающей бактероид, локализованы также ферменты, катализирующие превращение яблочной кислоты в янтарную.
В ходе реакций цикла Кребса, происходящих в бактероиде, синтезируются восстановленные динуклеотиды НАД × Н и ФАД × Н2, которые слу-жат донорами электронов для электронтранспортной цепи системы окислительного фосфорилирования, обеспечивающей синтез АТФ по такому же механизму, как и в митохондриях. Одновременно из электронтранспортной цепи через ферредоксин осуществляется вывод электронов на Fe,S-белки нитрогеназы, которые сопряжённо с гидролизом АТФ переносят их на активные группировки Mo,Fe-белков.
Часть метаболитов растения, поступающих в бактероиды, превращается в полиэфир b-оксимасляной кислоты, который служит запасным веществом в клетках бактерий и бактероидах клубеньков. Поли-b-оксимас-ляная кислота откладывается в специальных гранулах, и её содержание изменяется в зависимости от процесса азотфиксации.
Поскольку нитрогеназа инактивируется кислородом, клетка бактероида защищена от его проникновения внешней мембраной. Однако в системе окислительного фосфорилирования конечным акцептором электронов служит кислород, который вводится в бактероид в связанном состоянии специальным белком легоглобином. Легоглобины представляют собой гемопротеиды с молекулярной массой 15–16 тыс., которые синтезируются клетками растения. Как и гемоглобин крови человека и животных, лего-глобин содержит активную группировку в виде протогема, с которой связывается молекулярный кислород, образуя оксилегоглобин. В таком виде обеспечивается транспорт кислорода через мембрану бактероида и передача его на активный центр терминальной оксидазы электронтранспортной цепи бактероида, где кислород акцептирует электроны.
Кроме молекул азота, ферментный комплекс нитрогеназы одновременно восстанавливает также катионы водорода в молекулярный водород в соответствии с реакцией: 2Н+ + 2ē ¾® Н2. Поэтому наряду с аммиаком продуктом действия нитрогеназы является также молекулярный водород, при окислении которого у некоторых штаммов клубеньковых бактерий осуществляется дополнительный синтез АТФ. Окисление водорода катализирует фермент гидрогеназа. В опытах показано, что штаммы клубеньковых бактерий, способные к синтезу гидрогеназы, обеспечивают более интенсивную фиксацию молекулярного азота, вследствие чего повышается продуктивность бобовых растений, инфицированных этими видами клубеньковых бактерий.
Для питания бактероида субстратами цикла Кребса используется не только СО2, фиксированный в процессе фотосинтеза, но и диоксид углерода, поступающий в клубеньки из почвы или выделяющийся как продукт дыхания в клетках клубеньков. За счёт гетеротрофной фиксации СО2 в бактероиды поступает до 25% углерода, находящегося в составе субстратов цикла Кребса.
Продукт восстановления в бактероидах молекулярного азота – аммиак – транспортируется из бактероида в цитоплазму растительных клеток клубеньков в виде катионов аммония или аланина, который синтезируется с участием аланиндегидрогеназы бактероидов из поступающей в бактероиды пировиноградной кислоты растительного происхождения. В цитоплазме растительных клеток клубеньков локализован фермент глутаминсинтетаза, катализирующий синтез глутамина, а в пластидах – глутаматсинтаза, с участием которой синтезируется глутаминовая кислота. Под действием указанных ферментов, а также аминотрансфераз в клубеньках осуществляется синтез глутамина и аспарагина, которые далее переносятся по транспортной системе растения в другие органы. У некоторых бобовых (соя, фасоль, вигна) транспортными формами азота служат аллантоин и аллантоиновая кислота, являющиеся продуктами нуклеотидного обмена. Таким образом, бобовые растения, имеющие активные клубеньки, за счёт симбиотической азотфиксации практически полностью обеспечивают свои потребности в восстановленных формах азота.
Эффективность азотфиксации в клубеньках бобовых растений тесно связана с интенсивностью фотосинтеза. Факторы, влияющие на процессы фотоассимиляции, соответствующим образом влияют и на скорость усвоения растениями молекулярного азота. Особенно заметно снижается симбиотическая азотфиксация у бобовых при недостаточном их питании молибденом и кобальтом. Как мы уже знаем, молибден входит в состав активной группировки Mo,Fe-белка нитрогеназы, а кобальт активирует в составе клубеньков ферменты, имеющие в качестве активных группировок коферментные формы витамина В12.
Кроме симбиотических азотфиксаторов молекулярный азот атмосферы усваивают также некоторые свободноживущие микроорганизмы. К ним относятся аэробные бактерии родов Azotobacter и Beiyerinckia, анаэробные бактерии из рода Clostridium, отдельные виды цианобактерий и фотосинтезирующих бактерий. Их вклад в обогащение почвы биологически связанным азотом менее значителен, чем симбиотических микроорганизмов, при благоприятных условиях ежегодная фиксация ими азота может достигать 30–40 кг/га. Все они способны синтезировать ферментный комплекс нитрогеназы, катализирующий в их клетках восстановление молекул азота до аммиачной формы. Донорами электронов для нитрогеназы служат бактериальный ферредоксин и его молекулярные аналоги.
