
- •Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия. Строение и функции белков
- •Химический состав белков Элементарный состав белков
- •Виды связей аминокислот в белках.
- •Структурная организация белков
- •Факторы устойчивости белковых растворов
- •Заряд белковой молекулы.
- •Формирование гидратной (водной) оболочки
- •Виды осадочных реакций белков из растворов
- •Методы количественного определения белков, используемые в лабораторной практике
- •Выделение, фракционирование и очистка белков
- •Классификация белков
- •Структура, свойства и механизм действия ферментов Краткая история ферментологии
- •Структура ферментов
- •Механизм действия ферментов.
- •Снижение ферментами энергии активации.
- •Увеличение ферментами стерического коэффициента.
- •Номенклатура ферментов
- •Классификация ферментов.
- •Трансферазы.
- •Гидролазы.
- •Синтетазы (лигазы).
- •Свойства ферментов.
- •Термолябильность ферментов.
- •Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
- •Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
- •Механизм действия активаторов.
- •Регуляция активности ферментов в процессе метаболизма.
- •Структурная организация ферментов в клетке
- •Принципы обнаружения и количественного определения ферментов:
- •Количественное определение ферментов
- •Единицы активности (количества) фермента
- •Клиническая ферментология
- •Биологическое окисление
- •Краткая история учения о биологическом окислении
- •Дегидрогеназы
- •Никотинамидзависимые дегидрогеназы
- •Флавопротеиды – флавиновые дегидрогеназы
- •Убихинон (КоQ)
- •Цитохромы
- •Оксигеназы
- •Пероксидазы
- •Внутримитохондриальное окисление. Окислительное фосфорилирование.
- •Длинная дыхательная цепь.
- •Короткая дыхательная цепь.
- •Энергетический обмен
- •Окислительное фосфолирирование
- •Регуляция окислительного фосфолирирования.
- •Нарушение энергетического обмена.
- •Окисление с участием оксидаз.
- •Окисление с участием оксигеназ.
- •Пероксидазное окисление.
- •Общие пути катаболизма
- •С хема общих путей катаболизма. Окислительное декарбоксилирование пировиноградной кислоты
- •Липоевая кислота
- •Пантотеновая кислота
- •Цикл трикарбоновых кислот (цикл Кребса)
- •Химизм цикла Кребса (цикла трикарбоновых кислот)
- •Биологическое значение цикла Кребса
- •Регуляция активности цтк
- •Обмен и функции углеводов
- •Олигосахариды
- •Гетерополисахариды
- •Переваривание углеводов
- •Обмен гликогена
- •Распад гликогена
- •Обмен глюкозы в тканях Окисление глюкозы в тканях.
- •Анаэробное окисление глюкозы
- •Аэробное окисление глюкозы.
- •Биосинтез глюкозы. Глюконеогенез.
- •Витамин н, биотин, антисеборейный витамин
- •Пентозофосфатный путь окисления глюкозы.
- •Утилизация фруктозы.
- •Взаимные превращения углеводов (гексоз)
- •Особенности обмена глюкозы в различных тканях
- •Регуляция углеводного обмена.
- •Патология углеводного обмена. Нарушение переваривания и всасывания углеводов.
- •Нарушение содержания уровня глюкозы в крови.
- •Нарушение тканевого обмена углеводов.
- •Обмен и функции липидов Спиртовой и жирнокислотный состав основных жиров тканей человека
- •Классификация жиров.
- •Глицеринсодержащие жиры
- •Глицерофосфолипиды (фл)
- •Сфингозинсодержащие жиры
- •Холестеринсодержащие жиры
- •Функции жиров
- •Структура и функции клеточных мембран
- •Переваривание жиров.
- •Всасывание продуктов расщепления жиров
- •Ресинтез жиров в слизистой тонкого кишечника
- •Особенности переваривания и всасывании жиров у детей
- •Транспорт жиров кровью
- •Обмен триацилглицеринов Распад триацилглицеринов в тканях (липолиз)
- •Окисление жирных кислот.
- •Химизм β - окисления насыщенных жирных кислот
- •Синтез триацилглицеролов
- •Обмен глицерофосфолипидов Синтез глицерофосфолипидов
- •Распад глицерофосфолипидов
- •Синтез сфинголипидов.
- •Распад сфинголипидов
- •Обмен холестерина
- •Биосинтез холестерина
- •Выделение холестерина из организма
- •Нарушение обмена холестерина
- •Взаимосвязь липидного и углеводного обменов
- •Ацетоновые тела.
- •Регуляция липидного обмена
- •Патология липидного обмена
- •Перекисное окисление липидов (пол)
- •Эйкозаноиды
- •Синтез эйкозаноидов.
- •Обмен белков
- •Переваривание белков
- •Всасывание аминокислот
- •Гниение белков в толстом кишечнике
- •Обезвреживание продуктов гниения белков в печени
- •Динамическое состояние белков в тканях организма
- •Катаболизм аминогруппп аминокислот. Трансаминирование аминокислот
- •Дезаминирование аминокислот
- •Окислительное дезаминирование
- •Катаболизм карбоксильных групп аминокислот. Декарбоксилирование аминокислот. Биогенные амины
- •Образование и обезвреживание аммиака в организме
- •Пути временного (экстренного) связывания аммиака в тканях Восстановительное аминирование альфа-кетокислот
- •Амидирование тканевых белков.
- •Синтез глютамина
- •Конечные продукты азотистого обмена Синтез аммонийных солей в почках
- •Биосинтез мочевины.
- •Обмен безазотистых радикалов аминокислот
- •Особенности обмена отдельных аминокислот Обмен глицина и серина.
- •Витамин Вс, в9, фолиевая кислота, антианемический витамин
- •Обмен серосодержащих аминокислот цистеина и метионина
- •Витамин в12, кобаламин, антианемический витамин
- •Нарушение обмена серосодержащих аминокислот
- •Обмен фенилаланина и тирозина
- •Регуляция белкового обмена
- •Патология белкового обмена
- •Обмен и функции нуклеиновых кислот
- •Дезоксирибонуклеиновая кислота
- •Распад пиримидиновых нуклеотидов
- •Синтез пуриновых нуклеотидов
- •Основной путь синтеза пуриновых нуклеотидов
- •Дополнительный путь синтеза пуриновых нуклеотидов
- •Синтез пиримидиновых нуклеотидов
- •Биосинтез днк
- •Биосинтез рнк (транскрипция)
- •Биосинтез белков – трансляция
- •Посттрансляционная модификация белков
- •Ингибиторы биосинтеза белка
- •Регуляция биосинтеза белка
- •Биохимия гормонов
- •Классификация гормонов по их химической природе
- •Обмен гормонов.
- •Механизмы действия гормонов.
- •Краткая характеристика гормонов.
- •Гормоны паращитовидных желез
- •Гормоны поджелудочной железы
- •Гормоны вилочкой железы
- •Гормоны щитовидной железы
- •Гормоны мозгового слоя надпочечников (катехоламины)
- •Гормоны эпифиза
- •Гормоны коры надпочечников
- •Глюкокортикоиды
- •Гормоны плаценты
- •Особенности гормонального статуса у детей
- •Биохимия крови
- •Биохимия эритроцитов.
- •Химический состав эритроцитов.
- •Особенности метаболизма в эритроцитах
- •Обмен гемопротеидов
- •Нарушения распада гема.
- •Химический состав плазмы крови
- •Белки плазмы крови
- •Изменение белкового состава крови при заболеваниях
- •Небелковые азотсодержащие вещества.
- •Кининовая система крови.
- •Безазотистые органические вещества крови
- •Минеральные вещества крови
- •Физико-химические свойства крови.
- •Нарушение кислотно-основного баланса.
- •Особенности кислотно-основного состояния у детей.
- •Дыхательная функция крови Транспорт кислорода
- •Нарушения транспорта кислорода
- •Транспорт со2.
- •Регуляция агрегатного состояния крови (раск) Свёртывающая система крови.
- •Плазменные факторы свёртывающей системы крови
- •Внутренний механизм ввертывания крови (контактный)
- •Внешний механизм свертывания крови (прокоагулянтный)
- •Детские особенности системы гемостаза
- •Нарушения гемостаза.
- •Водно–солевой обмен Водный обмен
- •Биологическая роль воды в организме.
- •Факторы движения воды в организме.
- •Обмен натрия и калия
- •Ренин-ангиотензивная система крови.
- •Особенности водного обмена у детей.
- •Кальций - фосфорный обмен
- •Регуляция кальций – фосфорного обмена.
- •Нарушение кальций – фосфорного обмена
- •Обмен железа.
- •Тканевая биохимия
- •Состав и обмен основного межклеточного вещества.
- •Обмен белков соединительной ткани. Обмен коллагена
- •Синтез коллагена.
- •Распад коллагена.
- •Азотистые экстрактивные вещества мышц.
- •Органические безазотистые вещества
- •Минеральные вещества
- •Химизм мышечного сокращения и расслабления.
- •Белки головного мозга
- •Азотистые небелковые вещества
- •Липиды головного мозга
- •Углеводы головного мозга
- •Минеральные вещества
- •Проведение нервного импульса
- •Передача нервного импульса
- •Антитоксическая функция
Структура, свойства и механизм действия ферментов Краткая история ферментологии
Экспериментальное изучение ферментов в 19 веке совпало по времени с изучением процессов дрожжевого брожения, что нашло отражение в терминах «ферменты» и «энзимы». Название ферменты возникло от латинского слова fermentatio – брожение. Термин энзимы произошёл от понятия en zyme - из дрожжей. Вначале этим названиям придавали разный смысл, но в настоящее время они являются синонимами.
Первая ферментативная реакция осахаривания крахмала солодом была исследована отечественным учёным К.С. Кирхгоффом в 1814 году. Впоследствии были предприняты попытки выделения ферментов из дрожжевых клеток (Э. Бюхнер, 1897 год). В начале ХХ века Л. Михаэлис и М. Ментен разработали теорию ферментативного катализа. В 1926 году Д. Самнер впервые выделил очищенный препарат фермента уреазы в кристаллическом состоянии. В 1966 году Б. Меррифилду удалось осуществить искусственный синтез фермента РНК-азы.
Структура ферментов
Ферменты – это высокоспециализированные белки, способные повышать скорость реакции в живых организмах. Ферменты - биологические катализаторы.
Все ферменты являются белками, как правило, глобулярными. Они могут относиться как к простым, так и к сложным белкам. Белковая часть фермента может состоять из одной полипептидной цепи – мономерные белки – ферменты (например, пепсин). Ряд ферментов являются олигомерными белками, включают в свой состав несколько протомеров или субъединиц. Протомеры, объединяясь в олигомерную структуру, соединяются самопроизвольно непрочными нековалентными связями. В процессе объединения (кооперации) происходят структурные изменения отдельных протомеров, в результате чего активность фермента заметно возрастает. Отделение (диссоциация) протомеров и их объединение в олигомерный белок является механизмом регуляции активности ферментов.
Субъединицы (протомеры) в олигомерах могут быть или одинаковыми или отличающимися по первичной - третичной структуре (конформации). В случае соединения различных протомеров в олигомерную структуру фермента возникают множественные формы одного и того же фермента – изоферменты.
Изоферменты катализируют одну и ту же реакцию, но отличаются по набору субъединиц, физико-химическим свойствам, электрофоретической подвижности, по сродству к субстратам, активаторам, ингибиторам. Например, лактатдегидрогеназа (ЛДГ) – фермент, окисляющий молочную кислоту в пировиноградную кислоту, является тетрамером. Он состоит из четырёх протомеров двух типов. Один вид протомеров обозначается Н (выделен из сердечной мышцы), второй протомер обозначается М (выделен из скелетной мускулатуры). Возможно 5 сочетаний этих протомеров в составе ЛДГ: Н4, Н3М, Н2М2, Н1М3, М4.
Биологическая роль изоферментов.
Изоферменты обеспечивают протекание химических реакций в соответствии с условиями в разных органах. Так, изофермент ЛДГ1 – обладает высоким сродством к кислороду, поэтому он активен в тканях с высокой скоростью окислительных реакций (эритроциты, миокард). Изофермент ЛДГ5 активен в присутствии высокой концентрации лактата, наиболее характерен для ткани печени
Выраженная органоспецифичность используется для диагностики заболеваний различных органов.
Изоферменты изменяют свою активность с возрастом. Так, у плода при недостатке кислорода преобладает ЛДГ3, а с увеличением возраста, увеличением поступления кислорода возрастает доля ЛДГ2.
Если фермент является сложным белком, то он состоит из белковой и небелковой части. Белковая часть является высокомолекулярной, термолябильной частью фермента и называется апоферментом. Он имеет своеобразную структуру и определяет специфичность ферментов.
Небелковая часть фермента называется кофактором (коферментом). Кофактором чаще всего являются ионы металлов, которые могут прочно связываться с апоферментом (например, Zn в ферменте карбоангидразе, Сu в ферменте цитохромоксидазе). Коферменты чаще всего являются органическими веществами, менее прочно связанными с апоферментом. Коферментами являются нуклеотиды НАД, ФАД. Кофермент – низкомолекулярная, термостабильная часть фермента. Его роль заключается в том, что он определяет пространственную укладку (конформацию) апофермента, и определяет его активность. Кофакторы могут переносить электроны, функциональные группы, участвовать в образовании дополнительных связей между ферментом и субстратом.
В функциональном отношении в ферменте принято выделять два важных участка в молекуле фермента: активный центр и аллостерический участок
Активный центр – это участок молекулы фермента, который взаимодействует с субстратом и участвует в каталитическом процессе. Активный центр фермента образован радикалами аминокислот, удалённых друг от друга в первичной структуре. Активный центр имеет трёхмерную укладку, чаще всего в его составе выявляются
- ОН группы серина
- SH – цистеина
- NH2 лизина
- γ-СООН глютаминовой кислоты
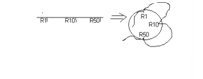
В активном центре различают две зоны – зону связывания с субстратом и каталитическую зону.
Зона связывания обычно имеет жёсткую структуру, к которой комплементарно присоединяется субстрат реакции. Например, трипсин расщепляет белки в участках, богатых положительно заряженной аминокислотой лизином, так как в его зоне связывания содержатся остатки отрицательно заряженной аспарагиновой кислоты.
Каталитическая зона - это участок активного центра, непосредственно воздействующий на субстрат и осуществляющий каталитическую функцию. Это зона более подвижна, в ней возможно изменение взаиморасположения функциональных групп.
В ряде ферментов (чаще олигомерных) кроме активного центра присутствует аллостерический участок – участок молекулы фермента, удалённый от активного центра и взаимодействующий не с субстратом, а с дополнительными веществами (регуляторами, эффекторами). В аллостерических ферментах в одной субъединице может находиться активный центр, в другой - аллостерический участок. Аллостерические ферменты изменяют свою активность следующим образом: эффектор (активатор, ингибитор) действует на аллостерическую субъединицу и изменяет её структуру. Затем изменение конформации аллостерической субъединицы по принципу кооперативных изменений опосредованно меняет структуру каталитической субъединицы, что сопровождается изменение активности фермента.
