
- •Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия. Строение и функции белков
- •Химический состав белков Элементарный состав белков
- •Виды связей аминокислот в белках.
- •Структурная организация белков
- •Факторы устойчивости белковых растворов
- •Заряд белковой молекулы.
- •Формирование гидратной (водной) оболочки
- •Виды осадочных реакций белков из растворов
- •Методы количественного определения белков, используемые в лабораторной практике
- •Выделение, фракционирование и очистка белков
- •Классификация белков
- •Структура, свойства и механизм действия ферментов Краткая история ферментологии
- •Структура ферментов
- •Механизм действия ферментов.
- •Снижение ферментами энергии активации.
- •Увеличение ферментами стерического коэффициента.
- •Номенклатура ферментов
- •Классификация ферментов.
- •Трансферазы.
- •Гидролазы.
- •Синтетазы (лигазы).
- •Свойства ферментов.
- •Термолябильность ферментов.
- •Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
- •Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
- •Механизм действия активаторов.
- •Регуляция активности ферментов в процессе метаболизма.
- •Структурная организация ферментов в клетке
- •Принципы обнаружения и количественного определения ферментов:
- •Количественное определение ферментов
- •Единицы активности (количества) фермента
- •Клиническая ферментология
- •Биологическое окисление
- •Краткая история учения о биологическом окислении
- •Дегидрогеназы
- •Никотинамидзависимые дегидрогеназы
- •Флавопротеиды – флавиновые дегидрогеназы
- •Убихинон (КоQ)
- •Цитохромы
- •Оксигеназы
- •Пероксидазы
- •Внутримитохондриальное окисление. Окислительное фосфорилирование.
- •Длинная дыхательная цепь.
- •Короткая дыхательная цепь.
- •Энергетический обмен
- •Окислительное фосфолирирование
- •Регуляция окислительного фосфолирирования.
- •Нарушение энергетического обмена.
- •Окисление с участием оксидаз.
- •Окисление с участием оксигеназ.
- •Пероксидазное окисление.
- •Общие пути катаболизма
- •С хема общих путей катаболизма. Окислительное декарбоксилирование пировиноградной кислоты
- •Липоевая кислота
- •Пантотеновая кислота
- •Цикл трикарбоновых кислот (цикл Кребса)
- •Химизм цикла Кребса (цикла трикарбоновых кислот)
- •Биологическое значение цикла Кребса
- •Регуляция активности цтк
- •Обмен и функции углеводов
- •Олигосахариды
- •Гетерополисахариды
- •Переваривание углеводов
- •Обмен гликогена
- •Распад гликогена
- •Обмен глюкозы в тканях Окисление глюкозы в тканях.
- •Анаэробное окисление глюкозы
- •Аэробное окисление глюкозы.
- •Биосинтез глюкозы. Глюконеогенез.
- •Витамин н, биотин, антисеборейный витамин
- •Пентозофосфатный путь окисления глюкозы.
- •Утилизация фруктозы.
- •Взаимные превращения углеводов (гексоз)
- •Особенности обмена глюкозы в различных тканях
- •Регуляция углеводного обмена.
- •Патология углеводного обмена. Нарушение переваривания и всасывания углеводов.
- •Нарушение содержания уровня глюкозы в крови.
- •Нарушение тканевого обмена углеводов.
- •Обмен и функции липидов Спиртовой и жирнокислотный состав основных жиров тканей человека
- •Классификация жиров.
- •Глицеринсодержащие жиры
- •Глицерофосфолипиды (фл)
- •Сфингозинсодержащие жиры
- •Холестеринсодержащие жиры
- •Функции жиров
- •Структура и функции клеточных мембран
- •Переваривание жиров.
- •Всасывание продуктов расщепления жиров
- •Ресинтез жиров в слизистой тонкого кишечника
- •Особенности переваривания и всасывании жиров у детей
- •Транспорт жиров кровью
- •Обмен триацилглицеринов Распад триацилглицеринов в тканях (липолиз)
- •Окисление жирных кислот.
- •Химизм β - окисления насыщенных жирных кислот
- •Синтез триацилглицеролов
- •Обмен глицерофосфолипидов Синтез глицерофосфолипидов
- •Распад глицерофосфолипидов
- •Синтез сфинголипидов.
- •Распад сфинголипидов
- •Обмен холестерина
- •Биосинтез холестерина
- •Выделение холестерина из организма
- •Нарушение обмена холестерина
- •Взаимосвязь липидного и углеводного обменов
- •Ацетоновые тела.
- •Регуляция липидного обмена
- •Патология липидного обмена
- •Перекисное окисление липидов (пол)
- •Эйкозаноиды
- •Синтез эйкозаноидов.
- •Обмен белков
- •Переваривание белков
- •Всасывание аминокислот
- •Гниение белков в толстом кишечнике
- •Обезвреживание продуктов гниения белков в печени
- •Динамическое состояние белков в тканях организма
- •Катаболизм аминогруппп аминокислот. Трансаминирование аминокислот
- •Дезаминирование аминокислот
- •Окислительное дезаминирование
- •Катаболизм карбоксильных групп аминокислот. Декарбоксилирование аминокислот. Биогенные амины
- •Образование и обезвреживание аммиака в организме
- •Пути временного (экстренного) связывания аммиака в тканях Восстановительное аминирование альфа-кетокислот
- •Амидирование тканевых белков.
- •Синтез глютамина
- •Конечные продукты азотистого обмена Синтез аммонийных солей в почках
- •Биосинтез мочевины.
- •Обмен безазотистых радикалов аминокислот
- •Особенности обмена отдельных аминокислот Обмен глицина и серина.
- •Витамин Вс, в9, фолиевая кислота, антианемический витамин
- •Обмен серосодержащих аминокислот цистеина и метионина
- •Витамин в12, кобаламин, антианемический витамин
- •Нарушение обмена серосодержащих аминокислот
- •Обмен фенилаланина и тирозина
- •Регуляция белкового обмена
- •Патология белкового обмена
- •Обмен и функции нуклеиновых кислот
- •Дезоксирибонуклеиновая кислота
- •Распад пиримидиновых нуклеотидов
- •Синтез пуриновых нуклеотидов
- •Основной путь синтеза пуриновых нуклеотидов
- •Дополнительный путь синтеза пуриновых нуклеотидов
- •Синтез пиримидиновых нуклеотидов
- •Биосинтез днк
- •Биосинтез рнк (транскрипция)
- •Биосинтез белков – трансляция
- •Посттрансляционная модификация белков
- •Ингибиторы биосинтеза белка
- •Регуляция биосинтеза белка
- •Биохимия гормонов
- •Классификация гормонов по их химической природе
- •Обмен гормонов.
- •Механизмы действия гормонов.
- •Краткая характеристика гормонов.
- •Гормоны паращитовидных желез
- •Гормоны поджелудочной железы
- •Гормоны вилочкой железы
- •Гормоны щитовидной железы
- •Гормоны мозгового слоя надпочечников (катехоламины)
- •Гормоны эпифиза
- •Гормоны коры надпочечников
- •Глюкокортикоиды
- •Гормоны плаценты
- •Особенности гормонального статуса у детей
- •Биохимия крови
- •Биохимия эритроцитов.
- •Химический состав эритроцитов.
- •Особенности метаболизма в эритроцитах
- •Обмен гемопротеидов
- •Нарушения распада гема.
- •Химический состав плазмы крови
- •Белки плазмы крови
- •Изменение белкового состава крови при заболеваниях
- •Небелковые азотсодержащие вещества.
- •Кининовая система крови.
- •Безазотистые органические вещества крови
- •Минеральные вещества крови
- •Физико-химические свойства крови.
- •Нарушение кислотно-основного баланса.
- •Особенности кислотно-основного состояния у детей.
- •Дыхательная функция крови Транспорт кислорода
- •Нарушения транспорта кислорода
- •Транспорт со2.
- •Регуляция агрегатного состояния крови (раск) Свёртывающая система крови.
- •Плазменные факторы свёртывающей системы крови
- •Внутренний механизм ввертывания крови (контактный)
- •Внешний механизм свертывания крови (прокоагулянтный)
- •Детские особенности системы гемостаза
- •Нарушения гемостаза.
- •Водно–солевой обмен Водный обмен
- •Биологическая роль воды в организме.
- •Факторы движения воды в организме.
- •Обмен натрия и калия
- •Ренин-ангиотензивная система крови.
- •Особенности водного обмена у детей.
- •Кальций - фосфорный обмен
- •Регуляция кальций – фосфорного обмена.
- •Нарушение кальций – фосфорного обмена
- •Обмен железа.
- •Тканевая биохимия
- •Состав и обмен основного межклеточного вещества.
- •Обмен белков соединительной ткани. Обмен коллагена
- •Синтез коллагена.
- •Распад коллагена.
- •Азотистые экстрактивные вещества мышц.
- •Органические безазотистые вещества
- •Минеральные вещества
- •Химизм мышечного сокращения и расслабления.
- •Белки головного мозга
- •Азотистые небелковые вещества
- •Липиды головного мозга
- •Углеводы головного мозга
- •Минеральные вещества
- •Проведение нервного импульса
- •Передача нервного импульса
- •Антитоксическая функция
Структурная организация белков
Принято выделять четыре уровня структурной организации белков, которые обозначаются как первичная, вторичная, третичная и четвертичная структуры белков.
П

Впервые первичная структура изучена в 1954 году Сенджером для гормона инсулина. Изучение первичной структуры представляет сложный процесс и включает два основных этапа: изучение аминокислотного состава и изучение последовательности соединения аминокислот в полипептидной цепи.
Изучение аминокислотного состава белка осуществляется путём его гидролиза до аминокислот. Для разрыва прочных пептидных связей между аминокислотами используют кислотный, щелочной и ферментативный гидролиз белка. Кислотный гидролиз осуществляется кипячением раствора белка в течение 16-92 часов, при температуре 1100 с 6-нормальным раствором кислоты. Щелочной гидролиз производится кипячением раствора белка в течение 4 – 8 часов, при 1100 с 2-4 нормальным раствором NaOH. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и ферментативного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) отсутствие положительной биуретовой реакции на пептидные связи и б) окончание прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп определяют методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют методом хроматографического анализа, основанном на разных физико-химических свойствах аминокислот.
Исследование последовательности аминокислот в составе белка, в свою очередь, проводится различными методами. Белки с высокой молекулярной массой предварительно подвергаются частичному ферментативному гидролизу до коротких пептидов. Затем в полученных коротких пептидах определяются последовательно более доступные для исследования концевые аминокислоты, находящиеся или на N-конце, или на С-конце пептида.
С целью узнавания С - и N -концевых аминокислот применяются ферментативные методы. Ферменты аминопептидазы отщепляют от пептида N - концевую аминокислоту, которая определяется хроматографически Ферменты карбоксипептидазы, отщепляют от белка С - концевую аминокислоту.
![]()
Кроме ферментативных используются химические методы распознавания концевых аминокислот
А)
методы исследования N-
концевых аминокислот
заключаются в
присоединении к N
-концевой аминокислоте какой - то
«химической метки» связью, более прочной,
чем пептидная связь. При последующем
г
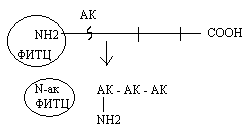
Б) Методы распознавания С - концевой аминокислоты.
Метод Акобори заключается в использовании фенилгидразина. Фенилгидразин разрывает пептидные связи в белке и присоединяется ко всем аминокислотам, кроме C-концевой. Последующий хроматографический анализ позволяет распознать С - концевую аминокислоту в составе белка.
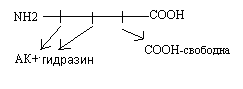
Исследование первичной структуры имеет важное общебиологическое и медицинское значение:
первичная структура является определяющей для последующих структур белка.
знание первичной структуры белка необходимо для искусственного синтеза белков.
первичная структура определяет видовую специфичность, например, в белке инсулине, обычно в середине молекулы у различных видов животных и человека происходит замена, как правило, 3-х равноценных аминокислот.
изменения в первичной структуре могут приводить ко многим болезням, например, к серповидно клеточной анемии, при которой в гемоглобине в β - цепи в 6 положении глютаминовая кислот заменяется на валин. Эта замена на неравноценную аминокислоту приводит к нарушению функции гемоглобина и появлению серповидной формы эритроцитов.
Вторичная структура - регулярно повторяющаяся форма укладки полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: α - спираль и β - структура.
α - спираль в 1951 году изучена Л. Полингом с помощью рентгеноструктурного метода. Она представляет собой правозакрученную спиральную структуру, в одном витке которой укладывается 3,6 аминокислоты. Шаг спирали (расстояние между соседними витками) составляет 0,54 н.м. α - спираль фиксируется водородными связями, которые замыкаются между пептидными связями, образованными каждой 4-ой аминокислотой. Вторичная α - структура укладывается самопроизвольно и определяется первичной структурой белка. Доля участков, уложенных в спиральную структуру, в различных белках различна. Например, в гемоглобине, миоглобине преобладает α - структурная укладка, которая в 4 раза уменьшает размеры белковой молекулы.
β –структура имеет вид «гармошки» и стабилизируется водородными связями между удалёнными участками одной полипептидной цепи или между несколькими белковыми молекулами. Выделяют параллельные β – структуры, в которых N и С-концы соответствуют друг другу, и антипараллельные структуры. Примером белков, преимущественно содержащих β – структуры, являются иммуноглобулины.
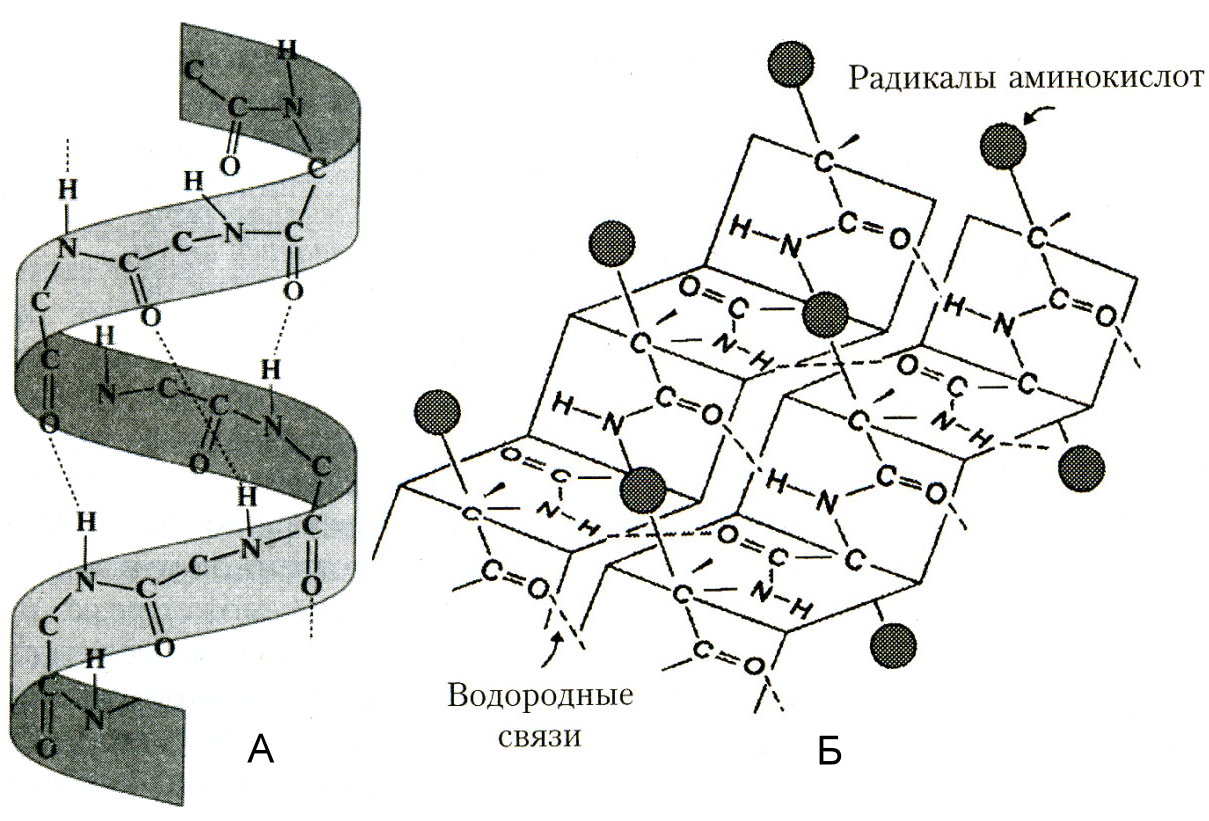
Вторичную структуру изучают методами рентгеноструктурного анализа, исследованием поглощения белком ультрафиолетовых лучей (чем больше доля α – структур, тем больше поглощение).
Вторичная структура разрушается при денатурации.
Третичная структура - специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные ( дисульфидные) связи.
Т
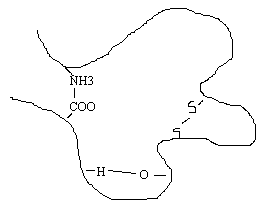
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической активности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят α - спиральные, β - складчатые структуры, β- петли (в них полипептидная цепь изгибается на 1800) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% α - спиральных участков, 6% β- складчатых структур, 10% молекулы уложены в виде β - петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно и её образование носит название фолдинг. Конформация белков очень неустойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
фибриллярные белки: коллаген, эластин, фиброин.
Глобулярные белки: гемоглобин, альбумин, глобулин.
Смешанные белки: миозин.
Третичная структура присуща всем белкам. Четвертичную структуру имеют только олигомерные белки, в составе которых имеется несколько субъединиц, протомеров. Протомером считается отдельная полипептидная цепь, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать или один протомер, или несколько.
Четвертичная структура - количество и взаимное расположение субъединиц в олигомерных белках. Четвертичную структуру имеют только олигомерные белки, в составе которых имеется несколько субъединиц, протомеров. Протомером считается отдельная полипептидная цепь, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать один протомер или несколько протомеров.
В формировании четвертичной структуры участвуют непрочные нековалентные связи (гидрофобные, ионные, водородные). Четвертичная структура белков формируются самопроизвольно и легко разрываются при денатурации. Отдельные субъединицы в олигомером белке взаимодействуют друг с другом, что приводит к изменению третичной структуры отдельных протомеров.. Это явление называется кооперативными изменениями конформации протомеров и сопровождается, как правило, повышением активности белка.
Олигомерные белки имеют ряд особенностей в сравнении с мономерными белками.
Имеют очень компактную укладку и относительно небольшая поверхность раздела, поэтому, располагаясь внутриклеточно, они связывают меньше воды
Активность их регулируется в организме. Протомеры, как правило, неактивны, а олигомерные белки значительно активнее.
Если в синтезе олигомерного белка участвуют однотипные протомеры, это экономит генетический материал (на коротком участке ДНК «штампуется» несколько одинаковых протомеров)
Они функционально более приспособлены для условий организма.
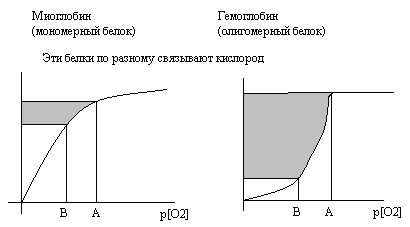
Функциональность олигомерных белков иллюстрируется при сравнении белков гемоглобина и миоглобина, участвующих в переносе кислорода в ткани. Гемоглобин эритроцитов - олигомерный белок, включает 4 полипептидные цепи. Миоглобин мышц – мономерный белок, включает 1 полипептидную цепь. Кривая насыщения кислородом у миоглобина свидетельствует о прямой зависимости её от концентрации кислорода. Для гемоглобина кривая насыщения кислородом носит S-образный характер. Это связано с постепенным последовательным изменением структуры (конформации) каждого из 4-х протомеров в составе гемоглобина, в результате которого резко возрастает сродство гемоглобина к кислороду. Такой характер насыщения гемоглобина кислородом резко повышает его кислородную ёмкость по сравнению с миоглобином.
Особое положение среди белков занимают доменные белки.
Домены – структурно и функционально обособленные участки одной полипептидной цепи. Домены могут отвечать за взаимодействие белка с различными веществами - лигандами (низкомолекулярные вещества, ДНК, РНК, полисахариды и др.) Примерами доменных белков служат альбумин сыворотки крови, иммуноглобулины, некоторые ферменты (трипсин поджелудочной железы).

В силу высокой избирательности белков они могут объединяться в комплексы, которые чаще всего называются полиферментные комплексы – это структурные объединения нескольких ферментов, катализирующих отдельные стадии сложного химического процесса. Пример: пируватдегидрогеназный комплекс (ПДК) комплекс трех видов ферментов, катализирующий окисление пировиноградной кислоты (ПВК).
Возможно специфическое соединение не только отдельных белков, но и белков с липидами (жирами) при образовании клеточных мембран, белков с нуклеиновыми кислотами при формировании хроматина.
Физико-химические свойства белков.
Физико- химические свойства белков во многом определяются конформацией белковой молекулы (первичная – третичная структура белка). Физико- химические свойства белков проявляются в растворах.
Растворимость белков у различных белков различна.
В целом растворимость белков высока, но различна для разных видов белков. На неё влияют следующие факторы:
форма белковой молекулы (глобулярные белки растворимы лучше, чем фибриллярные белки)
характер радикала аминокислоты белка, соотношение полярных неполярных радикалов (чем больше в составе белка полярных гидрофильных радикалов, тем лучше его растворимость)
свойства растворителя, присутствие солей. Невысокая концентрация солей (KCL, NaCl) иногда повышает растворимость белков. Например, альбумины лучше растворимы в чистой дистиллированной воде, глобулины растворяются только в присутствии 10% солей (KCL, NaCl). Белки соединительной ткани коллаген и эластин не растворимы ни в воде, ни в солевых растворах.
Молекулярная масса белков достаточно велика, находится в пределах от 6000 д. до 1000000 д. Например, молекулярная масса гемоглобина – 68000 д., альбумина - 100 000 д., рибонуклеазы – около 14 000 д., миозина – 500 000 д.
Методы определения молярной массы белков должны быть щадящими, не разрушать белковых молекул. Например, к белкам не применим эбулиоскопический метод, основанный на измерении температуры кипения растворов. Наиболее точными методами определения молекулярной массы белков являются метод ультрацентрифугирования и рентгеноструктурный метод.
Метод ультрацентрифугирования (седиментации) основан на изменении скорости осаждения белков различной молекулярной массы при вращении белковых растворов с большой скоростью. Молекулярная масса белков, найденная этим методом, обозначается единицей Сведберга (S=10-13c.)
Рентгеноструктурный метод позволяет рассчитать молекулярную массу путём анализа многочисленных рентгеновских снимков молекулы белка.
Электрофоретический метод основан на зависимости скорости передвижения белков в постоянном электрическом поле от молекулярной массы белка (электрофоретическая подвижность выше у белков с меньшей молекулярной массой)
Хроматографический метод основан на различной скорости прохождения различных белков через молекулярные гелевые «сита».

Крупные молекулы, превышающие размеры пор геля, проходят через гель быстрее, чем более мелкие молекулы белка, которые задерживаются внутри зёрен геля.
Электронномикроскопический метод проводится путём сравнения размеров белковой молекулы с эталонными образцами известной массы.
Химические методы связаны с особенностями химического состава белков
Форма белковых молекул различна. Белковые молекулы по форме могут быть фибриллярными и глобулярными. Фибриллярные белки имеют нитевидную форму молекулы. Они, как правило, не растворимы в воде и в разбавленных солевых растворах. К фибриллярным белкам относятся основные структурные белки соединительной ткани: коллаген, кератин, эластин. У глобулярных белков полипептидные цепи плотно свёрнуты в компактные сферические структуры. Большинство глобулярных белков хорошо растворяются в воде и слабых солевых растворах. К глобулярным белкам относятся ферменты, антитела, альбумины, гемоглобин. Некоторые белки имеют промежуточный вид молекулы, содержат в своём составе и нитевидные, и шаровидные участки. Примером таких белков служит белок мышц миозин, растворимый в солевых растворах.
Размеры белковых молекул находятся в интервале от 1 до 100 нм, близком к размерам коллоидных частиц. В силу этого белковые растворы обладают свойствами, как истинных растворов, так и коллоидных растворов.
Многие молекулярно- кинетические свойства белковых растворов сходны со свойствами коллоидных растворов.
Медленная скорость диффузии белков, необходимой для их обмена.
Н
евозможность прохождения белков через полупроницаемые мембраны. В отсеках с высокой концентрацией белка создаётся избыточное гидростатическое давление, обусловленное односторонним перемещением молекул воды через полупроницаемую мембрану в сторону высокой концентрации белка. Избыточное давление, создаваемое белками, называется онкотическим давлением. Оно является важным фактором, определяющим передвижение воды между тканями, кровью, кишечником.
Высокая вязкость белков обусловлена различными межмолекулярными взаимодействиями крупных белковых молекул. Повышенная вязкость крови, в частности, повышает нагрузку на сердечную мышцу.
. Некоторые белки способны образовывать гели, что увеличивает прочность белков (например, коллаген).
Оптические свойства белков определяются размерами белковых молекул, структурой радикалов аминокислот в белках, наличием пептидных связей и альфа-спиральных участков в белках.
Белковые растворы обладают эффектом светопреломления (рефракции) и светорассеивания. Эти свойства обусловлены большими размерами белковых молекул, соизмеримыми с длиной волны видимой части спектра.. При этом короткие синие лучи рассеиваются в большей степени, чем более длинноволновые красные лучи. Степень рефракции пропорциональна концентрации белкового раствора.
Белковые растворы поглощают ультрафиолетовые лучи в диапазоне 190-230 нм за счёт присутствия пептидных связей и в диапазоне 260-280 нм за счёт присутствия в белках циклических аминокислот. Степень поглощения УФЛ пропорциональна концентрации белка в растворе.
Белковые растворы способны вращать плоскость поляризованного света, что обусловлено оптической активностью содержащихся в белке аминокислот и наличием в нём альфа-спиральных участков. Существует прямая зависимость между поляризаций света и концентрацией белков в растворе.
Белки, являясь молекулярными растворами, обладают свойствами истинных растворов. Будучи истинными растворами, белковые растворы отличаются высокой устойчивостью.
