
- •Краткий курс лекций по биологической химии для студентов, обучающихся по специальности Педиатрия. Строение и функции белков
- •Химический состав белков Элементарный состав белков
- •Виды связей аминокислот в белках.
- •Структурная организация белков
- •Факторы устойчивости белковых растворов
- •Заряд белковой молекулы.
- •Формирование гидратной (водной) оболочки
- •Виды осадочных реакций белков из растворов
- •Методы количественного определения белков, используемые в лабораторной практике
- •Выделение, фракционирование и очистка белков
- •Классификация белков
- •Структура, свойства и механизм действия ферментов Краткая история ферментологии
- •Структура ферментов
- •Механизм действия ферментов.
- •Снижение ферментами энергии активации.
- •Увеличение ферментами стерического коэффициента.
- •Номенклатура ферментов
- •Классификация ферментов.
- •Трансферазы.
- •Гидролазы.
- •Синтетазы (лигазы).
- •Свойства ферментов.
- •Термолябильность ферментов.
- •Зависимость скорости ферментативной реакции от концентрации фермента и концентрации субстрата
- •Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
- •Механизм действия активаторов.
- •Регуляция активности ферментов в процессе метаболизма.
- •Структурная организация ферментов в клетке
- •Принципы обнаружения и количественного определения ферментов:
- •Количественное определение ферментов
- •Единицы активности (количества) фермента
- •Клиническая ферментология
- •Биологическое окисление
- •Краткая история учения о биологическом окислении
- •Дегидрогеназы
- •Никотинамидзависимые дегидрогеназы
- •Флавопротеиды – флавиновые дегидрогеназы
- •Убихинон (КоQ)
- •Цитохромы
- •Оксигеназы
- •Пероксидазы
- •Внутримитохондриальное окисление. Окислительное фосфорилирование.
- •Длинная дыхательная цепь.
- •Короткая дыхательная цепь.
- •Энергетический обмен
- •Окислительное фосфолирирование
- •Регуляция окислительного фосфолирирования.
- •Нарушение энергетического обмена.
- •Окисление с участием оксидаз.
- •Окисление с участием оксигеназ.
- •Пероксидазное окисление.
- •Общие пути катаболизма
- •С хема общих путей катаболизма. Окислительное декарбоксилирование пировиноградной кислоты
- •Липоевая кислота
- •Пантотеновая кислота
- •Цикл трикарбоновых кислот (цикл Кребса)
- •Химизм цикла Кребса (цикла трикарбоновых кислот)
- •Биологическое значение цикла Кребса
- •Регуляция активности цтк
- •Обмен и функции углеводов
- •Олигосахариды
- •Гетерополисахариды
- •Переваривание углеводов
- •Обмен гликогена
- •Распад гликогена
- •Обмен глюкозы в тканях Окисление глюкозы в тканях.
- •Анаэробное окисление глюкозы
- •Аэробное окисление глюкозы.
- •Биосинтез глюкозы. Глюконеогенез.
- •Витамин н, биотин, антисеборейный витамин
- •Пентозофосфатный путь окисления глюкозы.
- •Утилизация фруктозы.
- •Взаимные превращения углеводов (гексоз)
- •Особенности обмена глюкозы в различных тканях
- •Регуляция углеводного обмена.
- •Патология углеводного обмена. Нарушение переваривания и всасывания углеводов.
- •Нарушение содержания уровня глюкозы в крови.
- •Нарушение тканевого обмена углеводов.
- •Обмен и функции липидов Спиртовой и жирнокислотный состав основных жиров тканей человека
- •Классификация жиров.
- •Глицеринсодержащие жиры
- •Глицерофосфолипиды (фл)
- •Сфингозинсодержащие жиры
- •Холестеринсодержащие жиры
- •Функции жиров
- •Структура и функции клеточных мембран
- •Переваривание жиров.
- •Всасывание продуктов расщепления жиров
- •Ресинтез жиров в слизистой тонкого кишечника
- •Особенности переваривания и всасывании жиров у детей
- •Транспорт жиров кровью
- •Обмен триацилглицеринов Распад триацилглицеринов в тканях (липолиз)
- •Окисление жирных кислот.
- •Химизм β - окисления насыщенных жирных кислот
- •Синтез триацилглицеролов
- •Обмен глицерофосфолипидов Синтез глицерофосфолипидов
- •Распад глицерофосфолипидов
- •Синтез сфинголипидов.
- •Распад сфинголипидов
- •Обмен холестерина
- •Биосинтез холестерина
- •Выделение холестерина из организма
- •Нарушение обмена холестерина
- •Взаимосвязь липидного и углеводного обменов
- •Ацетоновые тела.
- •Регуляция липидного обмена
- •Патология липидного обмена
- •Перекисное окисление липидов (пол)
- •Эйкозаноиды
- •Синтез эйкозаноидов.
- •Обмен белков
- •Переваривание белков
- •Всасывание аминокислот
- •Гниение белков в толстом кишечнике
- •Обезвреживание продуктов гниения белков в печени
- •Динамическое состояние белков в тканях организма
- •Катаболизм аминогруппп аминокислот. Трансаминирование аминокислот
- •Дезаминирование аминокислот
- •Окислительное дезаминирование
- •Катаболизм карбоксильных групп аминокислот. Декарбоксилирование аминокислот. Биогенные амины
- •Образование и обезвреживание аммиака в организме
- •Пути временного (экстренного) связывания аммиака в тканях Восстановительное аминирование альфа-кетокислот
- •Амидирование тканевых белков.
- •Синтез глютамина
- •Конечные продукты азотистого обмена Синтез аммонийных солей в почках
- •Биосинтез мочевины.
- •Обмен безазотистых радикалов аминокислот
- •Особенности обмена отдельных аминокислот Обмен глицина и серина.
- •Витамин Вс, в9, фолиевая кислота, антианемический витамин
- •Обмен серосодержащих аминокислот цистеина и метионина
- •Витамин в12, кобаламин, антианемический витамин
- •Нарушение обмена серосодержащих аминокислот
- •Обмен фенилаланина и тирозина
- •Регуляция белкового обмена
- •Патология белкового обмена
- •Обмен и функции нуклеиновых кислот
- •Дезоксирибонуклеиновая кислота
- •Распад пиримидиновых нуклеотидов
- •Синтез пуриновых нуклеотидов
- •Основной путь синтеза пуриновых нуклеотидов
- •Дополнительный путь синтеза пуриновых нуклеотидов
- •Синтез пиримидиновых нуклеотидов
- •Биосинтез днк
- •Биосинтез рнк (транскрипция)
- •Биосинтез белков – трансляция
- •Посттрансляционная модификация белков
- •Ингибиторы биосинтеза белка
- •Регуляция биосинтеза белка
- •Биохимия гормонов
- •Классификация гормонов по их химической природе
- •Обмен гормонов.
- •Механизмы действия гормонов.
- •Краткая характеристика гормонов.
- •Гормоны паращитовидных желез
- •Гормоны поджелудочной железы
- •Гормоны вилочкой железы
- •Гормоны щитовидной железы
- •Гормоны мозгового слоя надпочечников (катехоламины)
- •Гормоны эпифиза
- •Гормоны коры надпочечников
- •Глюкокортикоиды
- •Гормоны плаценты
- •Особенности гормонального статуса у детей
- •Биохимия крови
- •Биохимия эритроцитов.
- •Химический состав эритроцитов.
- •Особенности метаболизма в эритроцитах
- •Обмен гемопротеидов
- •Нарушения распада гема.
- •Химический состав плазмы крови
- •Белки плазмы крови
- •Изменение белкового состава крови при заболеваниях
- •Небелковые азотсодержащие вещества.
- •Кининовая система крови.
- •Безазотистые органические вещества крови
- •Минеральные вещества крови
- •Физико-химические свойства крови.
- •Нарушение кислотно-основного баланса.
- •Особенности кислотно-основного состояния у детей.
- •Дыхательная функция крови Транспорт кислорода
- •Нарушения транспорта кислорода
- •Транспорт со2.
- •Регуляция агрегатного состояния крови (раск) Свёртывающая система крови.
- •Плазменные факторы свёртывающей системы крови
- •Внутренний механизм ввертывания крови (контактный)
- •Внешний механизм свертывания крови (прокоагулянтный)
- •Детские особенности системы гемостаза
- •Нарушения гемостаза.
- •Водно–солевой обмен Водный обмен
- •Биологическая роль воды в организме.
- •Факторы движения воды в организме.
- •Обмен натрия и калия
- •Ренин-ангиотензивная система крови.
- •Особенности водного обмена у детей.
- •Кальций - фосфорный обмен
- •Регуляция кальций – фосфорного обмена.
- •Нарушение кальций – фосфорного обмена
- •Обмен железа.
- •Тканевая биохимия
- •Состав и обмен основного межклеточного вещества.
- •Обмен белков соединительной ткани. Обмен коллагена
- •Синтез коллагена.
- •Распад коллагена.
- •Азотистые экстрактивные вещества мышц.
- •Органические безазотистые вещества
- •Минеральные вещества
- •Химизм мышечного сокращения и расслабления.
- •Белки головного мозга
- •Азотистые небелковые вещества
- •Липиды головного мозга
- •Углеводы головного мозга
- •Минеральные вещества
- •Проведение нервного импульса
- •Передача нервного импульса
- •Антитоксическая функция
Зависимость скорости ферментативных реакций от присутствия активаторов и ингибиторов.
Активаторы – вещества, повышающие скорость ферментативных реакций. Различают специфические активаторы, повышающие активность одного фермента (НСl - активатор пепсиногена) и неспецифические активаторы, увеличивающие активность целого ряда ферментов (ионы Mg – активаторы гексокиназы, К, Na –АТФ-азы и других ферментов). В качестве активаторов могут служить ионы металлов, метаболиты, нуклеотиды.
Механизм действия активаторов.
Достраивание активного центра фермента, в результате чего облегчается взаимодействие фермента с субстратом. Таким механизмом обладают в основном ионы металлов.
Аллостерический активатор взаимодействует с аллостерическим участком (субъединицей) фермента, через его изменения опосредованно изменяет структуру активного центра и увеличивает активность фермента. Аллостерическим эффектом обладают метаболиты ферментативных реакций, АТФ.
Аллостерический механизм может сочетаться с изменением олигомерности фермента. Под действием активатора происходит объединение нескольких субъединиц в олигомерную форму, что резко увеличивает активность фермента. Например, изоцитрат является активатором фермента ацетил-КоА карбоксилазы.
Фосфолирирование - дефосфолирирование ферментов относится к обратимой модификации ферментов. Присоединение Н3РО4 чаще всего резко увеличивает активность фермента. Например, два неактивных димера фермента фосфорилазы соединяются с четырьмя молекулами АТФ и образуют активную тетрамерную фосфорилированную форму фермента. Фосфолирирование ферментов может сочетаться с изменением их олигомерности. В некоторых случаях фосфорилирование фермента, наоборот, снижает его активность (например, фосфорилирование фермента гликогенсинтетазы)
Частичный протеолиз (необратимая модификация). При этом механизме от неактивной формы фермента (профермента) отщепляется фрагмент молекулы, блокирующий активный центр фермента. Например, неактивный пепсиноген под действием HCL переходит в активный пепсин.
Ингибиторы – вещества, понижающие активность фермента.
По специфичности выделяют специфичные и неспецифичные ингибиторы
По обратимости эффекта различают обратимые и необратимые ингибиторы.
По месту действия встречаются ингибиторы, действующие на активный центр и вне активного центра.
По механизму действия различают на конкурентные и неконкурентные ингибиторы.
Конкурентное ингибирование.
Ингибиторы этого типа имеют структуру, близкую к структуре субстрата. В силу этого ингибиторы и субстрат конкурируют за связывание активного центра фермента. Конкурентное ингибирование - это обратимое ингибирование Эффект конкурентного ингибитора может быть уменьшен путём повышения концентрации субстрата реакции
![]()
Примером конкурентного ингибирования может служить угнетение активности сукцинатдегидрогеназы, катализирующей окисление дикарбоновой янтарной кислоты, дикарбоновой малоновой кислотой, сходной по структуре с янтарной кислотой.
Принцип конкурентного ингибирования широко используется при создании лекарственных средств. Например, сульфаниламидные препараты имеют структуру, близкую к структуре парааминобензойной кислоты, необходимой для роста микроорганизмов. Сульфаниламиды блокируют ферменты микроорганизмов, необходимые для усвоения парааминобензойной кислоты. Некоторые противоопухолевые препараты являются аналогами азотистых оснований и, тем самым, ингибируют синтез нуклеиновых кислот (фторурацил).
Графически конкурентное ингибирование имеет вид:
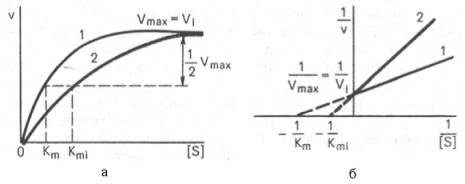
Неконкурентное ингибирование.
Неконкурентные ингибиторы структурно не имеют схожести с субстратами реакций и поэтому не могут вытесняться при высокой концентрации субстрата. Существует несколько вариантов действия неконкурентных ингибиторов:
Блокирование функциональной группы активного центра фермента и, вследствие этого, уменьшение активности. Например, активность SН - групп могут связывать тиоловые яды обратимо (соли металлов, ртути, свинца) и необратимо (монойодацетат). Эффект ингибирования тиоловых ингибиторов может быть уменьшен введением добавочных веществ, богатых SH группами (например, унитиол). Встречаются и используются сериновые ингибиторы, блокирующие ОН - группы активного центра ферментов. Таким эффектом обладают органические фосфофторсодержащие вещества. Эти вещества могут, в частности, ингибировать ОН - группы в ферменте ацетилхолинэстеразе, разрушающей нейромедиатор ацетилхолин.
Блокирование ионов металлов, входящих в состав активного центра ферментов. Например, цианиды блокируют атомы железа, ЭДТА (этилендиаминтетраацетат) блокирует ионы Са, Mg.
Аллостерический ингибитор взаимодействует с аллостерическим участком, опосредованно через него по принципу кооперативности, меняя структуру и активность каталитического участка. Графически неконкурентное ингибирование имеет вид:
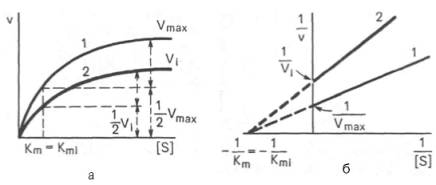
Максимальная скорость реакции при неконкурентном ингибировании не может быть достигнута путём повышения концентрации субстрата.
