
- •6.3. Криосорбционные насосы 102
- •7. Системы подачи жидкости к потребителю 106
- •Предисловие
- •Введение
- •Основные этапы развития криогенной техники
- •Области использования криогенных сред
- •1Ракетно-космическая техника
- •2Авиационная техника
- •3Физика высоких энергий и энергетика
- •4Электроника
- •5Машиностроение
- •7Металлургия
- •8Криобиология и криомедицина
- •9Пищевая промышленность
- •10Повторное использование материалов
- •Свойства криогенных сред
- •3.1 Теплофизические свойства криогенных сред
- •4. Конструкционные материалы в криогенной технике
- •4.1 Теплофизические свойства материалов
- •4.2 Механические свойства материалов при криогенных температурах
- •4.3 Электрические свойства материалов при криогенных температурах
- •4.4 Явление сверхпроводимости
- •5. Криогенная тепловая изоляция
- •5.1 Пассивная изоляция
- •5.1.1 Газонаполненная теплоизоляция
- •5.1.1.1 Порошковая и волокнистая газонаполненная изоляция
- •5.1.2 Вакуумированная теплоизоляция
- •5.1.2.1 Порошково-вакуумная изоляция
- •5.1.2.2 Экранно-(слоисто-)вакуумная изоляция
- •5.2 Активная изоляция
- •Активная теплоизоляция «Бурана»
- •5.3 Показатели эффективности изоляции
- •5.4 Тепловые мосты
- •5.4.1 Расчет теплопритоков через термомосты
- •6. Особенности конструкций емкостей и баков для хранения криогенных жидкостей
- •6.1 Конструктивные схемы крупных хранилищ
- •6.2 Транспортные сосуды
- •6.2.1 Гелиевые резервуары
- •6.3. Криосорбционные насосы
- •6.4 Особенности измерения давления в емкости
- •7. Системы подачи жидкости к потребителю
- •Система наддува емкостей:
- •Система выдачи криожидкости.
- •Конструктивная схема баков для хранения криожидкостей
- •Способы крепления сосудов.
- •Способы крепления магистралей.
- •7.1 Особенности конструкций криогенных магистралей
- •Тепловые мосты;
- •Состав магистрали двигательной установки.
- •7.1.1 Трубопроводы
- •7.1.2 Температурные компенсаторы
- •7.1.3 Запорно-регулирующая арматура
- •7.1.3.1 Материалы, используемые при изготовлении уплотнений
- •7.1.3.2 Гидравлические потери
- •7.1.4 Фильтры
- •9.1.5 Насосы в криогенной технике
- •Лопаточные насосы
- •Электрогидродинамические насосы
- •7.2 Особенности течения криогенных жидкостей в трубах
- •7.3 Особенности течения криогенной жидкости с насосной системой подачи
- •7.4 Изменение параметров по длине расходных магистралей
- •118. Особенности эксплуатации криогенных систем
- •8.1 Особенности эксплуатации водородных систем
- •8.2 Процессы захолаживания криогенных систем
- •8.3 Способы захолаживания магистралей и баКов
- •Захолаживание жидкостью.
- •Захолаживание газом
- •Захолаживание паром.
- •Захолаживание с использованием циркуляционных систем.
- •8.4 Особенности течения двухфазных сред
- •9. Теплообмен при захолаживании криогенных систем
- •9.1 Структура парожидкостных потоков при захолаживании магистрали
- •9.1.1 Пленочное кипение
- •9.1.2 Пузырьковое кипение
- •9.3 Структура потока по длине магистрали при захолживании
- •Структура потока в магистрали.
- •9.3.1 Режимы течения парожидкостного потока при пузырьковом и переходном режимах пузырькового кипения.
- •9.4 Особенности захолаживания двигательных магистралей разгонных блоков
- •9.5 Интенсификация процессов захолаживания магистрали
- •9.6 Особенности захолаживания емкостей и баков
- •Способы захолаживания
- •Наполнение бака через магистраль заправки
- •Подача жидкости через верхнюю обечайку бака
- •10.7 Процессы в емкостях при хранении криогенных продуктов
- •10.8 Расчет процессов захолаживания
- •Оценка времени захолаживания при полном усвоении энтальпии потока
- •Захолаживание длинных магистралей
- •Захолаживание систем при конечных значениях коэффициента теплоотдачи
- •10. Охлаждение криогенных жидкостей
- •11 Системы термостатирования, охлаждения и ожижения
- •12. Охлаждение газа
- •12.1 Адиабатное расширение газа с совершением внешней работы
- •12.2 Использование эффекта Джоуля-Томпсона
- •13 Циклы криоожижителей и криорефрижераторов
- •13.1 Использование идеального обратимого цикла Карно для холодильной машины
- •13.2 Цикл Линде-Хэмпсона с простым дросселированием
- •13.3 Ожижение водорода простым методом дросселирования. Получение параводорода
- •13.4 Ожижитель Клода
- •13.5 Цикл Капицы
- •13.6 Обратный цикл Стирлинга
- •Литература
Свойства криогенных сред
Жидкий азот представляет собой прозрачную бесцветную жидкость, напоминающую по виду воду, инертен, не токсичен, не поддерживает горения, не обладает магнитными свойствами, не имеет электропроводности. При стандартном атмосферном давлении (101.3 кПа) температура насыщения жидкого азота - 77.36 К. Давление упругости пара в тройной точке равно 12.5 кПа, а температура - 63.2 К. В отличие, от воды твёрдый азот ("лед") тяжелее жидкости.
При температуре насыщения 77.36 К жидкий азот имеет плотность 807 кг/м3. Поскольку азот является главной составляющей воздуха (78.08% по объему или 75.45% по весу), он получается в промышленных масштабах путем конденсации и разделения жидкого воздуха.
Жидкий кислород имеет характерный светло-голубой цвет, обусловленный присутствием полимерной или сгруппированной в длинную цепочку молекулы О4. При стандартном давлении жидкий кислород имеет температуру насыщения 90.18 К. Давление упругости пара в тройной точке равно 0.12 кПа, а температура - 54.4 К ("лед" тяжелее жидкости).
Кислород обладает слабыми магнитными свойствами (парамагнетик) в отличие от других криожидкостей, которые немагнитны. Путем измерения магнитной чувствительности даже небольшие количества кислорода могут быть обнаружены в смесях других газов.
При концентрации более 60% кислород токсичен при дыхании. Чистый кислород может использоваться для дыхания при уменьшенных давлениях. Благодаря высокой химической активности кислорода (сильный окислитель) при обращении с ним следует применять определенные меры безопасности. Имели место взрывы смесей кислорода с углеводородными смазочными материалами.
Кислород в больших количествах получается путем ожижения жидкого воздуха, поскольку он является второй по количеству составляющей воздуха (20.95% по объему или 23.2% по весу), а также при диализе воды.
Жидкий аргон — прозрачная бесцветная жидкость со свойствами, похожими на свойства жидкого азота. Он нетоксичен, инертен, не поддерживает горения, не обладает магнитными свойствами, неэлектропроводен.
При стандартном давлении жидкий аргон имеет температуру насыщения 87.3 К. Давление упругости пара в тройной точке равно 68.7 кПа, а температура - 83.8 К ("лед" тяжелее жидкости). Из-за большего молекулярного веса аргона чем у азота жидкий аргон при 87.3 К имеет более высокую плотность - 1394 кг/м3. Различие между температурой насыщения при нормальном давлении и тройной точкой для аргона всего 3.5 К.
Концентрация аргона в атмосферном воздухе составляет 0.934% по объему или 1.25% по массе.
Так как точка кипения аргона лежит между температурами насыщения жидкого кислорода и жидкого азота (немного ближе к температуре насыщения жидкого кислорода), аргон грубой очистки (с чистотой 90…95%) может быть получен добавлением в систему разделения воздуха дополнительной аргоно-разделительной колонны.
Жидкий неон — прозрачная бесцветная жидкость. Он нетоксичен, инертен, не поддерживает горения, не обладает магнитными свойствами, неэлектропроводен.
При стандартном давлении жидкий неон имеет температуру насыщения 27.09 К. Давление упругости пара в тройной точке равно 43.3 кПа, а температура - 24.54 К ("лед" тяжелее жидкости).
Неон получается как побочный продукт работы воздухоразделительной установки.
Жидкий фтор — светло-желтая жидкость, имеющая температуру насыщения 85.24 К при стандартном давлении. Давление упругости пара в тройной точке равно 0.0025 кПа, а температура - 53.5 К ("лед" тяжелее жидкости).
Твердое вещество обладает желтым цветом, однако при дальнейшем охлаждении до 45.6 К цвет его переходит в белый. Жидкий фтор является одной из наиболее плотных криожидкостей (плотность при 85.24 К - 1507 кг/м3).
Фтор как химическое вещество характеризуется исключительной химической активностью (сильный окислитель). Фтор вступает в реакцию с почти всеми неорганическими веществами. Если фтор вступает в контакт с углеводородами, происходит его самовоспламенение с большой теплотой реакции, которой иногда бывает достаточно, чтобы загорелся металлический контейнер с фтором. В системах, содержащих фтор, используются такие материалы, как низкоуглеродистая нержавеющая сталь и монель, создающую защитную поверхностную пленку при контакте с газообразным фтором. Эта поверхностная пленка предотвращает распространение реакции между фтором и металлом в объем металла.
Фтор чрезвычайно токсичен. Предельная смертельная концентрация для животных составляет 200%/час. Это значит, что при часовом действии концентрация фтора равная 200 частиц на миллион является смертельной. Присутствие фтора в воздухе может быть обнаружено по его острому едкому запаху при концентрациях от 1 до 3%/час. В связи с чрезвычайной токсичностью жидкий фтор не нашел широкого применения.
Получают фтор методом электролиза расплава гидрофторида калия.
Жидкий метан представляет прозрачную бесцветную жидкость, которая имеет температуру насыщения при стандартном давлении - 111.7 К. Давление упругости пара в тройной точке равно 11.72 кПа, а температура - 88.7 К ("лед" тяжелее жидкости). Плотность жидкого метана при температуре 111.7 К примерно в два раза меньше плотности азота - 424.1 кг/м3.
Метан образует взрывоопасные смеси с воздухом при концентрациях в пределах от 13.3 до 58% по объему.
Метан является основным компонентом природного газа. Перевозка жидкого метана в больших количествах осуществляется в специальных танкерах.
Жидкий водород представляет прозрачную легкоподвижную жидкость. Она не имеет запаха и цвета и не проводит электрический ток. Температура насыщения водорода при стандартном давлении - 20.39 К. Давление упругости пара водорода в тройной точке равно 7.4 кПа, а температура – 13.95 К ("лед" тяжелее жидкости).
Плотность жидкого водорода при стандартном давлении всего 70.98 кг/м3.
Водород не поддерживает горение. Однако в смеси с кислородом или воздухом водород легко воспламеняется. Водородно-воздушная смесь в условиях неограниченного объема взрывоопасна в диапазоне концентраций от 18 до 59% водорода по объему.
Природный водород представляет смесь двух изотопов: обычный водород (атомная масса 1) и дейтерий (атомная масса 2). Водород двухатомный газ и состоит из молекул Н2 и HD (дейтеро-водород) в соотношении 3200:1. Существует третий неустойчивый изотоп водорода — тритий, однако он очень редко встречается в природе из-за его радиоактивности и короткого периода полураспада.
Одним из свойств водорода является аллотропия. Аллотропия свойство простых веществ существовать в виде нескольких форм. Водород может существовать в двух различных формах: орто - водород (о-H2) и пара - водород (р-Н2). Смесь этих двух модификаций молекул водорода при температуре 300 К называется нормальным водородом, который содержит 75% орто - водорода и 25% пара - водорода по объему. Равновесная смесь о-H2 и р-Н2 при любой заданной температуре называется равновесным водородом. При температуре насыщения водорода 20.3 К равновесный водород имеет состав 0.2 % о-H2 и 99.80 % р-Н2. Можно считать, что это практически чистый пара - водород.
Существование двух модификаций молекул водорода связано с различной ориентацией ядерных спинов атомов составляющих молекулу водорода. Молекула водорода состоит из двух протонов и двух электронов.
Водород называется орто - водородом, когда спины ядер направлены в одну сторону, векторы угловых моментов протонов имеют общее направление (а). Водород называется пара - водородом, когда ядра имеют противоположные спины, векторы угловых моментов направлены противоположно (б).



Рисунок 5 – Аллотропные свойства водорода
(a – орто - водород, b – пара - водород)
При уменьшении температуры происходит превращение о-Н2 в р-Н2. На рисунке 6 представлена равновесная кривая орто-пара-состава водорода от температуры.

Рисунок 6 - Равновесная кривая орто-пара-состава водорода от температуры
Это превращение не является мгновенным, так как оно связано с энергетическим обменом посредством молекулярных магнитных взаимодействий. В процессе перехода первоначальные молекулы о-Н2 переходят на более низкий молекулярно-энергетический уровень. Таким образом, конверсионный переход о-Н2 в р-Н2 сопровождается выделением энергии, называемой теплотой конверсии. Теплота конверсии связана с изменением момента ядер водорода при изменении направления их спина. Эта энергия выделяется при экзотермической реакции, и значение её больше, чем теплота испарения жидкого водорода. Теплофизические свойства пара - и орто - водорода отличаются, так как обладают различным количеством вращательной энергии. Так теплопроводность пара - водорода выше, чем у нормального водорода. Однако различие теплофизических свойств незначительно.
При ожижении водорода жидкость имеет практически тот же состав, что и при комнатной температуре, если не принимать специальных мер по ускорению процесса конверсии. Если не претерпевший конверсию водород помещен в сосуд для хранения, то внутри сосуда будет происходить выделение теплоты конверсии, и испаряемость жидкости значительно превысит значение, вычисленное по обычным теплопритокам через изоляцию сосуда. Отметим, что теплота конверсии при температуре насыщения при нормальном давлении составляет 670 кДж/кг, а теплота парообразования – 443 кДж/кг. Энергия процесса конверсии достаточна для испарения примерно 1% хранимой жидкости в час, таким образом, реакция неизбежно приведет к испарению большего количества жидкости. До 60% жидкого водорода после ожижения нормального водорода испаряется при хранении в течение 16 суток. Для ускорения процесса конверсии применяют катализаторы, которые обеспечивают тепловыделение при конверсии во время ожижения до того, как жидкость будет залита в сосуд хранения.
Свойства водорода значительно отличаются от свойств других криогенных сред. Малая плотность газа обуславливает высокую скорость теплового движения молекул, поэтому теплопроводность водорода примерно в 7 раз больше, чем у воздуха. Велика и скорость диффузии. Водород легко поглощается металлами, особенно при высоких температурах; при этом качество металлов ухудшается. Теплота испарения водорода примерно в 5…7 раз больше, чем у азота и кислорода.
Твёрдый водород:
![]() ;
;
![]() ;
;
![]() .
.
Твёрдый водород используется для зарядки топливных баков спутников.
Водород получают из попутного газа или при диализе воды.
Жидкий гелий. Гелий получают из природного газа. Промышленные концентрации гелия в природном газе от 0.005% до 0.3 %. Гелий имеет два стабильных изотопа: Не3 и Не4. Не4 имеет наибольшее распространение в природе. Его образование связано с радиоактивным распадом в земле тяжелых химических элементов, таких как уран. Плотность гелия невелика, теплоемкость весьма значительна. Газообразный Не4 имеет высокую теплопроводность и является хорошим теплоносителем, он нейтрален и не поддерживает горение.
Обычный газообразный гелий содержит около 1.3…10-4 % Не3, и поэтому, когда говорят о гелии или жидком гелии, подразумевают Не4, если это не оговорено особо.
Жидкий гелий Не4 представляет прозрачную легкоподвижную бесцветную не проводящую электричество жидкость, не имеющая запаха и цвета, которая имеет температуру насыщения при стандартном давлении - 4.214 К. Жидкий гелий не имеет точки затвердения при стандартном давлении. Фактически жидкий гелий не затвердевает под давлением собственных паров, даже если температура снижается до абсолютного нуля. Для затвердевания жидкого гелия при абсолютном нуле необходимо его сжать до давления 2529.8 кПа. При параметрах выше критических (Рcr=2275 кПа, Тcr=5.2014 К) гелий существует в виде газа.
Жидкий Не4 имеет при температуре 4.214 К плотность равную 124.8 кг/м3, что в восемь раз меньше плотности воды. Жидкий Не4 имеет показатель преломления, близкий к показателю преломления газообразного Не4. Теплота испарения при температуре 4.214 К жидкого Не4 равна 20.90 кДж/кг, что примерно в 110 раз меньше теплоты испарения воды.
Как уже отмечалось, жидкий Не4 не затвердевает под давлением собственных паров, поэтому для гелия нет тройной точки равновесия твердое тело - жидкость - пар, как для других веществ.
Существуют два различных состояния жидкого гелия: жидкий гелий-I (гелийI) - нормальная жидкость и жидкий гелий-II (гелийII) - сверхтекучая жидкость. Кривая, разделяющая два фазовых состояния, названа λ- линией (лямбда – линией), а точка пересечения с кривой равновесия пар — жидкость названа λ-точкой (лямбда – точкой). λ-точка соответствует температуре 2.17 К и давлению 5.039 кПа. Гелиевый лёд имеет уникальную особенность - он может только плавиться, но не испаряться в отличие от других жидкостей.
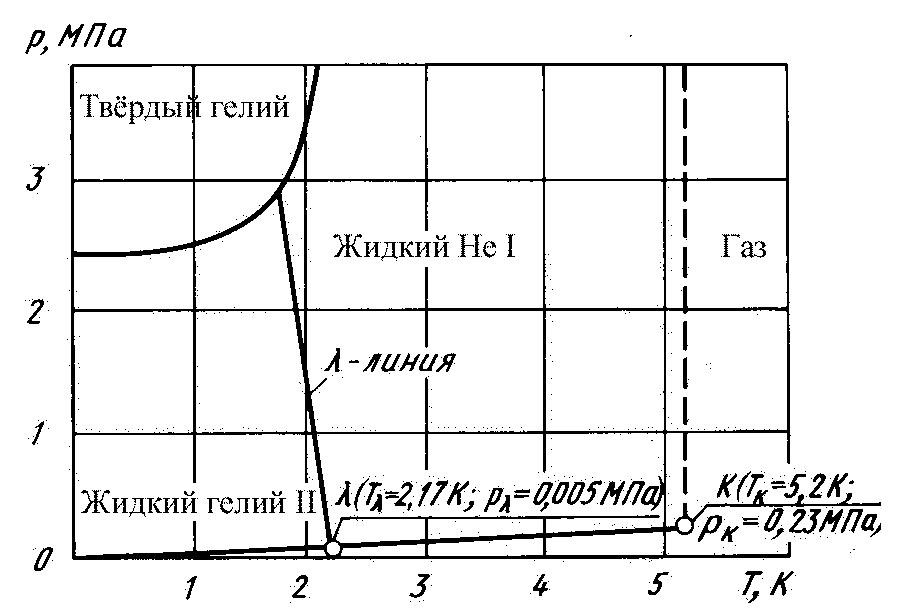
Рисунок 7 – Фазовая диаграмма Не4 в координатах p-T
Поведение теплоемкости жидкого гелия сильно отличается от поведения теплоемкости других жидкостей, поэтому следует ожидать, что и другие теплофизические и транспортные свойства также отличаются. На рисунке 8 представлена кривая изменения теплоёмкости жидкого гелия от температуры.

Рисунок 8 - Изменение теплоёмкости Не4 от температуры
Отмечается необычное поведение теплоёмкости гелия вблизи λ-точки. В этой точке теплоемкость жидкости неограниченно увеличивается при снижении температуры и при переходе через эту точку. Это явление связано с наличием необычного свойства жидкого гелия-II – сверхтекучести. Это означает, что в определенных условиях он ведет себя так, как если бы имел нулевую вязкость. Для объяснения поведения жидкого гелия-II было сделано предположение (Ландау, 1941 г.), что жидкость состоит из двух различных жидкостей: обычной и сверхтекучей, которая обладает нулевой энтропией и может двигаться через другие жидкости и твердые преграды с нулевым трением. Если принять эту модель, то жидкий гелий-II состоит из смеси нормального (n) и сверхтекучего компонентов (s), пропорции которых меняются с температурой.
При исследовании жидкого гелия были обнаружены необычные физические явления, связанные с наличием сверхтекучести.
При уменьшении давления жидкости происходит её интенсивное кипение, зависящее от скорости откачки. Во время откачки температура жидкости уменьшается с уменьшением давления при испарении жидкости. Когда температура достигает λ-точки и происходит переход к гелию-II, процесс парообразования неожиданно прекращается. Жидкость становится прозрачной и спокойной, хотя на зеркале жидкости продолжается интенсивное испарение гелия. Паровые пузырьки не возникают на теплоотдающей поверхности из за огромной способности жидкого гелия-II отводить тепло от теплоотдающей поверхности. Подвод теплоты к жидкому гелия-II увеличивает локальную температуру в окрестности зоны подвода теплоты, что повышает концентрацию п - компоненты и снижает концентрацию s - компоненты. Сверхтекучая жидкость (s-компонента) вследствие этого движется по направлению к зоне перегрева жидкости, при отсутствии реального макроскопического течения в гелии. Это и приводит к увеличению теплопроводности гелия. На рисунке 9 представлена кривая изменения теплопроводности жидкого гелия от температуры. Теплопроводность гелия-I падает с уменьшением температуры, что аналогично поведению других газов. Жидкий гелий-I имеет теплопроводность примерно 24 мВт/(м·К) при 3.3 К, в то время как кажущаяся теплопроводность в жидком гелия-II составляет 100 кВт/(м·К). Она значительно выше теплопроводности чистой меди и серебра. Теплопроводность гелия-II зависит не только от температуры, но и от величины градиента температуры в зоне измерения.
Следовательно, можно констатировать, что высокая теплопроводность гелия-II на самом деле обусловлена не собственно проводимостью жидкости, а интенсивным процессом кажущейся конвекции.

Рисунок 9 – Теплопроводность Не I и кажущаяся теплопроводность Не II Не4 от температуры Т и градиента температуры
Обычно вязкость и теплопроводность жидкости пропорциональны между собой. Для гелия–II наоборот вязкость падает, а теплопроводность колоссально возрастает.
Существующая аномалия физических свойств гелия-II из-за сверхтекучести приводит к возникновению ряда уникальных эффектов.
Существует эффект фонтанирования в жидком гелии-II. На рисунке 10 представлена схема опытов иллюстрирующих необычное поведение жидком гелия-II. На рисунке 10а представлен опыт с колбочкой. Колбочка 2 с электронагревателем 3 размещена в сосуде с жидким гелием – II. На выходе из колбы устанавливаются подвешенные на нити 5 диски 4. При подводе теплоты к гелию в колбе, температуры жидкости в колбе увеличивается. Это приводит к повышению концентрации нормальной компоненты. Возникшая разность концентраций сверхтекучей компоненты в сосуде и в колбе приводит к её движению для выравнивания концентрации. Количество гелия внутри колбы быстро возрастает в результате притока сверхтекучей жидкости, растёт давления, и, жидкость изливается из открытого конца колбы. Вытекающий поток гелия регистрируется по перемещению дисков. На рисунке 10в более подробно показана схема движения жидкости в колбе. Тонкая плёнка сверхтекучей жидкости (менее 30 мкм) втекает вдоль стенки в колбу, а из колбы в центральной зоне движется нормальная компонента.
Эффект фонтанирования гелием – II иллюстрируется и в опытах с реактивной турбиной. Схема эксперимента с турбиной показана на рисунке 10б. Кварцевая турбина 1 находится на оси 2. Кончики турбины загнуты под углом 90о. Световой поток попадает на зачернённую поверхность 4 и нагревает гелий в турбине. Как и в предыдущем случае, происходит истечение гелия из турбины и начинается её вращение. Тонкая плёнка сверхтекучей компоненты гелия-II втекающая в турбину экспериментально не обнаруживается.
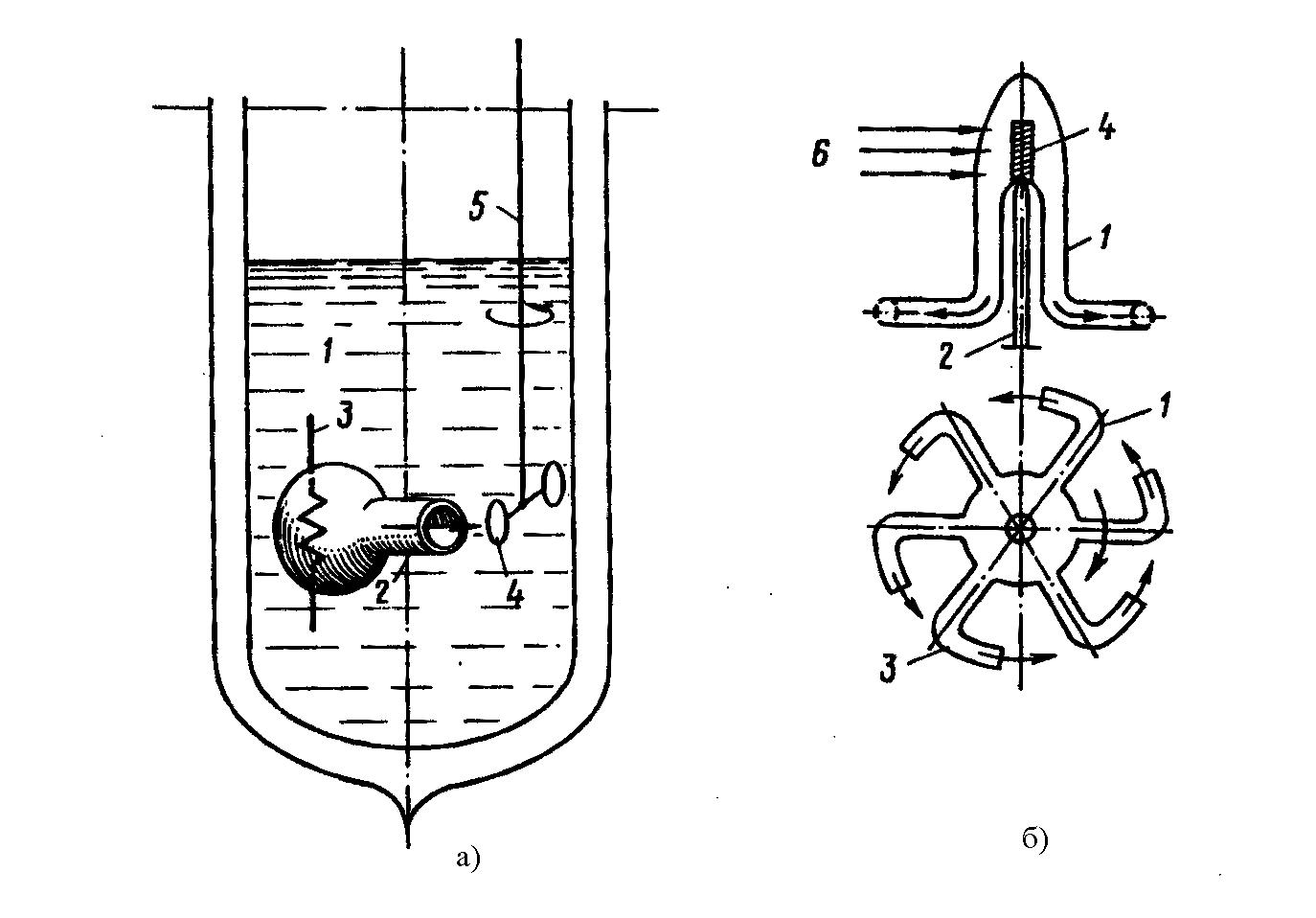

Рисунок 10 – Опыты иллюстрирующие движение Не II
Другой феномен, связанный с сверхтекучестью жидкого гелия,— перетекание пленки через край стакана. На рисунке 11 показаны эффектные опыты, иллюстрирующие движение гелия-II. Если стакан наполнить жидким гелием-II в большом сосуде, а затем поднять его над зеркалом жидкости, то по внутренним стенкам, через край стакана и потом по внешним стенкам стакана вниз будет ползти пленка (толщиной примерно 30 нм) и перетекать обратно в сосуд. Если стакан пустой, а его опустить в жидкость в большом сосуде, то тонкая пленка жидкости будет ползти вверх по внешним стенкам стакана до тех пор, пока уровень жидкости в стакане не сравняется с уровнем жидкости в большом сосуде. Скорость движения пленки зависит от ее температуры и в некоторой степени от состояния поверхности, по которой движется пленка. Наконец, если стакан поднять над поверхностью жидкости, то гелий вытекает из стакана, собираясь в центре дна, и по каплям стекает обратно в большой сосуд.

Рисунок 11 – Опыты иллюстрирующие движение Не II по стенкам сосуда
С состоянием сверхтекучести связан еще один явление, существующее в гелии-II, - второй звук. Второй звук похож на обычный звук тем, что он обладает определенной скоростью (которая отличается от скорости обычного или первого звука), может образовывать стоячие волны, волны второго звука могут отражаться. Второй звук отличается от обычного звука тем, что он представляет собой температурные волны или местные колебания температуры, а не волны давления или местные колебания давления. При периодическом изменении температуры возникают волны нагрева-охлаждения в результате взаимного перемещения сверхтекучей и нормальной компонент, обладающих инерцией.
Жидкий Не3 — прозрачная бесцветная жидкость, имеющая при стандартном давлении температуру насыщения 3.19 К и плотность при этих условиях 58.9 кг/м3. Теплота парообразования жидкого Не3 при температуре насыщения 3.19 К всего 8.49 кДж/кг, т.е. так мала, что на ранних этапах у исследователей были сомнения в том, что Не3 удастся получить в виде жидкости при атмосферном давлении. Как и Не4, Не3 остается в жидком состоянии при равновесном давлении паров вплоть до абсолютного нуля. Для перехода в твердую фазу Не3 необходимо сжать до давления 2930.3 кПа при 0.32 К — это минимальная точка на кривой затвердевания. Свойства жидкого Не3 значительно отличаются от свойств Не4 при низких температурах из-за квантовых эффектов, возникающих вследствие разницы масс и из-за квантового строения.
Смесь жидких Не3 и Не4 также обладает необычными свойствами. При температурах ниже 0.827 К смесь Не3 и Не4 самопроизвольно разделяется на две фазы: одна сверхтекучая (обогащенная Не4) и другая нормальная (обогащенная Не3). Это явление разделения фаз позволяет создавать рефрижераторы растворения для температур ниже 1 К.
