
- •Лабораторна робота № 2
- •1. Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Обладнання, хімічні реактиви
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи та проведення розрахунків
- •5. Техніка безпеки
- •6. Вимоги до звіту
- •7. Контрольні питання
- •8. Література
- •Визначення вмісту оксидів сірки (іv) та (vі) в газах сірчанокислотного виробництва
- •1. Характеристика методів аналізу
- •2. Обладнання, хімічні реактиви
- •4. Послідовність виконання роботи та розрахунків
- •2. Обладнання, хімічні реактиви:
- •3. Порядок виконання роботи
- •3.1. Схема лабораторної установки
- •3.2. Методика проведення досліду
- •4. Вивчення процесу обпалювання сірчистого колчедану з використанням багатофакторного планування експерименту
- •5. Техніка безпеки
- •2. Обладнання і хімічні реактиви
- •3. Послідовність виконання роботи
- •3.1 Визначення вмісту сірчаної кислоти
- •3.2. Визначення вмісту оксидів азоту
- •3.3 Побудова шкали еталонів
- •3.4 Приготування еталонного розчину
- •4. Техніка безпеки
- •5. Контрольні питання
- •6. Література
- •Звіт лабораторних робіт з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№2 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№3 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№4 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№5 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№7 з дисципліни: технологія виробництва сірчаної кислоти
2. Обладнання, хімічні реактиви:
Ресивер ГОСТ 8682-70.
Компресор УКМ.
Склянка Тищенко ГОСТ 8682-70.
Ротаметр-витратомір ГОСТ 13045-81.
Крани ГОСТ 7995-80Е.
Поглинальні склянки ГОСТ 8682-70.
Триходовий кран ГОСТ 7995-80Е.
Розходомір повітря ГОСТ 13045-81.
Термопара ГОСТ 3044-84 ( СТСЕВ 1059-85).
Термометр ГОСТ 28498-90.
3. Порядок виконання роботи
3.1. Схема лабораторної установки
Схема зображена на рисунку 5.1.
Повітря для горіння подається за допомогою компресора 1 через ресивер 2, осушувач повітря, ротаметр 3 в трубчасту піч 4. Відведення газів здійснюється через вихідний отвір з кварцової трубки трубчастої печі через поглиначі 5.
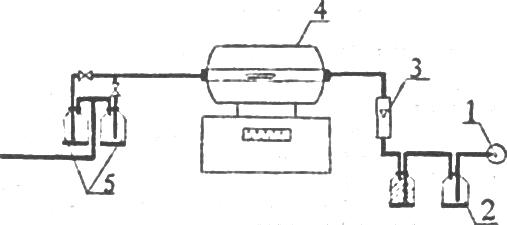
1 - компресор, 2 - ресивер, 3 - ротаметр, 4 - трубчаста піч, 5 - поглинальні склянки.
Рисунок 5.1 - Схема установки для дослідження процесу обпалення сірковмісного колчедану
3.2. Методика проведення досліду
Для проведення досліду вмикають піч для нагрівання і доводять температуру до необхідної межі (для колчедану 700-800 °С; для сірки 300- 400 °С). Далі беруть наважку колчедану (сірки), кладуть у фарфоровий човник, який швидко вміщують всередину кварцової трубки. Вихідний кінець кварцової трубки щільно закривають гумовою пробкою, яка за допомогою вмонтованої скляної трубки та газопроводу з’єднана із вхідним отвором поглинача. Швидкість подачі повітря регулюється за допомогою триходового крана. Момент переключення повітря на піч фіксується як початок досліду.
Записавши час, за який знебарвиться розчин йоду, у першому поглиначі переключають гази, що виходять на інший поглинач. Поглиначі по мірі знебарвлення розчину перезаряджають новим поглинальним розчином та замінюють в установці. Всі ці дії повторюють, доки поглинальний розчин не перестане знебарвлюватися. До складу поглинального розчину входить: 10- 30 см3 0,5 н розчину І2 та 50-60 см3 дистильованої води.
За кількістю знебарвленого йоду розраховують кількість SO2, що утворилася за певний проміжок часу. Якщо віднести цю кількість до теоретично можливої при повному вигорянні сірки, то отримаємо ступінь вигоряння сірки за певний час.
Приклад: нехай у піч завантажено 5г колчедану, який містить 40 % сірки. Теоретично можливо отримати сірчистого газу, г:
![]()
Якщо у поглинальну склянку налито 30 см3 0,5н розчину І2, і він знебарвився за 3 хв, то кількість S02, що знебарвила розчин дорівнюватиме, г:
![]()
де
—![]()
![]() 0,001-
маса SO2,
яка відповідає 1 см3
1н
розчину І2,
г.
0,001-
маса SO2,
яка відповідає 1 см3
1н
розчину І2,
г.
Значить,
за перші 3 хв вигоріло сірки, %: ![]() 100
= 12%.
100
= 12%.
Припустимо, що наступна порція розчину йоду знебарвилася за 5 хв, тобто загальний ступінь вигоряння за 8 хв дорівнюватиме 24 %.
Надалі
розрахунок проводиться таким же чином
і за даними дослідів будується графічна
залежність ступеня вигоряння сірки від
часу (ɳ = f(![]() )).
)).
Потім змінюють початкові умови проведення досліду (температура, об’ємні витрати повітря).
Роботу виконують за таких умов:
Температура обпалення - 300-750 °С.
Об’ємні витрати повітря - 300-600 см3/хв.
Результати роботи зводяться в таблицю:
Наважка FeS2, г |
Кількість 0,5 н розчину І2, см3 |
Вигоріло сірки |
Теоретично можлива кількість сірки, % |
Ступінь вигоряння сірки, %ɳ |
|
час, хв |
кількість SO2, г |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
