
- •Лабораторна робота № 2
- •1. Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Обладнання, хімічні реактиви
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи та проведення розрахунків
- •5. Техніка безпеки
- •6. Вимоги до звіту
- •7. Контрольні питання
- •8. Література
- •Визначення вмісту оксидів сірки (іv) та (vі) в газах сірчанокислотного виробництва
- •1. Характеристика методів аналізу
- •2. Обладнання, хімічні реактиви
- •4. Послідовність виконання роботи та розрахунків
- •2. Обладнання, хімічні реактиви:
- •3. Порядок виконання роботи
- •3.1. Схема лабораторної установки
- •3.2. Методика проведення досліду
- •4. Вивчення процесу обпалювання сірчистого колчедану з використанням багатофакторного планування експерименту
- •5. Техніка безпеки
- •2. Обладнання і хімічні реактиви
- •3. Послідовність виконання роботи
- •3.1 Визначення вмісту сірчаної кислоти
- •3.2. Визначення вмісту оксидів азоту
- •3.3 Побудова шкали еталонів
- •3.4 Приготування еталонного розчину
- •4. Техніка безпеки
- •5. Контрольні питання
- •6. Література
- •Звіт лабораторних робіт з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№2 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№3 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№4 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№5 з дисципліни: технологія виробництва сірчаної кислоти
- •Лабораторна робота№7 з дисципліни: технологія виробництва сірчаної кислоти
4. Послідовність виконання роботи та розрахунків
Для отримання оксиду сірки (VІ) S02 з балону 1, а повітря з компресора 7 подають у змішувач 3. Після змішування синтез-газ подається в трубчасту піч 4, де в об’ємі каталізатору при температурі 450-600 °С відбувається процес окислення S02 в S03. Після виходу з печі 4 газ охолоджується, проходить через поглинальні склянки 6 (для поглинання S02 і S03) та направляється в атмосферу.
Колбу 8 заповнюють до гумової пробки дистильованою водою, забарвленою метиловим оранжевим. Трубка 9 опускається до дна колби 8. Трубку 9 приєднують до крана відбору проби 5, трубку 10 опускають в мірну колбу 14. Відкривають затискачі (спочатку 11, потім 12). Коли мірна колба 14 заповниться до позначки, закривають затискачі 11 і 12. При цьому необхідно пам’ятати, що в колбі 8 має обов’язково залишитися певна кількість води (біля 200 см3), щоб шар води, забарвлений в червоний колір під впливом поглинутих S02 і S03, не попав у мірну колбу.
Після цього колбу 14 від’єднують від колби 8 та струшують у перевернутому положенні до повного поглинання туману. Потім, перевернувши, колбу 8 з’єднують за допомогою трубки 10 з ротаметром і заміряють розрідження. Відмічають температуру, при якій проводилося визначення розрідження в колбі. Після цього вміст колби 8 переносять у конічну колбу, ретельно промивають трубки і горловину колби 8. Промивні води додають до рідини, яка аналізується.
Отримані розчини Н2 S03 та Н2S04 титрують 0,1н розчином лугу в присутності 2-3 крапель фенолфталеїну. Далі додають у той самий розчин 2-3 см3 0,5 % розчину крохмалю та титрують 0,1н розчином І2 до появи синього забарвлення.
Розрахунок ведуть таким чином:
Об’єм води, що витекла у мірну колбу 14, зводять до нормальних умов:
![]()
де V0 - об'єм при нормальних умовах, см3;
V - об'єм води, що витік у колбу 13, см3;
Р та р - різниця барометричного та залишкового тисків у колбі 8, Па;
101325 - нормальний тиск, Па;
t - температура, при якій аналізувався газ, °С.
Маса GS02 + S03 (в г) у перерахунку на S03 буде становити:
GS02 + S03 = 0,040 · 0,1a · K1,
де 0,040 - мг-екв S03;
а - об'єм 0,1 н розчину NaОН, який пішов на титрування, см3.
Маса S02 дорівнює, г:
GS02 = 0,032 · 0,1% · K2,
де 0,032 - мг-екв S02;
в - об’єм 0,1н розчину І2, який пішов на титрування, см3.
Знайдену масу S02 перераховують на S03:
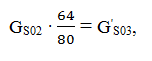
Тоді маса S03 буде дорівнювати
GS02 + S03 - G'S03 = GS03.
Газ містить, см3:

Об’єм газової суміші, взятий для аналізу, см3: Vзаг = V0+А+В, тоді склад газу буде, %:

Отримані результати та розрахунки зводять в таблицю:
№, п/п |
Покази ротаметрів |
Швидкість газової суміші,м3/год |
Титрування проб |
Склад газу,% |
|||
повітря |
SO2 |
розчин лугу |
розчин йоду |
SO2 |
SO3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Техніка безпеки
1. Перед проведенням експерименту установку слід перевірити на герметичність.
2. Температура в контактному апараті для запобігання спіканню каталізатора не повинна перевищувати 600 °С.
3. При виявленні запаху S02 негайно повідомити про це викладача або майстра по наладці установки.
4. Робота повинна виконуватися тільки при ввімкненій вентиляції у витяжній шафі.
6. Контрольні питання
1. Хімізм процесу контактного окислення S02 в S03.
2. Параметри технологічного процесу окислення S02 в S03.
3. Апаратурне оформлення процесу.
4. Сутність методики проведення роботи по визначенню оксидів сірки в газі.
7.Література
1. Х.Мухленов И.П., Кузнецов Д.А., Авербук А.Я. и др. Общая химическая технология, - М.: Высшая школа, 1983.
2. Амелин А.Г. Технология серной кислоты. - М.: Химия, 1983.
3. Руководство к практическим занятиям по технологии неорганических веществ: Учебное пособие для вузов / Под ред. М.Е. Позина. - Л.: Госхимиздат, 1967.
ЛАБОРАТОРНА РОБОТА № 5
Вивчення процесу обпалення сірковмісної сировини
Мета роботи: ознайомитися з методикою дослідження та контролю процесу обпалення сірковмісної сировини на лабораторній установці; встановити параметри оптимального режиму на основі вивчення процесу обпалення сірковмісної сировини з використанням багатофакторного планування експерименту.
1. Короткі відомості про процес
Першою стадією виробництва сірчаної кислоти є отримання оксиду сірки (ІV) в складі пічного газу при спалюванні сірки, сульфідних руд або іншої сірковмісної сировини.
При обпалюванні колчедану FeS2 йде кілька реакцій. Спочатку йде розкладання FeS2 з утворенням FeS та виділенням сірки в пароподібному стані:
2 FeS 2 = 2 FeS + S2.
Виділення сірки починається при температурі 500 °С та значно прискорюється з підвищенням температури. Пари сірки згоряють з утворенням оксиду сірки (ІV):
S(г)+02(г)= S02(г).
FeS також згоряє, а сумарний процес горіння колчедану при великому надлишку кисню протікає з утворенням оксиду заліза за рівнянням:
4 FeS 2 + 1102 = 2Fе203 + 8S02 + 3420 кДж,
а для меншої кількості кисню, високої температури та підвищеного вмісту оксиду сірки (ІV) в газі - з утворенням Fе304:
З FeS2 + 802 = Fе304 + 6S02 +2430 кДж .
Ці реакції практично необоротні. Швидкість цих реакцій зростає із зростанням температури, концентрації кисню в газовій суміші, поверхні контакту та концентрації реагуючих речовин. Швидкість процесу окислення колчедану лімітується дифузією кисню та оксиду сірки (ІV) всередині зерен колчедану, тому процес дуже прискорюється із зменшенням розміру часточок сировини. Інтенсивність процесу обпалювання залежить також від умов припливу та видалення газів з поверхні кожного зерна. Іншими словами, швидкість горіння колчедану, за інших рівних умов, як і швидкість інших гетерогенних процесів, обмежується швидкістю дифузійних процесів.
Гази, що виходять з печі, містять оксид сірки (ІV), надлишок кисню, азот, вологу, й приблизно 0.5 % оксиду сірки (VІ). Випалювання сірки з колчeдану як правило, відбувається не повністю і в недогарок переходить невелика кількість колчедану, що не розклався. Тому недогарок вміщує крім Fе20з, ще Fе304. FеS та домішки інших металів і їх оксидів.
Таким чином, швидкість процесу обпалення колчедану FeS2 залежить від багатьох факторів: масової частки сірки в колчедані, ступеня вилучення, температури, об’ємної частки кисню в зоні обпалення, інтенсивності перемішування колчедану, його хімічного та мінералогічного складу, швидкості потоку повітря і відводу газоподібних продуктів із зони реакції.
