
- •§ 1. Понятия и терминология
- •§ 2. Первый закон термодинамики
- •§ 3. Термохимия
- •40°, КДж/моль
- •§ 4. Применение первого закона термодинамики к биологическим системам
- •§ 5. Второй закон термодинамики. Энтропия
- •§ 6. Термодинамические потенциалы
- •§ 7. Биологические системы и ac0'
- •§ 8. Термодинамика химического равновесия
- •§ 9. Термодинамика открытых систем
- •Глава II. Учение о растворах
- •§ 1. Роль воды в жизнедеятельности организма
- •§ 2. Некоторые представления о растворах
- •§ 3. Процессы растворения и растворяющая способность воды
- •§ 4. Коллигативные свойства растворов
- •§ 5. Растворы слабых и сильных электролитов
- •§ 6. Кислоты, основания, амфолиты
- •Кислота I Основание 2 Основание 1 Кислота 2
- •§ 7. Ионное произведение воды.
- •Активная
- •§ 8. Гидролиз
- •§ 9. Физиологическое действие ионов водорода и гидроксид-ионов
- •§ 10. Буферные растворы и системы организма
- •Оксигемогло- Угольная Гемоглоби- биновая . Новая
- •§11. Колориметрический метод измерения рН
- •Красная Синяя
- •Малиновая Бесцветная
- •Глава III. Электрохимия II электрохимические методы исследований в физиологии и медицине
- •§ 2. Подвижности ионов
- •§ 3. Измерение электропроводимости растворов
- •§ 4. Кондуктометрическое исследование свойств растворов электролитов
- •§ 5. Кондуктометрическое титрование
- •§ 6. Электропроводимость клеток и тканей. Применение кондуктометрии в медицине
- •§ 7. Гальванические элементы и электродные потенциалы
- •§ 8. Уравнение Нернста для э. Д. С. Гальванического элемента и электродного потенциала
- •§ 9. Стандартные электродные потенциалы
- •§ 10. Классификация электродов
- •§ 11. Классификация гальванических цепей
- •§ 12. Электроды и цепи для измерения рН
- •§ 13. Потенциометрическое титрование
- •§ 14. Окислительно-восстановительные потенциалы биологических систем
- •§ 15. Диффузионные и мембранные потенциалы. Природа биопотенциалов
- •§16. Методики измерения э. Д. С. И рН
- •§ 17. Теоретические основы метода
- •§ 18. Применение полярографического метода в медико-биологических исследованиях
- •Глава IV. Физико химические основы кинетики биохимических реакций
- •§ 1. Понятие о скорости химической реакции. Кинетический вывод закона действующих масс
- •§ 2. Порядок и молекулярность реакций
- •§ 3. Зависимость скорости реакции от температуры. Энергия активации
- •§ 4. Катализ и катализаторы
- •Основание II Кислота I Кислота II Основание I (катализатор) (промежуточ-
- •§ 5. Особенности кинетики ферментативных процессов
- •§ 6. Механизмы химических и биохимических реакций
- •§ 7. Фотохимические реакции
- •Глава V. Поверхностные явления и адсорбция
- •§ 1. Поверхностная энергия и поверхностное натяжение
- •§ 2. Поверхностно-активные вещества и их свойства
- •§ 3. Общая характеристика сорбционных явлений
- •§ 4. Адсорбция газов на твердых поверхностях
- •§ 5. Адсорбция из растворов
- •Полиакриловая Полимер винилфосфоновой смола кислоты
- •§ 6. Хроматографический метод анализа
- •Глава VI. Физикохимия дисперсных систем
- •§ 2. Методы получения
- •§ 3. Молекулярно-кинетические свойства дисперсных систем
- •§ 4. Оптические свойства дисперсных систем
- •§ 5. Электрокинетические явления
- •§ 6. Двойной электрический слой.
- •§ 7. Электрокинетический потенциал и его свойства
- •§ 8. Электрофорез в медико-биологических исследованиях
- •§ 9. Виды и факторы устойчивости дисперсных систем
- •§10. Коагуляция электролитами. Коагуляция биологических систем
- •§11. Теория коагуляции
- •§ 12. Стабилизация дисперсных систем (коллоидная защита)
- •Глава VII. Свойства растворов высокомолекулярных соединений
- •§ 1. Некоторые сведения о синтетических и природных вмс
- •Структура полипептидной цепи
- •§ 2. Набухание и растворение вмс
- •§ 3, Устойчивость растворов вмс и методы осаждения белков
- •§ 4. Вязкость растворов вмс
- •§ 5. Свойства гелей и студней
§ 3. Термохимия
Независимость теплового эффекта от пути процесса установил опытным путем русский академик Г. И. Гесє в 1836 г. Закон Гесса гласит: тепловые эффекты химических реакций, протекающих при постоянном объеме или постоянном давлении, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций.
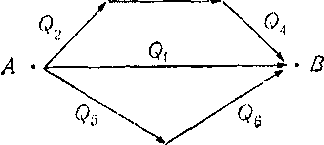
Тепловые эффекты для процесса, идущего различными путями, можно изобразить следующей схемой:
O3
Il
Из состояния А в состояние В система может перейти различными путями. Суммарные тепловые эффекты каждого пути будут при этом равны. Поэтому можно записать;
Qi = Q2+ Q3+ Q4 = Q8+ Qe- (1.5)
Закон Гесса является следствием первого начала термодинамики и служит основой термохимии — раздела химии, изучающего тепловые эффекты химических процессов. Он позволяет рассчитывать тепловые эффекты процессов, для которых отсутствуют экспериментальные данные либо которые невозможно осуществить.
Например, процесс окисления углерода можно представить следующими термохимическими уравнениями.=
С + O2 = CO2, AJY1; С+1/2O2 = CO1 AH2; 0+1/2O2 = CO21 AH3.
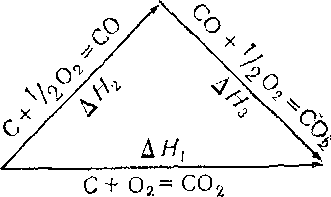
Здесь и в дальнейшем указаны изменения энтальпии реакции, которые противоположны по знаку тепловым эффектам.
Из сделанной записи видно, что AH1= АЯ,2+ ДЯ.а. Экспериментально можно легко измерить AjY1 и AjV3. Величину AjY2 с достаточной точностью определить невозможно, поскольку реакция окисления углерода до СО сопровождается всегда окислением и до CO2. Закон Гесса дает возможность рассчитать Л#2:
AH2 = AZY1 — AH3. Для данного случая
AyY1 = —393,5 кДж/моль; AH8 = —283,0 кДж/моль; AH2 = —393,5 — (—283,0) = —110,5 кДж/моль.
Термохимия позволяет определять тепловые эффекты различных реакций — теплоты образования химических соединений, теплоты сгорания, растворения, плавления, нейтрализации и т. д.
Тепловые эффекты, отнесенные к 1 моль вещества и стандартным условиям — температуре 298 К и давлению 101,3 кПа, называются стандартными.
Стандартная теплота (энтальпия) образования —..это тепловой эффект процесса образования 1 моль соединения из простых веществ при условии, что все компоненты системы находятся в стандартных состояниях. Обозначаются стандартные энтальпии образования Л#0бр и выражаются в джоулях (Дж) или килоджоулях (кДж) на моль:
1/2N2 +1/2O2 = NO ДЯ°обр = 81,6 кДж/моль; С + O2 = CO2 (г) АН°обр = —393,5 кДж /моль; H2 + 1 /2O2=H2O (ж) ДЯ^р = —286,8 кДж/моль; 1% + 1/2O2=H2O (п) AHl6 = ~242 кДж/моль
(г — газ, ж — жидкость, п ~f- пар).
Как следует из приведенных примеров, значения энтальпии образования зависят от агрегатного состояния вещества. Например, они различны для H2O (п) и H2O (ж). При образовании 1 моль водяного пара выделяется меньше теплоты, чем
Таблица 1. Термодинамические свойства некоторых соединений
органических
Соединение
Д«обр' кДж/моль
