
- •Механизмы образования химической связи
- •Реакция первого порядка
- •Реакция второго порядка
- •Термохимические уравнения
- •Закон Гесса
- •Закон Кирхгофа
- •Методы термохимии
- •Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
- •Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
1
Энергия Гиббса (или энергия Гельмгольца) характеризуют ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермическом (или в изохорно-изотермическом) процессе (так называемая полезная работа, совершаемая системой). Энергия Гиббса и энергия Гельмгольца являются функциями состояния системы, их абсолютные значения не поддаются вычислению. В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях: - при dG = 0 (G=Gmin , энергия Гиббса имеет минимальное значение) система находится в состоянии термодинамического равновесия; - при dG < 0 (Ga Gmin , энергия Гиббса убывает) процесс самопроизвольно протекает в прямом направлении, т.е. термодинамически возможен; - при dG > 0 (Ga Gmin, энергия Гиббса возрастает) самопроизвольно протекает только обратный процесс , прямой процесс термодинамически невозможен.
Химическая связь взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов или образования общих электронных пар (Г. Льюис).
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (Eсв). См фото
Химическая связь - это совокупность сил электростатического притяжения и отталкивания, создающее динамически устойчивую систему из двух и более атомов. Основной принцип образования молекул из атомов – это стремление к минимальной энергии и к максимальной устойчивости (пример: H(г)+H(г)=H2(г) + 435 кДж/моль энергии).
Виды химической связи:
Ковалентная связь – связь атомов за счет обществления электронной пары с антипараллельными спинами. Ковалентная неполярная связь возникает между неметаллами, разность электроотрицательности между которыми невелика: 0<Э.О.<0,4 (пример: PH3; Э.О.(P)=2,1; Э.О.(H)=2,2; Э.О.=0,1). Соответственно ковалентная полярная связь возникает между элементами с большой электроотрицательностью: 0,4<Э.О.<2 (пример: HCl Э.О.(H)=2,2; Э.О.(Cl)=3,1; Э.О.=0,9).
Ионная связь – это связь между ионами, т.е связь между атомами. Обусловлена электростатическим взаимодействием противоположно заряженных ионов. Рассматривается как отдельный случай ковалентной полярной связи. Для ионной связи Э.О.>2 (пример: NaCl Э.О.(Na)=0,9; Э.О.(Cl)=3,1; Э.О.=2,2).
Водородная связь – связь, обусловленная положительно поляризованным водородом в молекуле и электроотрицательным атомом другой или той же молекулы.
Металлическая связь – связь, обусловленная электростатическим взаимодействием между обобществленными делокализованными валентными электронами и положительно заряженными катионами в узлах кристаллической решетки
2.
1. энтропия(S) - мера неупорядоченности системы, выражается через вероятность S=klnw, где k-пост Больцмана, а w-кол-во микросост-й, с помощью которых можно реализовать данное макрос-е. с другой стороны в равновесном процессе S=Q/T, а в неравн S<Q/T (Дж/К). Энтропия как ф-ция внутренней энергии U системы, объема V и числа молей ni i-го компонента представляет собой характеристич. ф-цию. Простые ф-лы связывают энтропию с теплоемкостями при пост. давлении Ср и пост, объеме Cv
![]()
2. реакция диспропорционирования – химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
Примером может служить реакция взаимодействия оксида азота(IV) с водой:
![]()
или реакция разложения хлората калия
![]()
3. S+2h2so4(конц)=3so2+2h20
3.
1.энтальпия (тепловая функция Гиббса) – функция сост-я, опис теплосодержание хим с-мы при пост давлении (теплосодержание расширяющ системы): H ≡U-pV, H≡Qp (Дж или кал) (U- внутр энерг). Изменение энт реакции (∆Hp) – тепловой эффект хим реак при пост давлении (изобарн). Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.
2. Окислительно-восстановительная реакция, в которой окислителем и восстановителем является один и тот же химический элемент в разных степенях окисления. В результате образуется продукт с тем же элементом в промежуточной степени окисления.
Примеры реакций компропорционирования:
Взаимодействие иодида с иодатом при подкислении:
IO3- + 5 I- + 6 H + → 3 I2 + 3 H2O
Взаимодействие соли марганца (II) с перманганатом:
3Mn2+ + 2MnO4- + 2H2O = 5MnO2 + 4H+
Компропорционирование обратно диспропорционированию.
Некоторые реакции компропорционирования могут быть обращены при изменении условия (например, компропорционирование иодида с иодатом обращается при подщелачивании среды), другие не могут быть обращены ни при каких условиях (например, компропорционирование Mn2+ с MnO4-).
4.
1. Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов. Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Основными экспериментальными методами термохимии являются калориметрия, дифференциальный термический анализ, дериватография (изменение темп режима). Стандартная энтальпия атомизации (∆H°ат) = диссоциации двухатомных молекул (2∆H°дисс ) – изменение энтальпии при обр-нии 1 моля газообр атомов простого в-тва
2. два главных способа образования ков связи:
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
![]()
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить схемой:

Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустуюорбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
2KMnO4+5KNO2+3H2SO4=2MnSO4+5KNO3+K2SO4+3H2O
5
1. Химическим равновесием называется такое состояние обратимой химической реакции
aA + bB = cC + dD,
при
котором с течением времени не происходит
изменения концентраций реагирующих
веществ в реакционной смеси. Состояние
химического равновесия
характеризуется константой химического
равновесия:
![]() где Ci – концентрации компонентов
в равновесной идеальной смеси.
где Ci – концентрации компонентов
в равновесной идеальной смеси.
Изменение rG или rF в
химической реакции при заданных (не
обязательно равновесных) парциальных
давлениях Pi или концентрациях Ci компонентов
можно рассчитать по уравнению изотермы
химической реакции (изотермы
Вант-Гоффа):
![]()
![]()
2. Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1(l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
 и
и  .
.
3. 2KI+Cl2=2KCl+I2
6
Скорость хим р-ции(V)-число элементарных актов реакции,происход в ед времени,в ед объема(для гомогенных р-ций) или на ед поверхности(для гетерогенных реакций) раздела фаз.Элементарный акт р-ции состоит в таком соударении и дальнейшем взаимод молекул,перераспределении эл плотности,образовании новых и разрыве старых св,когда образуются новые по сост и строению в-ва. Скорость химической реакции-величина всегда положительная.Скорость гомогенной и гетерогенной р-ций определ различно. Закон действ масс-скорость хим р-ции прямо пропорциональна роизведению реагир в-в в степенях,соответсвующих пордкам р-ции. Для элементарных реакций(одностадийных)показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается.Скорость р-ции в целом определ лимитирующей стадией(наиболее медленной).В случае гетерогенной р-ции в выражение закона действ масс входят только концентрации газооб в-в,либо в-в,наход в р-ре.Конц тв в-в никогда не входят в выражение закона действ масс,тк р-ции протекают на их поверхности,а площадь поверхности не измен.Факторы,влияющие на ск: наличие катализатора,темп(правило Вант-Гоффа при увел темп на каждый 10 град ск хим р-ций возрастает в 2-4 р),давление,конц реагир в-в,объем(чем меньше объем,тем больше давл),площадь раздела фаз(при увелич-напр измельчении-скор возраст прямопропорц увелич площади). 2. Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда. Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии. Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. Если число электронов при заданном l просуммировать от 0 до n – 1, то получим формулу Бора–Бьюри, определяющую общее число электронов на уровне с заданным n:
|
Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: III
7
Катализ 1)В-ва,не расходующиеся в р-те протеканя реакции,но влияющие на ее скорость-катализаторы. Явление изменения скор р-ции под действием таких в-в-катализ.Реакции,протек под действ катализаторов-каталитические.Катализ-гомогенный(катализатор и рег в-ва образ 1 фазу:газ или р-р,гетерогенный:катализатор наход в системе в виде самост фазы.При гетерогенном катализе р-ция проходит на поверхности катализатора->активность зависит от величины и с-в его поврехн.(чтобы иметь большую поверхность,катализатор должен быть раздроблен).Бывают катализаторы ускор р-ции-положительные,замедл-отрицат(ингибиторы).Действие катализатора объясняется тем,что сниж энергию активации р-ции.(мин кол-во Е,которое требуется сообщить системе,чтобы произошла р-ция)В присутствии кт р-ция проходит через др промежуточные стадии,причем эти стадии энергетически более доступны->энергия акт пониж->некоторые молекулы,энергия которых была недостаточна для активных стокновений,теперь оказываются активными.Катализатор в одно и то же время ускоряет и прямую и обратную р-ции.Суть катализа:в присутствии ктализатора изменяется путь,по которому проходит суммарная р-ция,образ другие переходные сост с иными энергиями акт.,а поэтому и изменяется и скор хим р-ции.Катализаторы отличаются селективностью(действуют на процессы избирательно,направляя его в опред сторону:пример с этанлом над Al2O3 350 в этилен,250С нам Cu в уксусный альд и водор).Отриц катализ-для замедления электрохим коррозии стальных констр.
8
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
сравнение ммо и мвс. Оба квантовомеханических подхода к описанию химической связи – ММО и МВС – приближенны, ММО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях. МВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами. Сравнивая МВС м ММО, следует отметить, что достоинством первого является его наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар. Однако существование некоторых соединений невозможно объяснить с позиций МВС. Это электронодефицитные соединения (B2H6, NO, H2+) и соединения благородных газов. Их строение легко объясняет ММО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции ММО. И, наконец, магнетизм и окраска вещества также легко объясняются ММО. Количественные расчеты в ММО все же гораздо проще, чем в МВС. Поэтому в настоящее время в квантовой химии МВС почти не применяется. В то же время качественно выводы МВС гораздо нагляднее и шире используются экспериментаторами, чем ММО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
9
Растворы как хим система. Согласно второму началу термодинамики при р, Т = = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е. ΔG = (ΔН – TΔS) < 0. Величину ΔН называют энтальпийным фактором, а величину TΔS – энтропийным фактором растворения. При растворении жидких и твердых веществ энтропия системы обычно возрастает (ΔS > 0), так как растворяе–мые вещества из более упорядоченного состояния пе–реходят в менее упорядоченное. Вклад энтропийного фактора, способствующий увеличению растворимости, особенно заметен при повышенных температурах, по–тому что в этом случае множитель Т велик и абсолютное значение произведения TΔS также велико, соответст–венно возрастает убыль энергии Гиббса. При растворении газов в жидкости энтропия системы обычно уменьшается (ΔS < 0), так как растворяемое вещество из менее упорядоченного состояния (боль–шого объема) переходит в более упорядоченное (ма–лый объем). Снижение температуры благоприятствует растворению газов, потому что в этом случае множи–тель Т мал и абсолютное значение произведения TΔS будет тем меньше, а убыль энергии Гиббса тем больше, чем ниже значение Т. В процессе образования раствора энтальпия систе–мы также может как увеличиваться (NaCI), так и умень–шаться (КОН). Изменение энтальпии процесса раство–рения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо– и экзотермиче–ских вкладов всех процессов, сопровождающих про–цесс растворения. Это эндотермические эффекты раз–рушения кристаллической решетки веществ, разрыва связи молекул, разрушения исходной структуры рас–творителя и экзотермические эффекты образова–ния различных продуктов взаимодействия, в том числе сольватов.
Изомерия комплексных соединений связана 1) с возможным различным расположением лигандов и внешнесферных частиц, 2) с различным строением самой комплексной частицы.
К первой группе относится гидратная (в общем случае сольватная) и ионизационная изомерия, ко второй – пространственная и оптическая.
Гидратная изомерия связана с возможностью различного распределения молекул воды во внешней и внутренней сферах комплексного соединения, например: [Cu(H2O)2Br2] (цвет красно-коричневый) и [Cu(H2O)4]Br2 (цвет голубой).
Ионизационная изомерия связана с возможностью различного распределения ионов во внешней и внутренней сфере, например: [Co(NH3)5Br]SO4 (пурпурного цвета) и [Co(NH3)5SO4]Br (красного цвета). Первое из этих соединений образует осадок, реагируя с раствором хлорида бария, а второе – с раствором нитрата серебра.
Пространственная (геометрическая) изомерия, иначе называемая цис-транс изомерией, характерна для квадратных и октаэдрических комплексов (для тетраэдрических невозможна). Пример: цис-транс изомерия квадратного комплекса [Pt(NH3)2Cl2]

Оптическая (зеркальная) изомерия по своей сути не отличается от оптической изомерии в органической химии и характерна для тетраэдрических и октаэдрических комплексов (для квадратных невозможна).
10
Механизмы образования химической связи
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи. Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов.ьНа отдельных стадиях химических реакций могут образовываться и валентно ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3. Реакционная способность радикалов очень высока и поэтому время их существования, как правило, мало. Донорно-акцепторный механизм Известно, что валентно насыщенные соединения аммиак NH3 и трифторид бора BF3 реагируют друг с другом по реакции NH3 + BF3 = NH3BF3 + 171,4 кДж/моль. Рассмотрим механизм этой реакции:
 Видно,
что из четырех орбиталей бора три
заселены, а одна - остается вакантной.
В молекуле аммиака заселены все четыре
орбитали азота, из них три – по обменному
механизму электронами азота и водорода,
а одна содержит электронную пару, оба
электрона которой принадлежат азоту.
Такая электронная пара называется
неподеленной электронной парой.
Образование соединения H3N · BF3 происходит
за счет того, что неподеленная электронная
пара аммиака занимает вакантную орбиталь
фторида бора. При этом уменьшается
потенциальная энергия системы и
выделяется эквивалентное количество
энергии. Подобный механизм образования
называют донорно-акцепторным, донором
– такой атом, который отдает свою
электронную пару для образования связи
(в данном случае атом азота); а атом,
который предоставляя вакантную орбиталь,
принимает электронную пару, называется
акцептором (в данном случае атом бора).
Донорно-акцепторная связь является
разновидностью ковалентной связи. В
соединении H3N · BF3 азот и бор –
четырехвалентны. Атом азота повышает
свою валентность от 3 до 4 в результате
использования неподеленной электронной
пары для образования дополнительной
химической связи. Атом бора повышает
валентность за счет наличия у него
свободной орбитали на валентном
электронном уровне. Таким образом,
валентность элементов определяется
не только числом неспаренных электронов,
но и наличием неподеленных электронных
пар и свободных орбиталей на валентном
электронном уровне.
Видно,
что из четырех орбиталей бора три
заселены, а одна - остается вакантной.
В молекуле аммиака заселены все четыре
орбитали азота, из них три – по обменному
механизму электронами азота и водорода,
а одна содержит электронную пару, оба
электрона которой принадлежат азоту.
Такая электронная пара называется
неподеленной электронной парой.
Образование соединения H3N · BF3 происходит
за счет того, что неподеленная электронная
пара аммиака занимает вакантную орбиталь
фторида бора. При этом уменьшается
потенциальная энергия системы и
выделяется эквивалентное количество
энергии. Подобный механизм образования
называют донорно-акцепторным, донором
– такой атом, который отдает свою
электронную пару для образования связи
(в данном случае атом азота); а атом,
который предоставляя вакантную орбиталь,
принимает электронную пару, называется
акцептором (в данном случае атом бора).
Донорно-акцепторная связь является
разновидностью ковалентной связи. В
соединении H3N · BF3 азот и бор –
четырехвалентны. Атом азота повышает
свою валентность от 3 до 4 в результате
использования неподеленной электронной
пары для образования дополнительной
химической связи. Атом бора повышает
валентность за счет наличия у него
свободной орбитали на валентном
электронном уровне. Таким образом,
валентность элементов определяется
не только числом неспаренных электронов,
но и наличием неподеленных электронных
пар и свободных орбиталей на валентном
электронном уровне.
Теория кристаллического поля исходит из того, что природа лигандов и их расположение вокруг центрального иона (симметрия комплекса) уменьшают вырождениеd-орбиталей и изменяют их энергию. В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит отсимметрии расположения лигандов ( октаэдрическое, тетраэдрическое или иное кристаллическое поле ). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3 или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F или полярные молекулы типа NH3). В условном ионе М(+), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) иd(x2 y2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина. Разность энергий двух новых подуровней d и d получила название параметра расщепления 0: E2 – E1 = 0 Расположение двух новых энергетических подуровней d и d по отношению к исходному (d-АО) на энергетической диаграмменесимметричное: (Е2 – Е0) (Е0 – Е1). Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е0. Иначе говоря, должно выполняться равенство 4(Е2 – Е0) = 6(Е0 – Е1), где 4 и 6 – максимальное число электронов на d- и d-АО. Из этого равенства следует, что (Е2 – Е0) / (Е0 – Е1) = 3/2 и (Е2 – Е1) / (Е0 – Е1>) = 5/2, или 0 / (Е0 – Е1) = 5/2, откуда (Е0 – Е1) = 2/5 0>. Размещение каждого электрона из шести максимально возможных на d-орбитали вызывает уменьшение (выигрыш) энергии на 2/5 0. Наоборот, размещение каждого электрона из четырех возможных на d-орбитали вызывает увеличение (затрату) энергии на 3/5 0. Если заселить электронами d- и d-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
11
Растворение газа в жидкости почти всегда сопровож-ся выдел-м теплоты, поэтому растворим-сть газа с повыш-м темепер-ры понижается. Однако иногда растворе- газа сопровож-ся поглощением теплоты(например, растворение благород. газов в орган. растворах); в этом случае повышение температуры увеличивает растворимость газа.Газ в жидкости не растворяется беспредельно. При растворении происходит уменьшение обьема системы, поэтому повышение давления должно приводить к увеличению растворимости газа. Если газ малорастворим и давление мало, то раствор-сть газа пропорциональна его давлению. Эта зависимость выражена в законе Генри :кол-во газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.с(Х)=Кг(Х)р(Х) , где с(Х)-концентрация газа в насыщ. растворе,моль/л, p(Х)-давление газа Х над раствором, ПА, Кг(Х)- постоянная Генри для газа Х, моль*л в минус первой*па в минус первой. Константа генри зависти от природы газа, растворителя и температуры. Закон Генри является частным случаем общего закона Дальтона (если речь идет о растворении смеси газов, то растворимость подчиняется этому закону) : растворимость каждого компонента газовой смеси при постоянной темпер-ре пропорциональна парциальному давлению компонента над жидкостью и не зависти от общего давления смеси и индивидуальности других компонентов. Под парциальным давлением понимается доля давления компонента от общего давления газовой смеси, рассчитывается по формуле рi = pобщx(Xi), где pi- парциальное давление компонента Xi, робщ- общее давление газовой смеси, х(Хi)-молярная доля i-го компонента.
II и III периоды включают по 8 элементов, названных Менделеевым типическими. легчайшие элементы, от H до Na, называются типическими, ибо в них выражены как в образцах и в наиболее ясной форме все виды и свойства, но и со своими особенностями.
12
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Теория валентных связей. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней. Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя. При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей. Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрываниесоответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда,упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентнойсвязью, достаточной прочной и энергетически выгодной. Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
2CuSO4 + 2Na2CO3 + H2O = (СuOH)2CO3 + CO2
 +
2Na2SO4,
+
2Na2SO4,
13
Рауля законы, количественные зависимости, связывающие концентрацию раствора или с давлением насыщенного пара растворителя над раствором, или с изменением температуры кипения (замерзания) раствора. Один из законов Ф. Рауля гласит: относительное понижение парциального давления пара растворителя равно мольной доле растворённого вещества, т. е.
![]() где
где ![]() —
давление насыщенного пара чистого
растворителя при данной
температуре, p1 — давление
насыщенного пара растворителя над
раствором, х2 — мольная
доля растворённого вещества. В такой
форме закон применим лишь к растворам,
насыщенный пар которых ведёт себя как
идеальный газ. Растворы, для которых
соотношение (1) выполняется при всех
концентрациях и при всех температурах
в области существования раствора, часто
называются идеальными (совершенными).
В более общем случае в соотношении (1)
должны использоваться не давления и
концентрации, а летучести и активности.
Для другого закона Рауля, по которому
повышение температуры кипения (tкип)
или понижение температуры замерзания
(tк)
раствора прямо пропорционально моляльной
концентрации растворённого вещества,
имеют место соотношения:
—
давление насыщенного пара чистого
растворителя при данной
температуре, p1 — давление
насыщенного пара растворителя над
раствором, х2 — мольная
доля растворённого вещества. В такой
форме закон применим лишь к растворам,
насыщенный пар которых ведёт себя как
идеальный газ. Растворы, для которых
соотношение (1) выполняется при всех
концентрациях и при всех температурах
в области существования раствора, часто
называются идеальными (совершенными).
В более общем случае в соотношении (1)
должны использоваться не давления и
концентрации, а летучести и активности.
Для другого закона Рауля, по которому
повышение температуры кипения (tкип)
или понижение температуры замерзания
(tк)
раствора прямо пропорционально моляльной
концентрации растворённого вещества,
имеют место соотношения:
Dtкип = Еэ×m, Dtк = Eкm, (2)
где Dtкип — величина повышения tкип и Dtк — величина понижения tк, m — моляльная концентрация раствора, а Еэ и Ек — т. н. эбулиоскопическая (см. Эбулиоскопия) и криоскопическая (см. Криоскопия) постоянные растворителя (они приводятся во многих физико-химических таблицах). Соотношения (2) используют для определения молекулярной массы растворённого вещества по экспериментально определяемым величинам Dtкип и Dtк.
2.В основе теории молекулярных орбиталей лежит представление о том, что электронная орбиталь в атоме описывается волновой функцией (см. Уравнение Шрёдингера). Теория объясняет, как при протекании химической реакции атомные орбитали преобразуются в молекулярные. Подобно большинству известных нам типов волн, волновые функции электронов в орбиталях претерпевают интерференцию. Оказывается, орбитали в молекулах можно, с хорошим приближением, представить как результат интерференции волновых функций атомов.
Например, рассмотрим, что происходит при взаимодействии двух атомных орбиталей соседних атомов. Если в области перекрывания орбиталей волновые функции претерпевают конструктивную интерференцию, электроны большую часть времени проводят между ядрами, притягивая атомы друг к другу. С другой стороны, если интерференция в области перекрывания деструктивная, электронная плотность между ядрами равна нулю, и между атомами возникает результирующая сила отталкивания. Таким образом, две атомные орбитали объединяются с образованием двух молекулярных орбиталей: одна стремится связать атомы (связывающая молекулярная орбиталь), а другая — оттолкнуть их (разрыхляющая молекулярная орбиталь). И их взаимодействие определяет, будет ли образована стабильная молекула.
3.S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O
14
Теория электролитической диссоциации
1. 1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). a = n / N 0<a<1
2. Теория валентных связей. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней. Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя. При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей. Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрываниесоответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда,упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентнойсвязью, достаточной прочной и энергетически выгодной. Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
3. 2KMnO4+K2SO3+2KOH=2K2MnO4+K2SO4+H2O
15
Диссоциация слабых электролитов - обратимый процесс. Для диссоциации слабого бинарного электролита KA: KA « Ky+ + Ax- на основании закона действия масс справедливо соотношение:
 Константу равновесия в данном случае
называют константой
диссоциации (константой ионизации).
Как и любая константа равновесия, константа
диссоциации зависит от природы
диссоциирующего вещества и растворителя,
температуры и не зависит от концентрации
раствора.
Константа диссоциации - важная
характеристика слабых электролитов.
Чем меньше величина Kд ,
тем слабее диссоциирует электролит в
данном растворителе. Kд связана
с a простой
зависимостью. Если общую молярную
концентрацию электролита в растворе
обозначить СКА , то
для бинарных электролитов концентрации
ионов Ky+ и
Ax- будут
равныa·CKA .
Очевидно, что [Ky+]
= [Ax-]
= a·CKA ,
Константу равновесия в данном случае
называют константой
диссоциации (константой ионизации).
Как и любая константа равновесия, константа
диссоциации зависит от природы
диссоциирующего вещества и растворителя,
температуры и не зависит от концентрации
раствора.
Константа диссоциации - важная
характеристика слабых электролитов.
Чем меньше величина Kд ,
тем слабее диссоциирует электролит в
данном растворителе. Kд связана
с a простой
зависимостью. Если общую молярную
концентрацию электролита в растворе
обозначить СКА , то
для бинарных электролитов концентрации
ионов Ky+ и
Ax- будут
равныa·CKA .
Очевидно, что [Ky+]
= [Ax-]
= a·CKA ,
[KA]
= CKA - a·CKA =
CKA·(1-a ),
тогда
![]() Для слабых электролитов a ® 0
и (1 - a ) ® 1.
Следовательно,
Для слабых электролитов a ® 0
и (1 - a ) ® 1.
Следовательно,
![]() Полученная зависимость является
математическим выражением закона
разбавления Оствальда (1888
г.): степень
диссоциации слабого электролита
увеличивается при разбавлении раствора
обратно пропорционально корню квадратному
из его молярной концентрации.
Полученная зависимость является
математическим выражением закона
разбавления Оствальда (1888
г.): степень
диссоциации слабого электролита
увеличивается при разбавлении раствора
обратно пропорционально корню квадратному
из его молярной концентрации.
С сильным акцептором электронов водород образует положительный ион Н+, т.е. протон. На электронной орбите атома водорода могут находиться 2 электрона, поэтому водород способен также принимать электрон, образуя отрицательный ион Н-, гидрид-ион, и это роднит водород с галогенами, для которых характерно принятие электрона с образованием отрицательного галогенид-иона типа Cl-.
16HCl + 2KMnO4 = Cl2 +2KCl +2MnCl2 + 8H2O.
16
КH2O = 1.10-4 Данная константа для воды называется ионным произведением воды, которое зависит только от температуры. При диссоциации воды на каждый ион Н+ образуется один ион ОН-, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН-]. Используя значение ионного произведения воды, находим: [H+] = [ОН-] =
 моль/л.
Таковы концентрации ионов Н+ и
ОН- в
чистой воде. Рассмотрим, как изменится
концентрация при добавлении других
веществ, например, соляной кислоты,
которая диссоциирует в воде на ионы
Н+ и
Сl-.
Концентрация ионов Н+ в
растворе станет увеличиваться, но
ионное произведение воды от концентрации
не зависит - в таком случае уменьшается
концентрация [ОН-].
Напротив, если к воде добавить щелочь,
то концентрация [ОН-]
увеличится, а [Н+]
уменьшится. Концентрации [Н+]
и [ОН-]
взаимосвязаны: чем больше одна величина,
тем меньше другая, и наоборот. Кислотность
растворов обычно выражают через
концентрацию ионов Н+.
В кислых растворах [Н+]
> 10-7 моль/л,
в нейтральных [Н+]
= 10-7 моль/л,
в щелочных [Н+]
< 10-7 моль/л.
Чтобы не писать числа с показателем
степени, кислотность раствора часто
выражают через отрицательный логарифм
концентрации ионов водорода, называя
эту величинуводородным
ателем и
обозначая ее рН: pН
= -lg[Н+].
Величина рН впервые была введена
датским химиком С. Серенсоном. Буква
“р” - начальная от датского
слова potenz (степень),
“Н” - символ водорода. В кислых растворах
рН < 7, в нейтральных рН = 7, в щелочных pH >
7.
моль/л.
Таковы концентрации ионов Н+ и
ОН- в
чистой воде. Рассмотрим, как изменится
концентрация при добавлении других
веществ, например, соляной кислоты,
которая диссоциирует в воде на ионы
Н+ и
Сl-.
Концентрация ионов Н+ в
растворе станет увеличиваться, но
ионное произведение воды от концентрации
не зависит - в таком случае уменьшается
концентрация [ОН-].
Напротив, если к воде добавить щелочь,
то концентрация [ОН-]
увеличится, а [Н+]
уменьшится. Концентрации [Н+]
и [ОН-]
взаимосвязаны: чем больше одна величина,
тем меньше другая, и наоборот. Кислотность
растворов обычно выражают через
концентрацию ионов Н+.
В кислых растворах [Н+]
> 10-7 моль/л,
в нейтральных [Н+]
= 10-7 моль/л,
в щелочных [Н+]
< 10-7 моль/л.
Чтобы не писать числа с показателем
степени, кислотность раствора часто
выражают через отрицательный логарифм
концентрации ионов водорода, называя
эту величинуводородным
ателем и
обозначая ее рН: pН
= -lg[Н+].
Величина рН впервые была введена
датским химиком С. Серенсоном. Буква
“р” - начальная от датского
слова potenz (степень),
“Н” - символ водорода. В кислых растворах
рН < 7, в нейтральных рН = 7, в щелочных pH >
7.
3. CuSO4+Na2CO3+H2O=Na2SO4+CO2(газ)+Cu(OH)2(осадок)
17
1.Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции (pH) среды.
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого вещества. В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль.
а) Соль образована слабой кислотой и сильным основанием (K2S).
При растворении в воде K2S диссоциирует
K2S=2K+ + S2-.
При составлении уравнений гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды в малодиссоциирующие соединения, т.е. ионы, обусловливающие гидролиз.
В данном случае ионы S2- связывают катион H+, образуя ион HS–
S2– +H2O=HS– + OH–
Уравнение гидролиза в молекулярной форме
K2S + H2O=KHS + KOH.
б) Cоль образована слабым основанием и сильной кислотой (CuCl2, Al2(SO4)3).
При растворении в воде CuCl2 диссоциирует
СuCl2=Cu2+ + 2Cl–
Ионы Cu2+ соединяются с ионами OH–, образуя гидроксоионы CuOH+. Гидролиз соли ограничивается первой ступенью, и образование молекулы Cu(OH)2 не происходит. Ионно-молекулярное уравнение имеет вид
Cu2+ + HOH=CuOH+ + H+.
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом
CuCl2 + H2O= CuOHCl + HСl.
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой (в данном случае CuCl2) протекает по катиону соли. Избыток ионов H+ в растворе обусловливает кислую реакцию среды в растворе (рН<7).
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4).
CH3COO– + NH4+ + H2O =CH3COOH + NH4OH.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания. Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Al2S3 + 6 H2O = 2Al(OH)3↓ + 3H2S.
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса небходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
г) Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, RbBr и др.) гидролизу не подвергаются
2. Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.[1]
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция
нулевого порядка
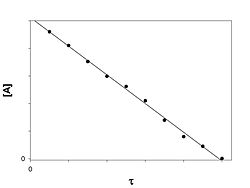 График зависимости концентрации
реагента A в реакции A → B от времени для
нулевого порядка реакции
График зависимости концентрации
реагента A в реакции A → B от времени для
нулевого порядка реакции
Кинетическое
уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
