
- •Дофаминовые рецепторы
- •3.4. Классификация дофаминовых рецепторов
- •3.4. Классификация дофаминовых рецепторов
- •3.5. Эффекторные системы дофаминовых рецепторов
- •Гипотетическая модель связывания агонистов и антагонистов с дофаминовыми рецепторами передней доли гипофиза свиней
- •3.6. Солюбилизация ______дофаминовых рецепторов_____
- •3.7. Молекулярные механизмы
- •3.8. Дофаминовые рецепторы сердечно-сосудистой системы____
- •3.12. Дофаминовые ________рецепторы надпочечников
- •3.13. Дофаминовые рецепторы — _______мишень действия лв_________
3.4. Классификация дофаминовых рецепторов
Дофамиповые рецепторы в настоящее время классифицируют по величинам связывания дофаминовых радиолигаидов с дофамшювыми рецепторами различных тканей в присутствии агоиистов и антагонистов. Исследователи были вынуждены принять этот принцип классификации, так как не удалось найти корреляции между биохимическими и фармакологическими эффектами дофаминергических средств и их сродством к тем или иным дофамииовым рецепторам.
Следует подчеркнуть, что принцип множественности, сформулированный нами для любого типа рецепторов, находит подтверждение и для дофамииовых рецепторов.
Первоначально все дофамиповые рецепторы были разделены только па два тина: ос-дофамипергические и (i-дофамипер-гические [Kebabian J.W., 1978], но это оказалось неудобным в связи с возможной путаницей с а- и р-адренореценторами. Поэтому дофамшювые рецепторы стали именовать как Д, и Д2-рецепторы [Kebabian J.W., CalneD.B., 1979]. Д^рецепторы — это дофамиповые рецепторы, которые сопряжены с дофамип-чувствителыюй адепилатциклазой, а Д2-реценторы — это дофамиповые рецепторы, которые не сопряжены с дофаминчувстви-телыюй адеиилатциклазой. Однако такое разделение дофаминовых рецепторов оказалось неприемлемым, поскольку, во-первых, имели место противоречия в данных о присутствии или
отсутствии дофаминчувствителыгай аденилатциклазы в различных тканях [Kebabian J.W., 1978; Miller R., McDermed J.D., 1979]; во-вторых, нет корреляции между выраженностью фармакологических эффектов дофаминергических агонистов и антагонистов и величиной их влияния на активность аденилатциклазы [Seeman P., List S., 1982]. В последующем было предложено делить все дофаминовые рецепторы на четыре типа [Davis А., 1982; Seeman P., ListS., 1982].
Д1-рецепторы —это рецепторы, сопряженные с дофаминчув-ствителыюй адеиилатциклазой безотносительно к тому, сопряжен или нет этот фермент с другими дофаминовыми рецепторами, и без связи с какими-либо поведенческими эффектами. Д^рецепторы стимулируются микромолярными концентрациями дофамипа (1 — 10 мкМ) и подавляются микромолярными концентрациями большинства нейролентиков.
Д2-реценторы — это рецепторы, которые чувствительны к ми-кромоляриым концентрациям дофамина и паномолярным концентрациям иейролептиков (0,1—30 иМ).
Д3-рецепторы —это рецепторы, которые чувствительны к папомоляриым концентрациям (1 — 10 нМ) дофамипа и микромолярным концентрациям нейролептиков.
Д4-рецепторы—это рецепторы, которые чувствительны к iiauo-молярным концентрациям дофамина и нейролептиков (схема 6).

При идентификации того или иного тина дофаминовых рецепторов нет необходимости связывающие участки делить на агонистические и антагонистические, поскольку величина Юзд вытеснения дофаминергическими веществами различных радиолигандов примерно одинакова. Иллюстрацией этого может служить табл.9.
Таблица 9.
Величины 1С50 вытеснения дофаминергическими веществами
3Н-лигандов из их связи с Д2-рецепторами мембран полосатого
тела головного мозга теленка в наномолярной концентрации
'Н-лнганд Дофаминергическое вещество 'Н-спи перок, •0.15 нМ 'Н-дигидро-эргокриптин. 'Н-бромкрпп-тин, 0.2 мМ 0.7 нМ Спиперон 0,7 0.7 0,8 Пимозид 4,4 2,4 1,9 Галоперидол Клозапнн 16 300 16 200 12 220 Апоморфин Дофамин 1350 5400 230 4500 970 8500 Примечание. Таблица составлена по данным A.Clossc и соавт. (1980) и М. Titeler(1977).
Согласно приведенной классификации дофамшювых рецепторов, участки мембран полосатого тела головного мозга теленка, связывающие с высоким сродством 3Н-дофамин или 3Н-апоморфин, представляют собой Д3-рецепторы [List S. et al., 1979,1980; List S., Seeman P., 1980].Д3-Реценторы не являются артефактом замораживания и отличаются от Д2-реценторов [Seeman P., ListS., 1982].
На рис. 36 представлены кривые экспериментов по конкуренции, позволяющие дифференцировать Д3- и Д4-реценторы. Видно, что величины Ю^—вытеснения дофамином и сшшероном 3Н-дофамина равны 5 и 1500 нМ соответственно; это свидетельствует о связывании 3Н-дофамииа с Д3-рецепторами.
Ипгибировапие нейролептиками связывания 3Н-АДТН и 3Н-аноморфипа было более сложным. В низких концентрациях (0,1—50 нМ) они иигибировали связывание этих ли-гандов с Д4-рецепторами, а в высоких концентрациях (200 — 2000 нМ) с Д3-рецепторами [Titeler М., 1979; List S., Seeman P., 1980; ListS. etal., 1980].
Рис. 36. Результаты конкурентных экспериментов, позволяющих дифференцировать Д,- и Д.-рецепторы в гомогенате полосатого тела крыс [Seeman P., List S., 1982].
В случае Д3-рсцепторов для дофамина величина 1C,,,находится между 1 и 10 нМ, а для нсйролсптиков Юзд между 200 и 2000 нМ. В случае Д4-рецепторов для дофамина IC^ находится между 1 и 10 нМ, а для нейролептиков между 0,1 и 10 нМ. Как Д3-, так и Д4-рсцепторы метятся 3Н-(±)-АДТН и 3Н-апоморфином. По оси абсцисс — концентрация немеченых лигандов в молях. По оси ординат — величина связывания лигандов, меченных тритием, с дофаминовыми рецепторами в процентах. Специфическое связывание 3Н-лигандов определялось по ингибирова-нию связывания апоморфином (1 мкМ), дофамином (1 мкМ) или (+)-бутакталамо-лом (1 и 10 мкМ).
Следует отметить, что величины IC^ конкуренции нейролептиков с 3Н-апоморфином за связывание с Д3- и Д4-рецепто-рами зависят от экспериментальных условий; от конечной концентрации 3Н-апоморфипа [Liesen J.E. et al., 1980], методов определения неспецифического связывания и добавления мембранной фракции до или после добавления других ингредиентов инкубационной смеси [List S. et al., 1980].
При идентификации того или иного тина дофаминовых рецепторов нет необходимости связывающие участки делить на агонистические и антагонистические, поскольку величина Юзд вытеснения дофаминергическими веществами различных радиолигандов примерно одинакова. Иллюстрацией этого может служить табл.9.
Таблица 9.
Величины 1С50 вытеснения дофаминергическими веществами
3Н-лигандов из их связи с Д2-рецепторами мембран полосатого
тела головного мозга теленка в наномолярной концентрации
'Н-лнганд Дофаминергическое вещество 'Н-спи перок, •0.15 нМ 'Н-дигидро-эргокриптин. 'Н-бромкрпп-тин, 0.2 мМ 0.7 нМ Спиперон 0,7 0.7 0,8 Пимозид 4,4 2,4 1,9 Галоперидол Клозапнн 16 300 16 200 12 220 Апоморфин Дофамин 1350 5400 230 4500 970 8500 Примечание. Таблица составлена по данным A.Clossc и соавт. (1980) и М. Titeler(1977).
Согласно приведенной классификации дофамшювых рецепторов, участки мембран полосатого тела головного мозга теленка, связывающие с высоким сродством 3Н-дофамин или 3Н-апоморфин, представляют собой Д3-рецепторы [List S. et al., 1979,1980; List S., Seeman P., 1980].Д3-Реценторы не являются артефактом замораживания и отличаются от Д2-реценторов [Seeman P., ListS., 1982].
На рис. 36 представлены кривые экспериментов по конкуренции, позволяющие дифференцировать Д3- и Д4-реценторы. Видно, что величины Ю^—вытеснения дофамином и сшшероном 3Н-дофамина равны 5 и 1500 нМ соответственно; это свидетельствует о связывании 3Н-дофамииа с Д3-рецепторами.
Ипгибировапие нейролептиками связывания 3Н-АДТН и 3Н-аноморфипа было более сложным. В низких концентрациях (0,1—50 нМ) они иигибировали связывание этих ли-гандов с Д4-рецепторами, а в высоких концентрациях (200 — 2000 нМ) с Д3-рецепторами [Titeler М., 1979; List S., Seeman P., 1980; ListS. etal., 1980].
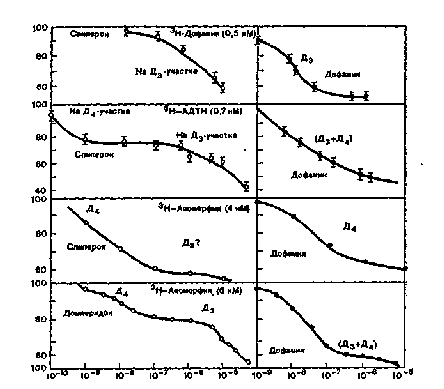
Рис. 36. Результаты конкурентных экспериментов, позволяющих дифференцировать Д,- и Д.-рецепторы в гомогенате полосатого тела крыс [Seeman P., List S., 1982].
В случае Д3-рсцепторов для дофамина величина 1C,,,находится между 1 и 10 нМ, а для нсйролсптиков Юзд между 200 и 2000 нМ. В случае Д4-рецепторов для дофамина IC^ находится между 1 и 10 нМ, а для нейролептиков между 0,1 и 10 нМ. Как Д3-, так и Д4-рсцепторы метятся 3Н-(±)-АДТН и 3Н-апоморфином. По оси абсцисс — концентрация немеченых лигандов в молях. По оси ординат — величина связывания лигандов, меченных тритием, с дофаминовыми рецепторами в процентах. Специфическое связывание 3Н-лигандов определялось по ингибирова-нию связывания апоморфином (1 мкМ), дофамином (1 мкМ) или (+)-бутакталамо-лом (1 и 10 мкМ).
Следует отметить, что величины IC^ конкуренции нейролептиков с 3Н-апоморфином за связывание с Д3- и Д4-рецепто-рами зависят от экспериментальных условий; от конечной концентрации 3Н-апоморфипа [Liesen J.E. et al., 1980], методов определения неспецифического связывания и добавления мембранной фракции до или после добавления других ингредиентов инкубационной смеси [List S. et al., 1980].
Согласно данным I. Creese и соавт. (1978), дофамип в низких концентрациях не влияет па связывание 3Н-апоморфи-на; для него величина 1СМ равняется 250 пМ, а для спипе-рона 0,5 нМ. Эти величины типичны для Д2-рецепторов и свидетельствуют о том, что в данных экспериментальных условиях 3Н-апоморфип не связывался с Д.,-рецепторами. Причиной этого может быть использование высоких концентраций аскорбиновой кислоты без ЭДТА (известно деструктивное действие аскорбиновой кислоты в отсутствие ЭДТА на дофами-новые рецепторы).
По нашему мнению, при сравнении результатов, полученных различными авторами, необходимо также учитывать вариабельность дофаминовых рецепторов, связанную с генетическим различием. О генетическом контроле дофаминовых рецепторов в головном мозге мышей чистых линий сообщили R.Bohme и R.Ciaranello (1983). Для получения информации о Д2-рецепторах, имеющих высокое сродство к дофамиперги-ческим антагонистам, они использовали 3Н-домперидоп. У мышей линий С57В1/6, DBA/2, AKR и C57L имеются различия в числе Д2-рецепторов в полосатом теле, зрительных буграх и гипофизе. Поскольку плотности дофамиповых рецепторов в этих трех областях головного мозга мышей изучаемых линий не коррелировали между собой, можно полагать, что число дофамиповых рецепторов в каждой области контролируется генетически независимо друг от друга. Анализ Д2-рецепторов у рекомбинантпых мышей имбредных линий показал, что они могут детерминироваться мопогенетически.
A.T.Gower и соавт. (1982) продемонстрировали гетерогенность дофамииовых рецепторов ЦНС фармакологическими методами. Анализ влияния различных дофамиповых средств па поведение крыс показал, что эффект агонистов на вращение в противоположную сторону опосредуется двумя различными классами дофаминовых рецепторов, которые отличаются от дофаминовых рецепторов, опосредующих стереотипию поведения. Центральные дофамиповые рецепторы авторы классифицируют по их чувствительности к апоморфину или 2, 3, 4, 5-тетрагидро-7, 8-диокси-фепил-1Н-3-бензазешшу (ТДФБ); ТДФБ-чувствительпые рецепторы блокируются клозапипом, по не галоперидолом, пимозидом и флуфепазином и разделяются па два подкласса, которые отличаются между собой но чувствительности к клозапину и локсапину. Однако, как эти рецепторы соотносятся с Д,-, Д2-, Д3 и Д4-рецепторами, выявляемыми биохимически, пока неизвестно.
В соответствии с приведенными данными и результатами анализа химической структуры дофаминовых рецепторов с помощью рекомбипантной технологии можно констатировать, что существует не менее пяти типов дофаминовых рецепторов Д(, Д2, Д3, Д4, Д5. Они различаются по чувствительности к дофами-иу и пейролептику спинерону. Д,-рецепторы стимулируются дофамином и блокируются спипероном в микромолярных концентрациях. Д2-участки чувствительны к дофамину в микромолярных, а к сиипероиу в иапомолярных концентрациях. Д3-реценторы, напротив, связывают дофамин в паномолярных, а сшшероп в микромолярных концентрациях. Д4 - связывают дофамин и спиперон в наиомолярных концентрациях [Seeman P., List S. 1981, 1982]. Д5- рецепторы, при сходном с Д,-рецеп-торами фармакологическом профиле, в 10 раз более чувствительны к дофамину, чем последние [Sunahara R.K., Guan H.C., O'Dowd B.F. etal., 1991].
С помощью генной инженерии идентифицировано 5 генов, соответствующих типам рецепторов дофамина. Эти гены подразделяются па два семейства: гены не содержащие нитронов и кодирующие Д, и Д5 типы рецепторов, а также гены, содержащие нитроны и кодирующие Д2-, Д3- и Д4-рецепторы. Обнаружено два варианта Д2 и три варианта Д3-рецепторов [Fears R., Bowen W.P., Brown F. et al., 1993, Schwartz J.C. 1993, Spano P.F., Memo M. 1993]. Размеры всех этих рецепторов близки: Д,-466, Д2-433 и 414 (из одного гена образуются два белка), Д3-400, Д4-387, Д5-477 аминокислотных остатков. Все рецепторы гомологичны и имеют 7 трансмембраниых домена [Авдонин П.В., Ткачук В.А. 1994]. Д2- и Д3-рецепторы имеют преимущественно нресииаптическую локализацию; постсинаптические рецепторы представлены Д)( Д2, Д3, Д4 и Д5-рецепторами [Раевский К.С. 1995].
Агопистами Д^рецепторов являются такие соединения как СКФ 38393 (наибольший процент его специфического связывания с мембранами мозга достигается в фосфатном буфере при 0° С, когда Kd=5,8 иМ, Втах=384 фМ/мг белка) [Cereska K.Z., Zharkovsky A.M. 1988], А68930 [De Ninno M.P., Schoenleber R., Mac Kenzie R. et al., 1991, De Ninno M.P., Shoenleber R., Mac Kenzie R. et al., 1991, Grenader A., Healy D.P. 1992], дигидроксе-ДШ1—агонист периферических Д^рецепторов, феполдопам. Ибо-намии и апоморфип неселективные агонисты дофаминовых рецепторов [Coudert P.,Rubal C.,Bastide M.,Malhuret R., Chopineau J. 1993, Kohli J.D., Horn P.T., Glock D. et al., 1993, Motlola D.M.,Brewster W.K., Cook L.L. et al., 1992]. Антагонистами Д^рецеито-ров является SCH-23390 [(К-(+)-8-хлор-2, 3, 4, 5 тетра-гидро-3-метил-5 фенил-14-3-бензазепин], который обладает слабым центральным Д2-блокирующим действием и является сильным антагонистом Д,-реценторов периферических сосудов [Hilditch A., Drew G.M., Naylor R.J. 1984]. SCH-23390 связывается с сосудами почек с Kd=4,2 нМ, 6^=180,6 фМ/мг белка [Amenta F., Ricci A. 1990], с пупочной артерией Kd=l,2 нМ, Вгшх=38,2 фМ/мг белка [Ferreira de Almeida J.A., Pereira Leite L., Cavallotti C. et al., 1993], квиппирол—антагонист Д,-рецепторов связывался с мембранами переднего мозга с Kd=9,5 нМ, В тах=38,2 фМ/мг сухого веса [Gehlert D.R., Gackenheimer S.L., Seiman P., Schaus J. 1992]. Ок-топамин—эндогенный блокатор Д,-рецепторов [Cheng T.T., Tsai Т.Т. 1990, 1991]. NNC-112, NNC-687 и NN-756-новые избирательные антагонисты Д,-рецепторов бензазепиновой природы [Andersen P.H., Gronvald F.C., Hohlweg R. et al., 1992, Nielsen E.B., Andersen P.H. 1992]. Галоперидол и флунентиксол наряду с Д,-рецепторами блокируют и Д2-реценторы [Koshikawa N., Mori Е., Maruyama Y. et al., 1990].
Д,-рецепторы разных видов животных сходны между собой [Watts V.T., Lawler C.P., Crilmere J.H. et al., 1993]. Количество и аффинность Д,-рецепторов зависят от присутствия агоииста или антагониста. На изолированных мембранах стриатума до-фамин снижал аффинность и плотность Д,-рецепторов, а антагонисты при хроническом введении увеличивали их количество, но не аффинность [O'Boyle K.M., Gavin K.T., Harrison N. 1993]. В мозге в присутствии высоких концентраций дофамина Д,-рецепторы переходят в высокоаффинное состояние и стабилизируются в этой конформации. При низких концентрациях дофамина высокоаффинные рецепторы переходят в низкоаффинное состояние [Herve D., Trovero F., Blanc G. et al., 1992].
Д2-рецепторы являются гликопротеидами [.Abbott W.M., Strange P.G., 1995]. Их агонисты представлены следующими соединениями: LY-141865 [Ruffolo R.R., Shaar C.J., 1983], N-04334 (в 200 раз активнее LY141865) [Horn A.S., Tepper R., Kebabian J.W. et al., 1984], ВНТ-920 [Pichler L., Pifl С., Hornykiewiez О., Kobinger W., 1987], И-6644В и И-68553В (агонисты Д2- ауторецепторов) [Riercey M.F., Brodevick P.A., Hoffmann W.E. et al., 1990], каберголин [Kimmig R., 1995], RU24213 и RH24946 (также антагонисты ониоидных рецепторов) [Fortin M., Degryse M., Petit F. et al., 1991], талипексол [Kropf W., Kuschinsky K., 1991], NCO920 [Hogberg Т., Strom P.,
Hall H. et al., 1990], бромокринтип, квинпирол [Horn A.S., Tepper R., Kebabian J.W. et al., 1984]. Антагонисты Д2-рецепторов: домиеридон (YM09151-2) [Teral M.,Hidaka K.,Nakamura Y., 1989], мосанрамин (Y-516) [Uchihashi Y., Morimoto Т., Tadokoro S. 1992], оканеридоп (R79598) [Megens A.A.H.P., Awouters F.H.L., Meert T.F. et al., 1992], бензамиды (сульпирид, тропа-нрид, снектрамид, раклоприд, этиклоприд), спиперон [Amalric M., Merhow M., Polis J. et al., 1990].
Антагонист Д2-рецепторов [3Н]-спиперон связывался с мембранной фракцией таламуса крысы с Kd=0,l нМ, Втах=6,4 фМ/ мг белка [Young К., Wilcox R.E., 1991], хвостатого ядра теленка с Kd=0,16 нМ, 3^=21,5 нМ/г ткани [Johansson A.M., Nordvall G., Hacksell W., 1991]. Антагонист Д2-рецепторовтропаприд, производное бензамида, связывался с Д2-рецепторами мозга с Kd=0,03 иМ [Schotte A., Janssen P.F.M., Veruimp M. et al., 1992].
Во взаимодействии Д2-антагонистов бензамидной структуры основную роль играют N-бензильные и N-алкильные группы. В структуре активной поверхности Д2-рецептора имеется 2 участка взаимодействия с N-алкильными заместителями [Pettersson J., SiljeforsT., 1992].
Обнаружен нелинейный характер кривой Скэтчарда для связывания [3Н]-сииперона с мембранами нейрогипофиза, что свидетельствует о наличии более чем одного класса участков связывания [Trieman M., Andersen P.H. 1989]. Возможно, это два пространственно раздельных участка связывания спиперо-иа, одна из которых имеет активную карбоксильную группу, а другая содержит карбоксил или остаток гистидина. Такое предположение основано па том, что М^'-дициклогексил карбоди-имид (реагент на свободные карбоксильные группы) эффективно угнетает связывание [3Н]-спипероиа. Кроме того, максимальное связывание [3Н]-сшшерона наблюдается при рН 7,5, что указывает на участие ионизированных остатков карбоксильных групп в связывании спиперона. Модификация гис-тидинового остатка в мембранах диэтилкарбонатом также ин-гибировала связывание спиперона, снижая сродство Д2-рецеп-тора к спиперону из-за аллостерического эффекта [Williamson R.A., Strange P.G. 1990, Woodward R., Daniel S.J., Strange P.G. et al., 1994]. По мнению других авторов Д2-рецепторы существуют в высокоаффинном и низкоаффинном состояниях по отношению к [3Н]-сшшерону. Первые связывают [3Н]-спи-нерон с Kd=0,2 —10 нМ и составляют 80% от общего числа участков связывания. Ионы Mg повышают аффинность Д2-ре-цепторов, а ГТФ трансформирует их в пизкоаффинные [De Vries D.J., Beart P.M. 1986]. Высокоаффипное состояние Д2-рецепторов обусловлено сопряжением рецепторов с G-белка-ми. Антитела к С концевому участку а субъедипицы белков G^ Go переводят рецепторы в низкоаффипиое состояние [Plug M.J., MollerW., Dijk J. 1992].
Конформация белка Д2-рецеитора регулируется также ионами натрия и водорода. Связывание агонистов с Д2-рецепто-рами уменьшается при добавлении ионов Na или снижении рН до 6,8. Связывание антагонистов беизамидпой структуры также уменьшается при снижении рН от 8,0 до 6,8, но увеличивается при добавлении ионов натрия. На связывание других антагонистов изменение рН существенно не влияет [Neve К.А., Henningsen R.A., Bunzow J.R., Civelli О. 1989, Ningsen R.A., Bunzow J.R., Civelli О. 1989].
Выделены две субъедипицы Д2-рецепторов, связывающие до-фамип. У свинок они имели Мг= 140000 и 90000, а у собак 94000 и 34000. Удаление сиаловой кислоты и карбогидратов выявило две субъединицы с Мг =44000 и 23000 как у свинок, так и у собак. Отличие в молекулярной массе Д2-рецепторов стриату-ма собак и свинок обусловлено их разным гликозилироваиием [Jarvie K.R., Niznik H.B., Seeman P. 1988]. Выявлены две изо-формы Д2-рецепторов, которые они отличаются между собой по отношению к замещенным бензамидам (раклоприд и суль-пирид), последовательностью 29 аминокислот в одном фрагменте и взаимодействием с G-белком. Существуют 2 изофор-мы мРНК Д2-рецептора. Д2 415-рецепторная мРНК присутствует в количестве 2 —45 % относительно мРНК исходной (Д2414) формы, встречается в мозге и печени.
Хроническое введение Д,, Д2-аптагониста галоперидола индуцирует гиперчувствителыюсть Д2-рецепторов путем увеличения плотности рецепторов и увеличения в 2 —4 раза количества мРНК [Giros В., Sokoloff P., Martres M.P., Schwartz J.C. 1990]. Так же действует сулышрид [Rogue P., Nanauer A., Zuiller J. et al., 1991]. Другие авторы не определяли увеличения мРНК Д2-рецепторов при увеличении плотности последних [Goss J.R., Kelly А.В., Johnson S.A., Morgan D.G. 1991] или наблюдали повышение уровня мРНК G0 белка, связанного с Д ^рецептором [Maus M., Vernier P., Valdenaire О. et al., 1993].
