
- •Минобрнауки россии
- •Теоретические основы анализа и эксперимента в нефтегазохимическом комплексе
- •Санкт-Петербург
- •Допущено
- •080502(5), 080502(Н) – Экономика и управление на предприятии нефтегазохимического комплекса
- •Введение
- •Выбор вариантов, и теоретических вопросов
- •Раздел 1 (Модуль 1) Теоретические основы химического анализа и эксперимента в нгхк Вариант I
- •Вариант II
- •Вариант III
- •Вариант IV
- •Вариант V
- •Вариант VI
- •Вариант VII
- •Вариант VIII
- •Вариант X
- •Библиографический список
- •Раздел 2. (Модуль 2) Теоретические основы физико-химического анализа и эксперимента в нгхк Вариант I
- •Вариант II
- •Вариант III
- •Вариант IV
- •Вариант V
- •Библиографический список
- •Минобрнауки россии
- •«Теоретические основы анализа и эесперимента в нефтегазохимическом комплексе»
Вариант V
В чем заключается сущность процесса созревания осадка?
Проба каменного угля содержит 4% серы. Какую навеску пробы следует взять для анализа, если серу осаждают и взвешивают в виде сульфата бария?
Сколько миллилитров 0,1 н. раствора AgNO3 требуется для осаждения всего хлора из 0,05 г хлористого натрия?
Почему
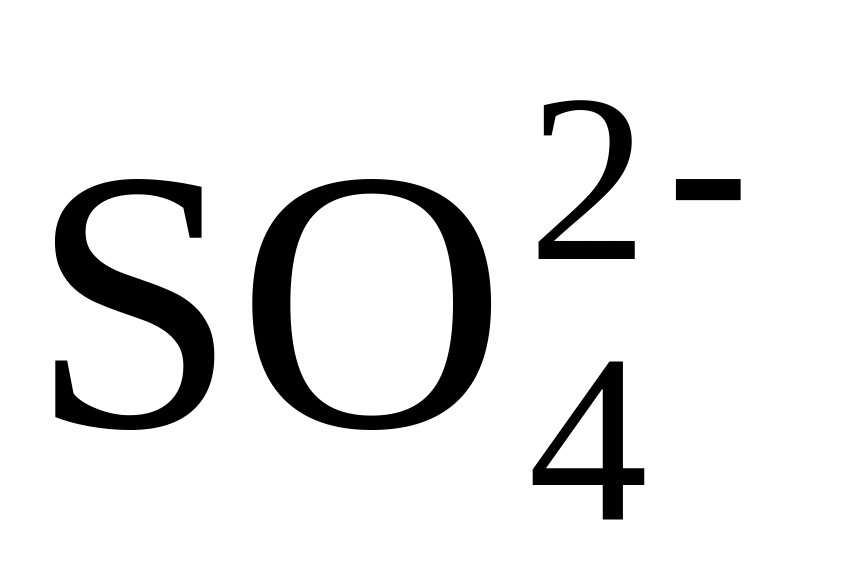 осаждают
BaCl2,
а не Ba(NO3)2?
осаждают
BaCl2,
а не Ba(NO3)2?Привести примеры прямого и обратного титрования, а также титрования замещения. Какие растворы называются нормальными?
Сколько миллилитров 2,00 н. раствора HNO3 нужно взять для приготовления 3 л 0,100 н. раствора?
Исследуемый образец Na2CO3 оттитрован 0,3 н. раствором H2SO4. Навеска образца равна 0,6440 г. Для полной нейтрализации этой навески требуется 35 мл H2SO4. Определить процентное содержание Na2CO3 в исследуемом образце.
Вариант VI
Приведите классификацию гравиметрических методов анализа.
В каких условиях получаются крупнокристаллические осадки?
Для определения общего содержания серы по методу Эшке взята воздушно-сухая навеска угля 0,985 г. После соответствующей обработки получено 0,1906 г BaSO4. Влага аналитическая составляет 1,2%. Вычислить процентное содержание серы в исходном образце и в сухой пробе.
Для чего раствор при осаждении BaSO4 подкисляют и нагревают?
В чем состоят задачи и сущность метода нейтрализации?
Сколько граммов КОН содержится в 200 мл 0,092 н. раствора?
Сколько нужно добавить 6 н. раствора вещества к 750 мл 2 н. раствора вещества, чтобы получить 3 н. раствор этого вещества?
Вариант VII
Обосновать выбор осадителя и определение его количества в гравиметрическом анализе.
Проба угля содержит 2% серы (в пересчете на сухую пробу) и 2% аналитической влаги. Какую навеску воздушно-сухого угля нужно взять для определения в нем серы?
Вычислить объем серной кислоты для осаждения ионов Ba2+, если для анализа взято 0,45 г хлорида бария. Осадитель – 2 н. раствор серной кислоты.
Обсудить условия осаждения
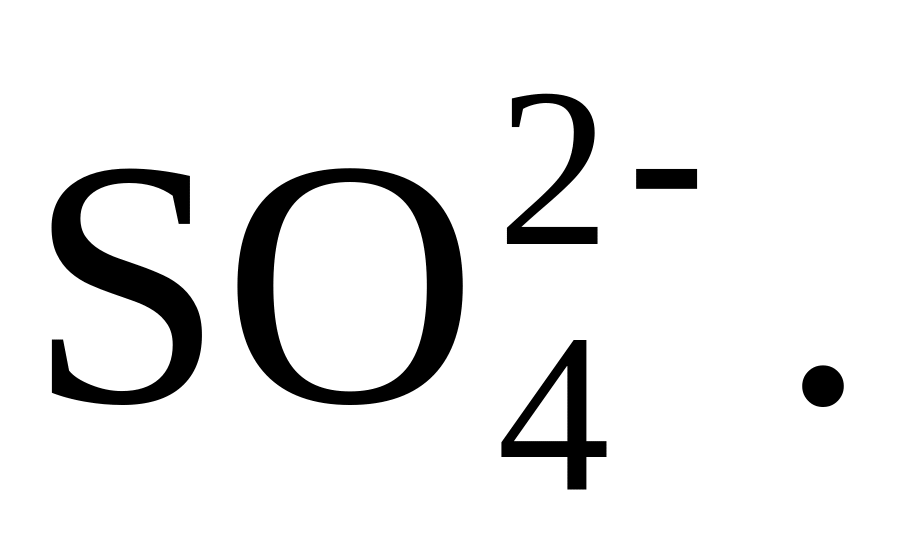 Почему это осаждение ведут в присутствии
HCl?
Почему это осаждение ведут в присутствии
HCl?Перечислить способы выражения концентрации рабочего раствора.
Чему равен титр 0,125 н. раствора H2SO4?
Сколько миллилитров концентрированной серной кислоты плотностью 1,84 г/см3, содержащей 96% H2SO4, нужно взять для приготовления 5 л 0,1 н. раствора?
Вариант VIII
Каким требованиям должны удовлетворять осадки в гравиметрическим анализе?
Из навески соединения Ba получен осадок BaSO4 весом 0,5864 г. Какому количеству граммов BaCl2·2H2O соответствует вес полученного осадка?
Сколько миллилитров 2 н. раствора хлорида бария потребуется для осаждения сульфат-иона, полученного при обработке 1,2 г угля, содержащего 3% серы?
Как определяют содержание кристаллизационной воды в кристаллогидратах? О чем свидетельствует достижение постоянной массы при этом?
По каким принципам и как классифицируются титриметрические методы анализа?
Дать характеристику понятий “титр по рабочему веществу” и “титр по определяемому веществу”.
Сколько миллилитров 0,42 н. раствора HCl потребуется для нейтрализации аммиака, выделенного из 400 мл вещества, содержащего 8% NH3?
Вариант IX
В чем состоит сущность гравиметрического (весового) метода анализа и каковы его задачи?
Растворимость Ag2CO3 при 20°С равна 3,17·10–2 г/л. Вычислить произведение растворимости.
Рассчитать, какую навеску кристаллического хлорида бария (BaCl2·2H2O) следует взять, чтобы масса осадка была равна 0,5 г.
Почему осаждают BaCl2, а не Ba(SO3)2?
Что такое точка эквивалентности и как она фиксируется?
Дайте определение понятий “эквивалент”, “нормальность раствора”.
Исследуемый образец Na2CO3 оттитрован 0,3 н. раствором H2SO4. Навеска образца равна 0,6440 г. Для полной нейтрализации этой навески требуется 35 мл H2SO4. Определить процентное содержание Na2CO3 в исследуемом образце.
