
- •Вимоги безпеки під час роботи
- •Визначення основних фізичних констант огранічнихречовин
- •Температура плавлення
- •Температура кипіння
- •Хід роботи
- •Дослід 2 Відкриття вуглецю та водню.
- •Дослід 3 Відкриття азоту.
- •Контрольні питання
- •Дослід 1 Отримання метану та вивчення його властивостей.
- •Дослід 2 Отримання етилену та вивчення його властивостей.
- •Дослід 3. Отримання ацетилену та вивчення його властивостей
- •Дослід 4. Окислення ароматичних вуглеводнів.
- •Контрольні питання
- •Завдання
- •Завдання
- •Завдання
- •Завдання.
- •Завдання
- •Завдання
- •Завдання
Завдання
1.Поясніть здійснення таких перетворень:
1 2
тристеарин →гліцерин → гліцерат міді (ІІ)
↑ 3
тріолеїн
2.Напишіть структурні формули: а) тристеарину, б) олеопальмітостеарину.
3.Закінчіть запропоновану схему хімічної реакції:
ОН-
диолеїностеарин + Н2О →
4.За допомогою якої реакції можна відрізнити тристеарин від тріолеїну?
5.Яка реакція полягає у основі перетворення рослинних олій у тверді жири (маргарин)? Продемонструвати цю реакцію на прикладі тріолеїну.
Контрольні питання
1 Поширення в природі. Методи виділення ліпідів з рослинної сировини.
2 Класифікація ліпідів.
3 Будова та властивості простих ліпідів.
4 Будова та властивості складних ліпідів.
5 Біологічне значення ліпідів. Утворення мембранних ліпідних структур.
6. Омиляєма та неомиляєма фракції ліпідів в біологічних системах.
7. Жири – як запасні ліпіди.
8. Основні показники якості жирів.
9. Омилення жирів. Мила.
10. Біологічне і сільськогосподарське значення жирів.
ЛАБОРАТОРНЕ ЗАНЯТТЯ № 10
ВУГЛЕВОДИ.
Мета роботи: ознайомитися з номенклатурою, класифікацією, будовою та основними фізичними та хімічними властивостями вуглеводів. Навчитися писати структурні формули та рівняння реакції.
ХІД РОБОТИ
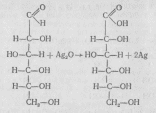
ДОСЛІД 1 Окислення глюкози оксидом срібла
І) — реакція срібного дзеркала.
Реактиви і матеріали. Глюкоза (10-процентний розчин). Нітрат срібла (1-процентний розчин). Гідроксид натрію (2 н розчин). Аміак (2 н розчин).
Обладнання. Штатив з пробірками. Тримач для пробірок. Спиртівка.
Пробірку для досліду потрібно знежирити — прокип'ятити з лугом, промити водою. У підготовлену для досліду пробірку наливають 4—5 крапель нітрату срібла і стільки саме гідроксиду натрію. До добутого чорного осаду доливають стільки розчину аміаку, щоб осад повністю розчинився і розчин став прозорим. В аміачний розчин оксиду срібла (І) добавляють половинну кількість розчину глюкози.
Вміст пробірки злегка нагрівають у полум'ї спиртівки до початку почорніння розчину. Потім реакція проходить без нагрівання. Металічне срібло виділяється на стінках пробірки У вигляді блискучого дзеркального нальоту.
AgNO3 + NaOH → AgOH ↓ + NaNO3
2AgOH → Ag2O + H2O
Ag2O + 4NH4OH → 2[Ag (NH3)2]OH + 3H2O
ДОСЛІД 2 . Реакція Селіванова на фруктозу.
Реактиви i матеріали. Фруктоза (3-процентний водний розчин). Резорцин кристалічний. Концентрована соляна кислота (р = 1,19 г/см3).
Обладнання. Штатив з пробірками. Тримач для пробірок. Спиртівка. Шпатель.
У пробірку вміщують кілька кристаликів резорцину, 4—5 крапель концентрованої соляної кислоти i стільки саме води. До добутого реактиву Ceлiвaнoвa добавляють 4—5 крапель розчину фруктози. Вміст пробірки нагрівають до кипіння. Piдина поступово забарвлюється в червоний колір.
3aмість резорцину можна використати таку саму кількість дифеніламіну. Реакційна суміш у цьому випадку забарвлюється в синій колір.
ДОСЛІД 3 Взаємодія лактози з гідроксидом міді (II).
Реактиви і матеріали. Лактоза (розчин). Гідроксид натрію (2н розчин). Сульфат міді (0,2 н розчин).
Обладнання. Штатив з пробірками. Тримач для пробірок. Спиртівка.
У пробірку наливають розчин лактози об'ємом 2—3 мл, половину кількості розчину лугу та розчин сульфату міді об'ємом 0,5 мл. Суміш перемішують і нагрівають у полум'ї спиртівки. Спостерігають утворення червоного осаду оксиду міді (І). Це свідчить про відновні властивості лактози.
ДОСЛІД 4. Кольорова реакція на сахарозу.
Реактиви і матеріали. Сахароза (10-процентний розчин). Сульфат або хлорид кобальту (2-процентний розчин). Гідроксид натрію (5-процентний розчин).
Обладнання. Штатив з пробірками.
У пробірку наливають розчин сахарози об'ємом 2—3 мл, розчин гідроксиду натрію об'ємом 2 мл і розчин сульфату або хлориду кобальту об'ємом 1 мл. Вміст пробірки перемішують. Розчин набуває фіолетового забарвлення. Реакція дуже чутлива і дає позитивні результати навіть при значному розведенні сахарози.
ДОСЛІД 5. Кислотний гідроліз сахарози.
Реактиви і матеріали. Сахароза (10-процентний розчин). Соляна кислота (2н розчин). Гідроксид натрію (2 н розчин. Сульфат міді (0,2 н розчин). Концентрована соляна кислота (ρ = 1,19 г/см3). Резорцин або дифеніламін (кристалічний).
Обладнання. Штатив з пробірками. Тримач для пробірок. Спиртівка.
У пробірку наливають розчин сахарози об'ємом 2—3 мл, 2 н розчин соляної кислоти об'ємом 1 мл і обережно нагрівають у полум'ї спиртівки 3—5 хв. Розчин поділяють на дві пробірки.
У першу пробірку добавляють розчин гідроксиду натрію об'ємом 2 мл, воду об'ємом 0,5 мл, а потім розчин сульфату міді об'ємом 0,5 мл. Вміст пробірки перемішують і нагрівають верхню частину синього розчину реакційної суміші до кипіння. З'являється цегляно-жовте забарвлення, що свідчить про утворення глюкози.
У другу пробірку до продуктів гідролізу сахарози вкидають 2—3 кристалики резорцину або дифеніламіну і добавляють концентровану соляну кислоту об'ємом 1 мл. Вміст пробірки перемішують і нагрівають до кипіння. З'являється червонувате або синє забарвлення, що свідчить про утворення фруктози. СІ2Н22О11 + Н2О → С6Н12О6 + С6Н12О6
Сахароза Глюкоза Фруктоза
ДОСЛІД 6. Реакція крохмалю з йодом.
Реактиви і матеріали. Крохмальний клейстер. Йод (спиртовий розчин).
Обладнання. Штатив з пробірками. Піпетка. Тримач для пробірок. Спиртівка.
У пробірку наливають крохмальний клейстер об'ємом 1 млі, добавляють воду об'ємом 1 мл і 1—2 краплі спиртового розчину йоду. Вміст пробірки перемішують. Розчин забарвлюється в синій колір.
Добутий темно-синій розчин нагрівають до кипіння. Забарвлення зникає, але під час охолодження знову з'являється .
ДОСЛІД 7. Розчинення целюлози в мідноаміачному реактиві та виготовлення ниток штучного волокна.
Реактиви і матеріали. Целюлоза (вата). Сульфат міді (2 н розчин). Гідроксид натрію (2 н розчин). Аміак (25-процентний розчин). Сірчана кислота (2 н розчин).
Обладнання. Хімічний стакан на 100 мл. Скляна паличка. Чашка Петрі. Пінцет.
У хімічний стакан наливають розчин сульфату міді об'ємом 5 мл і стільки саме розчину гідроксиду натрію. До утвореного осаду доливають розчин аміаку, щоб осад повністю розчинився. Спостерігають утворення темно-синього розчину (реактив Швейцера).
У добутий розчин опускають кульку з вати. Суміш перемішують скляною паличкою. Вата розчиняється, утворюється в'язкий розчин. Добутий розчин целюлози тоненьким струменем виливають у чашку Петрі з розчином сірчаної кислоти. Утворюються прозорі нитки волокна.
