
- •1. Закон действия масс и константа равновесия химической реакции.
- •7. Лимитирующее звено химической реакции
- •2. Законы распределения.
- •17. Реакции вблизи фурменной зоны доменной печи(дп).
- •19. Общая тд хар-ка реакций образ-я и термической диссоц-ии оксидов.
- •8. Порядок химической реакции
- •11. Реация горения со
- •13. Реакция водяного газа
- •12. Реакция горения водорода.
- •18.Упругость диссоциации оксидов.
- •14. Реакция вз-ия углерода с углекислым газом
- •9.Способы определения лимитирующего звена химической реакции
- •10.Тепловые эффекты реакций окисления и их влияние на организацию сталеплавильных процессов.
- •16) Взаимодей-ие углерода с водным паром.
- •15) Реакция полного и неполного горения углерода.
12. Реакция горения водорода.
Реакцию
горения водорода H2+1/2О2=H2O
(1) Качественную оценку изменения
параметров системы на протекание
реакции (1) можно выполнить при помощи
принципа Ле-Шателье и правила фаз Гиббса
С=k+n-f (2). В рассм системе k=2, f=1. Если же
из внешних факторов, влияющих на
состояние равновесия указано только
Т и Р, то из (2) следует С=3. То что у системы
3 степени свободы показывает на то, что
для однозначного определения равновесного
состава необходимо указать Т, Р и
какую-либо постоянную величину, связанной
с конц-цией взаимодействия. При увеличении
Т и p=const равновесие экзотерм реакции
(1) смещается в направлении диссоциации
H2O.
Горение протекает с уменьшением объема
взаим веществ. Поэтому с увеличением
Р при неизменной Т способствует
протеканию р-ии в направлении образования
дополнительного кол-ва H2O
если для сжигания H2
используется воздух, то в систему
вносится еще 1 компонент N2.
Введение в систему N2
при неизменных Т и р влияет на изменение
равновесного состава газовой смеси.
Константа равновесия (Кр)
р-ции 1 можно определить
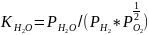 (3). Состав газовой смеси принято
выражать в объемных конц-циях, при этом
связь Р и объемной концентрации будет
(4) (%i) - конц-ция компонента i в объемных
процентах. Протекание реакции возможно
только при
тогда
(3). Состав газовой смеси принято
выражать в объемных конц-циях, при этом
связь Р и объемной концентрации будет
(4) (%i) - конц-ция компонента i в объемных
процентах. Протекание реакции возможно
только при
тогда
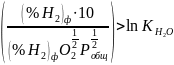 (5) Окислительный потенциал при
протекании р-и 1 может быть охарактеризован
(5) Окислительный потенциал при
протекании р-и 1 может быть охарактеризован
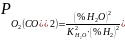 (6). Из 6 следует след-ие выводы: 1) 1) для
газовой смеси с постоянным соотношением
м/у H2O
и H2
величина равновесного парционального
Р зависит только от Т.(так как
зависит только от Т); 2)при
Т численное зн-ие Кр
,
а окислительный потенциал
;
3) при постоянной Т величина
опр-ся соотношением м/у объемными
концентрациями H2O
и H2,
а окислительный потенциал повышается
при ув-ии %-ного содержания H2O
и убывает при увеличении H2.
(6). Из 6 следует след-ие выводы: 1) 1) для
газовой смеси с постоянным соотношением
м/у H2O
и H2
величина равновесного парционального
Р зависит только от Т.(так как
зависит только от Т); 2)при
Т численное зн-ие Кр
,
а окислительный потенциал
;
3) при постоянной Т величина
опр-ся соотношением м/у объемными
концентрациями H2O
и H2,
а окислительный потенциал повышается
при ув-ии %-ного содержания H2O
и убывает при увеличении H2.
21.
Восстановление МеО газообразными
восстановителями. В
общем виде р-и м/у МеО и восстановителем
может быть записана МеО+В= Ме+ВО (1)
Реакцию 1 можно рассм как последовательное
протекание след р-цией МеО= Ме + ½ О2
и В + ½ О2=ВО
В соответствии с принятой схемой
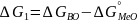 (2). Если в-ва взаимодействуют в СС с
учетом след. соот-я
(2). Если в-ва взаимодействуют в СС с
учетом след. соот-я
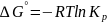 ур-е 2 можно привести к виду
ур-е 2 можно привести к виду
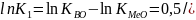 (3). Из 3 следует
(3). Из 3 следует
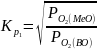 (4). Из формул 2 и 4 видно что направление
протекания р-и 1 в станд условиях м-о
установить из соотн-я станд значений
∆G
в реакции образования МеО и восстановителя
Ме. При этом, чем больше различие между
указанными Р-ми, тем больше численное
значение Кр
и полнота превращения. Если выполняется
след условия
(4). Из формул 2 и 4 видно что направление
протекания р-и 1 в станд условиях м-о
установить из соотн-я станд значений
∆G
в реакции образования МеО и восстановителя
Ме. При этом, чем больше различие между
указанными Р-ми, тем больше численное
значение Кр
и полнота превращения. Если выполняется
след условия
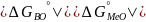 и
и
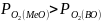 то система нах-ся в состоянии терм
равновесия. Если ж
то система нах-ся в состоянии терм
равновесия. Если ж
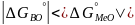 и
и
 то произвольное протекание р-ции
возможно лишь в направлении окисления
Ме. Если р-я 1 протекает в условиях,
отличающих от станд то вывод о направлении
р-и также может быть получен из соотношения
величин изменении энергии Гиббса
реакции образовании МеО и восстановителя
или значений равновесного парц давления
кислорода в газ фазе для этих реакции.
то произвольное протекание р-ции
возможно лишь в направлении окисления
Ме. Если р-я 1 протекает в условиях,
отличающих от станд то вывод о направлении
р-и также может быть получен из соотношения
величин изменении энергии Гиббса
реакции образовании МеО и восстановителя
или значений равновесного парц давления
кислорода в газ фазе для этих реакции.
