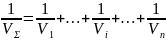- •1. Закон действия масс и константа равновесия химической реакции.
- •7. Лимитирующее звено химической реакции
- •2. Законы распределения.
- •17. Реакции вблизи фурменной зоны доменной печи(дп).
- •19. Общая тд хар-ка реакций образ-я и термической диссоц-ии оксидов.
- •8. Порядок химической реакции
- •11. Реация горения со
- •13. Реакция водяного газа
- •12. Реакция горения водорода.
- •18.Упругость диссоциации оксидов.
- •14. Реакция вз-ия углерода с углекислым газом
- •9.Способы определения лимитирующего звена химической реакции
- •10.Тепловые эффекты реакций окисления и их влияние на организацию сталеплавильных процессов.
- •16) Взаимодей-ие углерода с водным паром.
- •15) Реакция полного и неполного горения углерода.
1. Закон действия масс и константа равновесия химической реакции.
Рассмотрим
хим. реакцию (ХР), в которой участвуют
2 в-ва: А и В, в результате получается 2
в-ва: D
и E.
Эту ХР можно записать в след.виде:
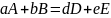 (1). Коэф. a,b,d,e
яв-ся стехиометрическими коэф. реакции.
Пусть параметры, кот-рые харак-ют ТД
состояние системы, остаются постоянными.Как
известно состояние системы может
харак-ваться параметрами:P,T,V.Поскольку
параметры, характеризующие ТД состояние
сис-мы остаются постоянными,то спустя
некот-ое время после начала взаимод-я
в сист-ме устанавл-ся неизменные во
времени консентрации продуктов реак-ции
и исход-х в-в.Это позволяет говорить о
достижении системой,сост-я ТД равновесия,
при кот-ом V прямой и обратной реакции
становятся равными. В качестве модели
ХР примем след.модель: будем рассматривать
молекулы как мат.точки,а для протекания
ХР будем считать,что достаточно,чтобы
в какой –то момент времени частицы
взаимодействующих вещ-в оказались в
одной точке простр-ва. Вероятность
появления в необх-ой точке простр-ва
молек-лы одного из реагентов прямо
пропорцион-а концентрациям реагентов,
то V ХР оказывается прямопропор-о
произвелению концентрации взаимодест.в-в,
возведен-х в степени равными
стехиометрическим коэфт-ам в ур-ии
р-ции.
(1). Коэф. a,b,d,e
яв-ся стехиометрическими коэф. реакции.
Пусть параметры, кот-рые харак-ют ТД
состояние системы, остаются постоянными.Как
известно состояние системы может
харак-ваться параметрами:P,T,V.Поскольку
параметры, характеризующие ТД состояние
сис-мы остаются постоянными,то спустя
некот-ое время после начала взаимод-я
в сист-ме устанавл-ся неизменные во
времени консентрации продуктов реак-ции
и исход-х в-в.Это позволяет говорить о
достижении системой,сост-я ТД равновесия,
при кот-ом V прямой и обратной реакции
становятся равными. В качестве модели
ХР примем след.модель: будем рассматривать
молекулы как мат.точки,а для протекания
ХР будем считать,что достаточно,чтобы
в какой –то момент времени частицы
взаимодействующих вещ-в оказались в
одной точке простр-ва. Вероятность
появления в необх-ой точке простр-ва
молек-лы одного из реагентов прямо
пропорцион-а концентрациям реагентов,
то V ХР оказывается прямопропор-о
произвелению концентрации взаимодест.в-в,
возведен-х в степени равными
стехиометрическим коэфт-ам в ур-ии
р-ции.
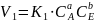 -V
скор-ть прям. ХР (2)
-V
скор-ть прям. ХР (2)
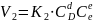 -Vобрат-й
ХР (3). Когда ХР достигает сост-я
равновесия, то V прямой и обр-ой реак-ии
равны. (2)+(3)->(4):
-Vобрат-й
ХР (3). Когда ХР достигает сост-я
равновесия, то V прямой и обр-ой реак-ии
равны. (2)+(3)->(4):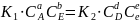 (4) Из(4)=>,что
(4) Из(4)=>,что
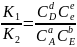 =K
(5) При неизмен-й Т,const
V
ХР яв-ся постоян-ми величинами, и их
отношение также яв-ся постоянной вел-ой,
кот-я наз-ся const
равновесия ХР. Ур-е (5) яв-ся математ-ой
записью закона дейст-я масс(ЗДМ). ЗДМ:В
условиях равновесия ХР при пос-ой Т
отн-ие произв-я конц-ций продуктов
реак-ии, возвед-х степени, равные
стехеометр-им коэф-ом в ее ур-ии к
произвед-ю конц-ции исх-х в-в, возведенных
в соот-ей степени яв-ся постоянной
величиной. Если в ХР принимают участие
в-ва, кот-ые в газообр-м сост-ии, то
конц-ции этих в-в, заменяют их парциальн.
Р:
=K
(5) При неизмен-й Т,const
V
ХР яв-ся постоян-ми величинами, и их
отношение также яв-ся постоянной вел-ой,
кот-я наз-ся const
равновесия ХР. Ур-е (5) яв-ся математ-ой
записью закона дейст-я масс(ЗДМ). ЗДМ:В
условиях равновесия ХР при пос-ой Т
отн-ие произв-я конц-ций продуктов
реак-ии, возвед-х степени, равные
стехеометр-им коэф-ом в ее ур-ии к
произвед-ю конц-ции исх-х в-в, возведенных
в соот-ей степени яв-ся постоянной
величиной. Если в ХР принимают участие
в-ва, кот-ые в газообр-м сост-ии, то
конц-ции этих в-в, заменяют их парциальн.
Р:
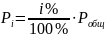 (6)
(6)
7. Лимитирующее звено химической реакции
Обычно ХР явл-ся
результатом последовательного протекания
большого кол-ва отдельных их звеньев,
связанных с массой переноса реагентов
в объеме взаимодействующих фаз к месту
протекания реакции, адсорбцией и
десорбцией их на межфазных поверхностях,
химическим взаимодействием атомов
или молекул участвующих в реакции в-в,
массой переноса продуктов взаимодействия
и др. Из усл-ия стационарности перемещения
в-ва ур-ие, которое связывает суммарную
ск-ть ХР со ск-тью отдельных ее звеньев,
может быть получено в виде:
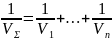 (1) , где V
Σ –
суммарная ск-ть ХР; v – ск-ти отдельных
звеньев реакции. Согласно ур-ию (1)
обратная ск-ть ХР равна сумме обратных
ск-тей отдельных ее звеньев. Анализ
ур-ия (1) показывает, что суммарная ск-ть
ХР всегда меньше ск-ти наиболее медленного
ее звена. При соизмеримой ск-ти отдельных
звеньев ХР резкое уменьшение скорости
какого-либо ее звена приводит к
аналогичному уменьшению суммарной
ск-ти реакции. Допустим, например, что
в первом из звеньев процесс практически
прекратится:
(1) , где V
Σ –
суммарная ск-ть ХР; v – ск-ти отдельных
звеньев реакции. Согласно ур-ию (1)
обратная ск-ть ХР равна сумме обратных
ск-тей отдельных ее звеньев. Анализ
ур-ия (1) показывает, что суммарная ск-ть
ХР всегда меньше ск-ти наиболее медленного
ее звена. При соизмеримой ск-ти отдельных
звеньев ХР резкое уменьшение скорости
какого-либо ее звена приводит к
аналогичному уменьшению суммарной
ск-ти реакции. Допустим, например, что
в первом из звеньев процесс практически
прекратится:
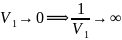
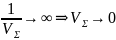 .
Однако в тех же условиях резкое
увеличение скорости одного из звеньев
реакции не может вызвать аналогичного
роста суммарной ее скорости. Так, на
пример, при пример, при V1→∞
.
Однако в тех же условиях резкое
увеличение скорости одного из звеньев
реакции не может вызвать аналогичного
роста суммарной ее скорости. Так, на
пример, при пример, при V1→∞
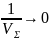 .
Cк-ть
ХР по-прежнему определяется ск-тью
наиболее медленных ее звеньев. Если
ск-ть одного из звеньев реакции намного
(в 100 раз и более) меньше ск-ти других
ее звеньев, остальными слагаемыми в
правой части ур-ия (1) с достаточной
точностью можно пренебречь и считать,
что суммарная ск-ть реакции определяется
ск-тью наиболее медленного ее звена.
Это звено, определяющее ск-ть реакции
в целом, принято наз-ть лимитирующим
звеном ХР. Одной из главных задач при
изучении кинетики металлургических
реакций обычно явл-ся опр-ие их
лимитирующего звена, воздействуя на
кот-е можно добиться значительного
роста ск-ти процесса.
.
Cк-ть
ХР по-прежнему определяется ск-тью
наиболее медленных ее звеньев. Если
ск-ть одного из звеньев реакции намного
(в 100 раз и более) меньше ск-ти других
ее звеньев, остальными слагаемыми в
правой части ур-ия (1) с достаточной
точностью можно пренебречь и считать,
что суммарная ск-ть реакции определяется
ск-тью наиболее медленного ее звена.
Это звено, определяющее ск-ть реакции
в целом, принято наз-ть лимитирующим
звеном ХР. Одной из главных задач при
изучении кинетики металлургических
реакций обычно явл-ся опр-ие их
лимитирующего звена, воздействуя на
кот-е можно добиться значительного
роста ск-ти процесса.