
- •5. Диаграммы состояния (фазового равновесия) сплавов
- •Компоненты и фазы в сплавах железа с углеродом
- •Легированные стали
- •Раздел I. Строение и свойства металлов 22
- •Раздел I. Строение и свойства металлов 22
- •Стали и сплавы для режущего инструмента
- •Особенности термообработки литейных сталей
- •Раздел VIII. Материалы на основе полимеров
- •Раздел I. Строение и свойства металлов 22
- •Раздел I. Строение и свойства металлов 22
- •Глава 38. Стали и сплавы пищевой промышленности
- •Биметаллы в пищевой промышленности
- •Наплавка износостойкими материалами
- •Раздел I. Строение и свойства металлов
- •Глава 1
- •Общая характеристика металлов и сплавов
- •Дефекты строения кристаллических тел
- •Степень переохлатдения- Температура
- •Глава 2 деформация и разрушение металлов
- •Свойства металлов и сплавов
- •Упругая и пластическая деформация
- •Хрупкое и вязкое разрушение
- •Факторы, определяющие характер разрушения
- •Наклеп и рекристаллизация
- •Глава 3
- •Металлографические методы испытаний
- •Испытания механических свойств
- •Специальные методы испытаний
- •3.7. Неразрушающие методы контроля
- •Раздел II. Строение и свойства сплавов
- •Глава 4
- •Характеристика основных фаз в сплавах
- •4.2. Структура сплавов
- •4.4. Пути упрочнения сталей и сплавов
- •Напряжение трения решетки
- •Содержание элементов, %
- •Глава 5
- •Основные типы диаграмм состояния
- •Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (II рода)
- •Раздел III. Железо и его сплавы
- •Глава 6
- •6.2. Диаграмма состояния системы железо - цементит (метастабильное состояние)
- •Глава 7 углеродистые стали
- •Общая характеристика
- •Влияние углерода на свойства стали
- •7.3. Влияние примесей на свойства стали
- •Классификация углеродистых сталей
- •Глава 8 легированные стали
- •Карбиды в легированных сталях
- •Классификация легированных сталей
- •Раздел I. Строение и свойства металлов 22
- •Маркировка сталей по национальным стандартам Японии
- •Глава 9 чугуны
- •Разновидности чугунов
- •9.2. Процесс графитизации чугунов
- •Легированные чугуны
- •Раздел IV. Термическая обработка стали
- •Глава 10
- •Общие сведения
- •Превращения в стали при нагреве.
- •Мартенситное превращение аустенита
- •Глава 11
- •Отжиг стали
- •Закалка стали
- •Отпуск стали
- •Поверхностная закалка
- •Азотирование стали
- •Раздел V. Промышленные стали и сплавы
- •Глава 13
- •Влияние модифицирования на ударную вязкость и критическую температуру хрупкости стали 08гфл
- •Глава 14 конструкционные стали
- •Общая характеристика
- •Цементируемые стали
- •Рессорно-пружинные стали
- •Судостроительные стали (гост 5521-93)
- •Марки и сортамент
- •Глава 15 инструментальные стали и сплавы
- •Стали для измерительного инструмента
- •Штамповые стали
- •Стали для штампов горячего деформирования
- •Глава 16
- •16.1. Общие сведения
- •Виды электрохимической коррозии
- •Оценка коррозионной стойкости
- •Методы защиты от коррозии
- •Глава 17
- •17.1. Жаростойкие стали (heat resistant steel)
- •Критерии жаропрочности
- •Раздел I. Строение и свойства металлов 22
- •Суперсплавы
- •Глава 18
- •Радиационно-стойкие материалы
- •Свойства и применение аморфных сплавов
- •Особенности наноструктурных материалов
- •Глава 19 литейные стали
- •19.1. Характеристика литейных сталей
- •19.4. Особенности применения литейных сталей
- •Глава 20
- •Общие сведения
- •Конструкционные материалы
- •Антифрикционные материалы (гост 26802-86)
- •Фрикционные материалы
- •Пористые фильтрующие элементы
- •Инструментальные порошковые стали
- •Карбидостали
- •Раздел VI. Цветные металлы и сплавы
- •Глава 21
- •Основные свойства магния
- •Деформируемые магниевые сплавы
- •Литейные магниевые сплавы
- •Применение магниевых сплавов
- •Глава 22
- •Основные свойства бериллия
- •Сплавы бериллия
- •Применение бериллия
- •Глава 23 алюминий и его сплавы
- •Основные свойства алюминия
- •Классификация алюминиевых сплавов
- •Деформируемые алюминиевые сплавы
- •Литейные алюминиевые сплавы
- •Маркировка алюминиевых сплавов
- •Глава 24
- •Основные свойства титана
- •Глава 25
- •Основные свойства меди
- •Сплавы меди с цинком, или латуни
- •25 3 Бронзы
- •25.4. Антифрикционные сплавы, припои, легкоплавкие сплавы
- •Раздел VII. Хладостойкие металлы и сплавы
- •Глава 26 хладостойкие стали
- •Общие сведения
- •Стали криогенной техники
- •Метастабильные аустенитные стали
- •Глава 27
- •Алюминий и его сплавы
- •27.2. Титан и его сплавы
- •Раздел VIII. Материалы на основе полимеров
- •Глава 28 характеристика полимеров
- •Состав и строение полимеров
- •Основные свойства полимеров
- •Раздел I. Строение и свойства металлов 22
- •Общая характеристика пластмасс
- •Термопластичные пластмассы (термопласты)
- •Раздел I. Строение и свойства металлов 22
- •Глава 30 резины
- •Глава 32 лакокрасочные материалы
- •Глава 33 стекло
- •Глава 34 древесина
- •Строение и химический состав древесины
- •34.3. Общая характеристика видов древесины
- •Изделия из древесины
- •Долговечность и консервация древесины
- •Глава 35
- •Общие сведения
- •Пластмассы
- •Клеящие материалы
- •Раздел IX. Керамические и композиционные материалы
- •Глава 36 керамические материалы
- •Глава 37 композиционные материалы
- •37.1. Общая характеристика и классификация
- •Волокнистые композиционные материалы
- •Слоистые композиты
- •Глава 38
- •Биметаллы в пищевой промышленности
- •Металлическая тара и упаковка
- •Раздел X. Покрытия в машиностроении
- •Глава 39
- •Глава 40 металлические покрытия
- •Цинковые покрытия
- •Оловянные и хромсодержащие покрытия
- •Наплавка износостойкими материалами
- •Лакокрасочные покрытия
- •Раздел XI. Проблемы выбора и применения
- •Глава 42
- •Технические условия и стандарты
- •Технологические свойства
- •Глава 43 примеры выбора материалов
Раздел I. Строение и свойства металлов
Глава 1
ОСНОВЫ КРИСТАЛЛОГРАФИИ И КРИСТАЛЛИЗАЦИИ
Общая характеристика металлов и сплавов
Металлы и их сплавы повсеместно используются для конструкций машин, оборудования, инструмента и т. д. Несмотря на широкий круг искусственно созданных материалов, керамики, клеев, металлы служат основным конструкционным материалом и в обозримом будущем по-прежнему будут доминировать.
В природе металлы встречаются как в чистом виде, так и в рудах, оксидах и солях. В чистом виде встречаются химически устойчивые элементы (Pt, Au, Ag, Hg, Си). Масса наибольшего самородка меди составляет 420 т, серебра - 13,5 т, золота - 112 кг.
Из 109 открытых элементов, представленных в периодической системе элементов Д. И. Менделеева (см. форзац), 22 являются неметаллами. Все элементы, расположенные левее жирной ступенчатой линии, проведенной от бора до астата (от № 5 до № 85) относятся к металлам, а правее - к неметаллам. Эта граница не является абсолютно строгой, среди элементов, расположенных вблизи гранцы, находятся и элементы, промежуточные между металлами и неметаллами, иногда называемые полуметаллами.
Металлические материалы обычно делятся на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы - цветными. Кроме того, все цветные металлы, применяемые в технике, в свою очередь, делятся на следующие группы:
легкие металлы Mg, Be, Al, Ti с плотностью до 5 г/см3;
тяжелые металлы Pb, Mo, Ag, Au, Pt, W, Та, Ir, Os с плотностью, превышающей 10 г/см3;
легкоплавкие металлы Sn, Pb, Zn с температурой плавления соответственно 232, 327, 410 °С;
тугоплавкие металлы W, Мо, Та, Nb с температурой плавления существенно выше, чем у железа (> 1536 °С);
благородные металлы Au, Ag, Pt с высокой устойчивостью против коррозии;
урановые металлы, или актиноиды (актиниды), используемые в атомной технике;
редкоземельные металлы (РЗМ) - лантаноиды, применяемые для модифицирования стали;
щелочные и щелочноземельные металлы Na, К, Li, Са в свободном состоянии применяются в качестве жидкометаллических теплоносителей в атомных реакторах; натрий также используется в качестве катализатора в производстве искусственного каучука, а литий - для легирования легких и прочных алюминиевых сплавов, применяемых в самолетостроении.
Свойства металлов разнообразны. Ртуть замерзает при температуре -38,8 °С, вольфрам выдерживает рабочую температуру до 2000 °С (7'11Л = 3410 °С), литий, натрий, калий легче воды, а иридий и осмий в 42 раза тяжелее лития. Электропроводность серебра в 130 раз выше, чем у марганца. Вместе с тем металлы имеют характерные общие свойства. К ним относятся:
высокая пластичность;
высокие тепло- и электропроводность;
положительный температурный коэффициент электрического сопротивления, означающий рост сопротивления с повышением температуры, и сверхпроводимость многих металлов (около 30) при температурах, близких к абсолютному нулю;
хорошая отражательная способность (металлы непрозрачны и имеют характерный металлический блеск);
термоэлектронная эмиссия, т. е. способность к испусканию электронов при нагреве;
кристаллическое строение в твердом состоянии.
Общее свойство металлов и сплавов - их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена изображением не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 1.1).
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния а, b и с между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1-0,7 нм, размеры элементарных ячеек 0,2-0,3 нм.
Для однозначного описания элементарной ячейки кристаллической решетки необходимо знание величин параметров а, Ь, с и углов между ними.
В 1848 г. французский ученый Бравэ показал, что изученные трансляционные структуры и элементы симметрии позволяют выделить 14 типов кристаллических решеток. Из 14 решеток Бравэ 7 являются простыми и строятся осевыми трансляциями к узлам ячейки, а 7 являются сложными и строятся трансляциями по точкам, находящимся либо в центре объема элементарной ячейки (объемноцентрированные), либо в центре грани ячейки (гране-
1/
/Г.
1
7|-
1
—4—.
1
|
к
/1,
1
/\
1
1C
/
/
I
/
—У~
/
![]() центрированные).
7 типов простых кристаллических решеток
представлены на рис. 1.2. В большинстве
случаев у реальных металлов решетки
более сложные, так как элементарные
частицы могут находиться не только в
узлах, но и на их гранях и в центре
решетки. На рис. 1.3 показаны три типа
элементарных ячеек кристаллических
решеток, наиболее харак-
центрированные).
7 типов простых кристаллических решеток
представлены на рис. 1.2. В большинстве
случаев у реальных металлов решетки
более сложные, так как элементарные
частицы могут находиться не только в
узлах, но и на их гранях и в центре
решетки. На рис. 1.3 показаны три типа
элементарных ячеек кристаллических
решеток, наиболее харак-
Рис. 1.1. Кристаллическая решетка
a=fi=90°,
f - T20
i*b*C, ОФбфС,
a
= $ = 90° Ji*30° a*fi*]*90o
Рис.
1.2. Основные типы кристаллических
решеток:
1
-
кубическая; 2
-
тетрагональная; 3 - ромбическая, 4
-
ромбоэдрическая; 5
- гексагональная;
6
-
моноклинная; 7 - триклинная

 терных
для металлов: объем- ноцентрированная
кубическая (ОЦК), гранецентриро-
ванная кубическая (ГЦК) и гексагональная
плотноупа- кованная (ГП), а также схемы
упаковки в них атомов.
терных
для металлов: объем- ноцентрированная
кубическая (ОЦК), гранецентриро-
ванная кубическая (ГЦК) и гексагональная
плотноупа- кованная (ГП), а также схемы
упаковки в них атомов.
 В
кубической гранецент- рированной
решетке (ГЦК; А1) атомы расположены в
вершинах куба и в центре каждой грани
(рис. 1.3, а).
В
кубической гранецент- рированной
решетке (ГЦК; А1) атомы расположены в
вершинах куба и в центре каждой грани
(рис. 1.3, а).
 В
кубической объемноцен- трированной
решетке (ОЦК;
В
кубической объемноцен- трированной
решетке (ОЦК;
Рис. 1.3. Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов:
А1 - гранецентрированная кубическая (ГЦК); А2 - объемноцентриро ванная кубическая (ОЦК); АЗ - гексагональная плотноупакованная (ГП) решетка
А2) атомы расположены в вершинах куба, а один атом - в центре его объема (рис. 1.3, б).
В гексагональной плотноупакованной решетке (ГП; АЗ) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома - в средней плоскости призмы (рис. 1.3, в).
Для характеристики кристаллических решеток введены понятия координационного числа и коэффициента компактности.
Координационным числом 1К называется число атомов, находящихся на наиболее близком равном расстоянии от данного атома. Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12.
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке помимо атомов имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки:
где R - радиус атома (иона); п - базис, или число атомов, приходящихся на одну элементарную ячейку; V - объем элементарной ячейки.
Для простой кубической решетки п = (1/8)- 8 = 1; V = а3 = = (2й)3и коэффициент компактности Q = 52 %.
Схема определения базиса ОЦК решетки приведена на рис. 1.4. На решетку ОЦК приходится два атома: один центральный и один как сумма от вершин куба, так как ячейке принадлежит 1/8 атома от каждого угла.
Для ОЦК п = (1/8)- 8 + 1 = 2. Учитывая, что атомы соприка
в
ба, длина которой равна 4 атомным
радиусам, параметр решетки равен а
=
=
4R
,
а коэффициент
Рис. 1 4 Схема определения базиса ОЦК решетки
Рис. 1 5 Индексы Миллера Плоскость (112) пересекает оси X, Y,
 Z
на расстояниях 1, 1, ]/г единичных
расстояний
Z
на расстояниях 1, 1, ]/г единичных
расстояний
Проведя аналогичные вычисления, найдем QrUK = 74 %,
Qrn = 74 % .
Таким образом, решетки ГЦК и ГП более компактны, чем ОЦК.
Рассмотрим кристаллогра фические индексы (индексы Миллера). В кристаллографии положение атомных плоскостей в кристалле определяется отрезками, отсекаемыми этими плоскостями при их пересечении с осями координат X, Y, Z. Эти отрезки измеряются целыми числами т, п, р, равными длине ребер ячейки а, Ь, с, которые являются единичными расстояниями вдоль осей координат.
За индексы плоскостей принято брать обратные отрезки: h = = 1 /т, k = 1 /п, I = 1/р. Эти числа заключают в круглые скобки.
Каждая плоскость простой кубической решетки пересекает только одну ось координат. Отсекаемые отрезки равны (1, °°, <=>), (°°, 1, <*>), (°°, с», 1), а обратные им величины соответственно - (1, О, 0); (0, 1, 0); (0, 0, 1). Тогда для плоскости (100): 1/1, 1/°=, 1/°°; для плоскости (110): 1/1, 1/1, 1/°°; для плоскости (111): 1/1, 1/1, 1/1.
Пример графического изображения плоскостей представлен на рис. 1.5. На рис. 1.6 представлен ряд плоскостей в одной простой кубической решетке. Плоскость (010) расположена параллельно плоскости XZ элементарной ячейки. Плоскость (110) пересекает оси X, Y на одинаковом расстоянии и параллельна оси Z. Плоскость (111) пересекает все оси на одинаковом расстоянии от начала координат. Если плоскость отсекает по осям отрицательные
Рис.
1.6. Плоскости (010), (110), (111) и (010) в простой
кубической ячейке
отрезки, то над соответствующей цифрой индекса ставится знак минус, например (010) на рис. 1.6.
Для рассмотрения явлений, происходящих в кристаллических телах, введены понятия индексов направлений расположения рядов атомов в кристаллической решетке. Кристаллические направления проходят через начало координат и узлы кристаллической решетки. Приняв за единицу длину ребра элементарной ячейки (период решетки), определяют координаты любой точки этого направления. Их обозначают простыми числами, пропорциональными координатам выбранной точки вдоль координатных осей, и заключают в квадратные скобки. Кристаллографические направления и их индексы в простой кубической решетке представлены на рис. 1.7.
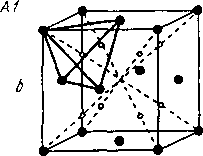
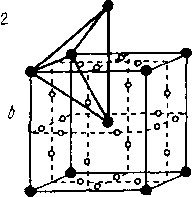
В пространственной решетке помимо атомов имеется свободное пространство, образующее поры. Различают октаэдрические и тетраэдрические поры. Центры этих пор показаны маленькими точками на рис. 1.8.
Радиус октаэдрической поры ячейки А1 решетки ГЦК с коэффициентом компактности 74 % составляет 0,41 радиуса основного атома (иона), а радиус тетраэдрической - лишь 0,22. Поры локализованы в центре ячейки А1 и по середине ее ребер.
Решетка А2 ОЦК имеет коэффициент компактности 68 %. Радиус пор октаэдрического типа (6 в центре граней и 12 в середине ребер) составляет 0,154 радиуса атома. 24 поры тетраэдрического типа, расположенные по 4 на гранях ячейки, могут принимать «чужой» атом с радиусом 0,29 от радиуса атома основного металла.
Решетка АЗ ГП также имеет коэффициент компактности 74 % . Радиусы 6 пор октаэдрического типа и 20 пор тетраэдрического типа составляют соответственно г = 0,14R и г = 0,225R, где R - радиус основного атома ячейки.
Некоторые металлы при разных температурах могут иметь
 различную
кристаллическую решетку. Способность
металла существовать в различных
кристаллических формах носит название
полиморфизма
или аллотропии.
Принято
обозначать полиморфную модификацию,
устойчивую при более низкой температуре,
индексом а (а-Fe), при более
высокой р, затем у и т. д.
различную
кристаллическую решетку. Способность
металла существовать в различных
кристаллических формах носит название
полиморфизма
или аллотропии.
Принято
обозначать полиморфную модификацию,
устойчивую при более низкой температуре,
индексом а (а-Fe), при более
высокой р, затем у и т. д.
Рис. 1.7. Индексы кристаллографических направлений в простой кубической ячейке пространственной решетки
|
|
|
I. j/ ь -IV 1 N \ 1 |
£/\Ч / / \i\ 1 / 1 V if 7 fa | - ♦ Чг- . Л ' /• . W!/ х/ \\ 1 / А |
Г -J I I |
|
|
|
А
о - поры • - атомы
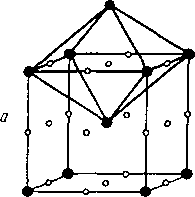
Рис.
1.8. Поры в кристаллических решетках
(А1 - ГЦК; А2 - ОЦК; АЗ - ГП):
о
- октаэдрические; б
-
тетраэдрические
 Известны
полиморфные превращения железа: Fea
о FeY
(a-Fe <-4
y-Fe), титана:
Tia о
TiY
(a-Ti y-Ti)
и других элементов.
Известны
полиморфные превращения железа: Fea
о FeY
(a-Fe <-4
y-Fe), титана:
Tia о
TiY
(a-Ti y-Ti)
и других элементов.
Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения.
При полиморфном превращении меняются форма и тип кристаллической решетки. Это явление называется перекристаллизацией. Так, при температуре ниже 911 °С устойчиво Fea, в интервале 911-1392°С устойчиво FeY. При нагреве выше 911 °С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка.
При переходе из одной полиморфной формы в другую меняются свойства, в частности плотность и соответственно объем вещества. Например, плотность FeY на 3 % больше плотности Fea, а удельный объем соответственно меньше. Эти изменения объема необходимо учитывать при термообработке.
Полиморфизм олова явился одной из причин гибели полярной экспедиции английского исследователя Р. Скотта. Оловом были запаяны канистры с керосином. При низкой температуре произошло полиморфное превращение пластичного белого олова с образованием хрупкого порошка серого олова. Горючее вылилось, и на обратном пути экспедиция осталась без топлива. Превращение белого олова в серое называют «оловянной чумой».
Исследование физико-химической природы этого явления позволило разработать способы борьбы с ним. Добавки в олово таких элементов, как Bi, Pb и Sb, противодействуют восприимчивости олова к чуме.
Типы кристаллических решеток важнейших металлических элементов приведены в табл. 1.1.
Таблица
1.1
Типы
кристаллических решеток
важнейших
металлических элементов
А
Металлы
с одним типом решетки
Тип
решетки
Координационное
число
Коэффициент
компактности, %
Металл
ГЦК
12
74
Ag,
Au, Pt, Си,
Al, Pb, Ni
ОЦК
8
68
Na,
К,
V, Nb, Cr, Mo, W
ГП
12
74
Be,
Mg, Zn, Cd
Б.
Металлы с полиморфным превращением
Металл
Тип
решетки
Аллотро
пическая
форма
Интервал
температур существования данной
модификации
Fe
ОЦК
а
До
911
ГЦК
У
911-1392
ОЦК
5
1392-1536
Co
ГПУ
а
До
477
ГЦК
Р
477-1430
Sn
Алмазная
а
До
13
Тетрагональная
объемноцентрированная
Р
13-232
Mn
Кубическая
сложная многоатомная
а
До
700
Кубическая
сложная многоатомная
Р
700-1079
Тетрагональная
гранецентрированная
Y
1079-1143
ОЦК
8
1143-1244
Zr
ГПУ
а
До
862
ОЦК
Р
862-1852
Ti
ГПУ
а
До
882
ОЦК
Р
882-1668
U
Ромбическая
а
До
663
Тетрагональная
объемноцентрированная
Р
663-764
ОЦК
Y
764-1130
Свойства материалов зависят от природы атомов, из которых они состоят, и силы взаимодействия между ними. Аморфные материалы характеризуются хаотическим расположением атомов. Поэтому свойства их в различных направлениях одинаковы, или, другими словами; аморфные материалы изотропны. В кристаллических материалах расстояния между атомами в разных кристаллографических направлениях различны. Например, в ОЦК решетке в кристаллографической плоскости, проходящей через грань куба, находится всего один атом, так как четыре атома в вершинах одновременно принадлежат четырем соседним элементарным ячейкам: (1/4) -4=1 атом. В то же время в плоскости, проходящей через диагональ куба, будут находиться два атома: 1 + (1/4) -4 = 2.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Различие свойств в кристалле в зависимости от направления испытания называется анизотропией.
Разница в физико-химических и механических свойствах в разных направлениях может быть весьма существенной. При измерении в двух взаимно перпендикулярных направлениях кристалла цинка значения температурного коэффициента линейного расширения различаются в 3-4 раза, а прочности кристалла железа - более чем в два раза.
Анизотропия свойств характерна для одиночных кристаллов, или так называемых монокристаллов. Большинство же технических литых металлов, затвердевших в обычных условиях, имеют поликристаллическое строение. Они состоят из большого числа кристаллов или зерен (рис. 1.9, а). При этом каждое отдельное зерно анизотропно. Различная ориентировка отдельных зерен приводит к тому, что в целом свойства поликристаллического металла являются усредненными.
6
Рис.
1.9. Ориентировка кристаллических
решеток в зернах литого металла (а)
и
после обработки давлением (б)
Поликристаллическое тело характеризуется квазиизотропно- стъю - кажущейся независимостью свойств от направления испытания. Квазиизотропность сохраняется в литом состоянии. При обработке давлением (прокатке, ковке), особенно если она ведется без нагрева, большинство зерен металла приобретает примерно одинаковую ориентировку - так называемую текстуру (рис. 1.9,6), после чего металл становится анизотропным. Свойства деформированного металла вдоль и поперек направления главной деформации могут существенно различаться. Анизотропия может приводить к дефектам металла (расслою, волнистости листа). Анизотропию необходимо учитывать при конструировании и разработке технологии получения деталей.
