
- •Основные термины и задачи физической химии.
- •Первый закон термодинамики. Вычисление тепловых эффектов. Энтальпия.
- •Факторы, от которых зависит тепловой эффект. Зависимость энтальпии от температуры (в трёх приближениях). Теплоёмкость веществ. Уравнение Кирхгофа в трёх приближениях.
- •Второе начало термодинамики. Энтропия
- •Третье начало термодинамики. Вычисление изменения энтропии в химических реакциях. Зависимость энтропии от температуры (в трех приближениях).
- •Самопроизвольные процессы. Равновесный процесс. Энергии Гиббса и Гельмгольца.
- •Химическое равновесие. Термодинамический вывод константы равновесия.
- •Кинетический вывод константы равновесия. Различные выражения константы равновесия. Равновесие в гетерогенных системах.
- •Смещение химического равновесия. Принцип Ле-Шателье. Влияние температуры на константу хим.Равновесия.
- •Влияние давления на хим.Равновесие. Расчет равновесных концентраций (пример)
- •Газообразное состояние вещества. Идеальный газ. Смесь идеальных газов.
- •Реальные газы. Критические температура и давление.
- •Фаза. Фазовые переходы и равновесия. Диаграмма состояния.
- •Уравнение Клаузиуса - Клапейрона. Определение координат тройной точки. Вычисление теплоты фазового перехода.
- •Растворы газов в жидкостях. Способы выражения растворимости газов. Зависимость растворимости газов от давления и температуры.
- •Смеси жидкостей. Взаимная растворимость жидкостей. Давление насыщенного пара идеальных растворов. Закон Рауля.
- •Состав пара идеальных растворов. Диаграмма «температура-состав». Реальные растворы.
- •Поверхностная энергия и поверхностное натяжение. Факторы, от которых зависит поверхностное натяжение.
- •Поверхностное натяжение растворов. Пав, пиав, п-нв.
- •Адсорбция. Уравнения Шишковского и Ленгмюра.
- •Дисперсные системы. Признаки дисперсных систем. Классификация дисперсных систем по агрегатному состоянию.
- •Классификация дисперсных систем по размерам частиц дисперсной фазы. Классификация по межфазовому взаимодействию.
- •Способы получения дисперсных систем. Строение коллоидных растворов. Строение мицеллы.
- •Свойства дисперсных систем: броуновское движение и диффузия частиц дисперсной фазы.
- •Седиментация.
- •Оптические свойства дисперсных систем
- •Электрические поверхностные явления. Электрофорез, электроосмос.
- •Двойной электрический слой. Строение дэс.
- •Коагуляция коллоидных растворов.
Фаза. Фазовые переходы и равновесия. Диаграмма состояния.
Фазой называется совокупность однородных частей системы одинаковых по составу и физико-химическим свойствам.
Переход вещества из одной фазы в другую без изменения химического состава называется фазовым переходом. (плавление, испарение, возгонка, полиморфное превращение (из графита в алмаз))
Если скорости прямого и обратного переходов равны, такое состояние системы называется фазовым равновесием.
Диаграмма состояния. В однокомпонентных системах (К=1) любая фаза представляет одно вещество в различных агрегатных состояниях или полиморфных модификациях.
Число, находящихся в равновесии фаз определяется по правилу фаз Гиббса.
Зависимость существования различных фаз от Т и Р, принято изображать в виде диаграмм состояния вещества (диаграмм фазовых равновесий)
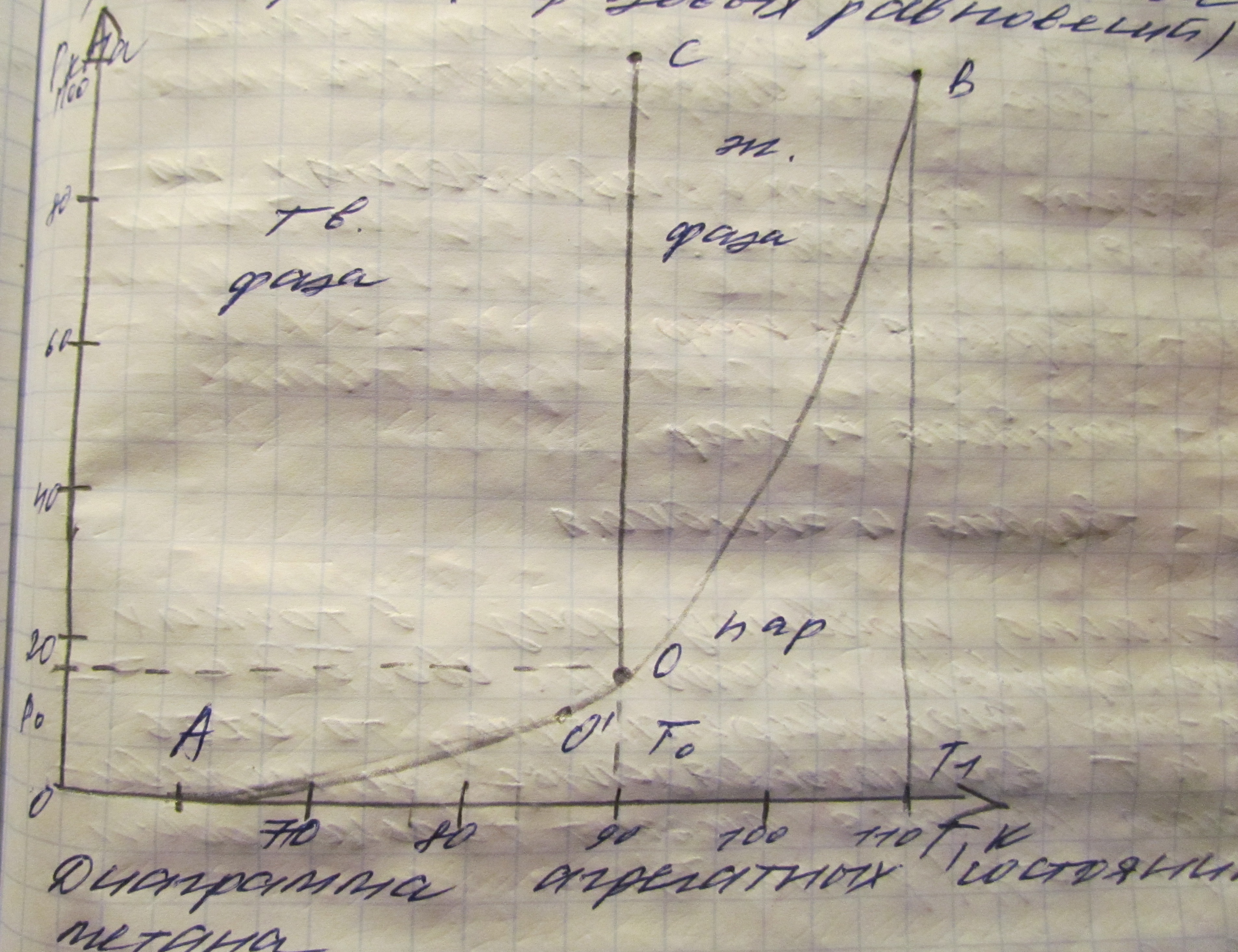
Уравнение Клаузиуса - Клапейрона. Определение координат тройной точки. Вычисление теплоты фазового перехода.
Связь между основными термодинамическими параметрами, однокомпонентной двухфазной системы, находящейся в равновесии выражается уравнением К-К
Определение координат тройной точки: тройная точка находится на пересекающихся кривых возгонки и испарения. Определения ее координат непосредственно по графикам, построенным по экспериментальным данным в коор. Р(Т) может привести к значительной ошибке.
Возможность ошибки возрастает, если часть экспериментальных данных относится к переохлажденному состоянию.
Более точные результаты получаются, если для процесса возгонки и испарения построить графики, проинтегрированного в 1 приближении уравнения К-К, которые координата Ln p от Т (1/Т), являются прямимы линиями.
Точка пересечения этих 2-ух прямых (возгонки и испарения), является тройной точкой.
Вычисление теплоты фазового перехода.
1 способ: по 2 значениям давлений насыщенного пара р1 и р2 при температурах Т1 и Т2 по уравнению:
Для такого вычисления требуется весьма точное измерение Т и Р. Вычисленная теплота фазового перехода тем ближе к истинному значению, чем меньше интервал температур.
2 способ: теплоты возгонки и испарения можно вычислить по tg углов наклона прямых, проинтегрированного в 1 приближении уравнения К-К:
Тангенсы углов наклона находят через отношения отрезков:
Этот способ более точен, чем 1-ый, т.к. вычисление основаны на нескольких экспериментах.
Растворы газов в жидкостях. Способы выражения растворимости газов. Зависимость растворимости газов от давления и температуры.
Газ, находящийся в контакте с жидкостью растворяется в ней. Этот процесс называется адсорбцией.
Обратимый процесс выделения газа из жидкости называется десорбцией.
Раствор становится насыщенным, когда скорость адсорбцией будет равна скорости десорбции.
Растворимость газов в жидкостях измеряются в концентрации насыщенного раствора, которая может быть выражена любым способом (массовая концентрация, молярная доля, молярная концентрация)
Растворимость газов в воде часто выражают коэффициентом растворимости.
q – коэффициент растворимости.
Иногда растворимость газа характеризуют коэффициент адсорбции, он показывает какой V газа, приведенный к н.у. растворяется в 1 V жидкости при данной температуре Т и давлении газа = 1 атм.
Растворимость газа в жидкостях изменяется в широких пределах и зависит в первую очередь от природы газа и природы растворителя.
Также зависит от Т, Р газа и С растворенных в жидкости каких-либо веществ.
Зависимость растворимости газов от Р: При растворении газа в ж. их V сокращается, поэтому в соответствии с принципом Ле-Шателье увеличение Р должно увеличивать и растворимость газа.
Количественно зависимость растворимости газа от Р выражается законом Генри: растворимость газа при Т=cоnst пропорционально его Р над жидкостью. С=К*Р, где С – растворимость газа (концентрация насыщенного раствора); Р – давление газа над жидкостью; К – коэффициент пропорциональности или константа Генри, зависящий от природы газа и жидкости, от Т, но не зависящий от Р.
Закон Генри выполняется для идеальных растворах. В реальных растворах он соблюдается тем лучше, чем меньше растворимость газа, и чем меньше его Р над жидкостью.
Газы, взаимодействующий с жидкостью, закону Генри не поддаются.
Закон Генри позволяет вычислить растворимость газов при различных Р.
Зависимость растворимости газов от Т: При увеличении Т растворимость газов в соответствием с принципом Ле-Шателье уменьшается, т.к. все газы растворяются с выделением тепла.
Зависимость константы генри от Т:
