
- •Основные термины и задачи физической химии.
- •Первый закон термодинамики. Вычисление тепловых эффектов. Энтальпия.
- •Факторы, от которых зависит тепловой эффект. Зависимость энтальпии от температуры (в трёх приближениях). Теплоёмкость веществ. Уравнение Кирхгофа в трёх приближениях.
- •Второе начало термодинамики. Энтропия
- •Третье начало термодинамики. Вычисление изменения энтропии в химических реакциях. Зависимость энтропии от температуры (в трех приближениях).
- •Самопроизвольные процессы. Равновесный процесс. Энергии Гиббса и Гельмгольца.
- •Химическое равновесие. Термодинамический вывод константы равновесия.
- •Кинетический вывод константы равновесия. Различные выражения константы равновесия. Равновесие в гетерогенных системах.
- •Смещение химического равновесия. Принцип Ле-Шателье. Влияние температуры на константу хим.Равновесия.
- •Влияние давления на хим.Равновесие. Расчет равновесных концентраций (пример)
- •Газообразное состояние вещества. Идеальный газ. Смесь идеальных газов.
- •Реальные газы. Критические температура и давление.
- •Фаза. Фазовые переходы и равновесия. Диаграмма состояния.
- •Уравнение Клаузиуса - Клапейрона. Определение координат тройной точки. Вычисление теплоты фазового перехода.
- •Растворы газов в жидкостях. Способы выражения растворимости газов. Зависимость растворимости газов от давления и температуры.
- •Смеси жидкостей. Взаимная растворимость жидкостей. Давление насыщенного пара идеальных растворов. Закон Рауля.
- •Состав пара идеальных растворов. Диаграмма «температура-состав». Реальные растворы.
- •Поверхностная энергия и поверхностное натяжение. Факторы, от которых зависит поверхностное натяжение.
- •Поверхностное натяжение растворов. Пав, пиав, п-нв.
- •Адсорбция. Уравнения Шишковского и Ленгмюра.
- •Дисперсные системы. Признаки дисперсных систем. Классификация дисперсных систем по агрегатному состоянию.
- •Классификация дисперсных систем по размерам частиц дисперсной фазы. Классификация по межфазовому взаимодействию.
- •Способы получения дисперсных систем. Строение коллоидных растворов. Строение мицеллы.
- •Свойства дисперсных систем: броуновское движение и диффузия частиц дисперсной фазы.
- •Седиментация.
- •Оптические свойства дисперсных систем
- •Электрические поверхностные явления. Электрофорез, электроосмос.
- •Двойной электрический слой. Строение дэс.
- •Коагуляция коллоидных растворов.
Седиментация.
Под действием силы тяжести частицы дисперсной фазы постепенно оседают, если плотность частиц больше плотности среды или всплывают, если плотность частиц меньше плотности среды.
Простым и распространенным методом изучения распределения тв.частиц по размерам от 1 до 100 мкм является седиментационный анализ. Метод основанный на разной скорости оседания частиц в гравитационном поле.
Экспериментально снимается седиментационная кривая, то есть зависимость от времени, привеса осевших частиц.
Оптические свойства дисперсных систем
При прохождении излучения через коллоидный раствор могут наблюдаться следующий явления: поглощение, отражение, рассеивание (опалесценция)
В истинном растворе происходит только поглощение: расвор окрашен, если его частицы способны избирательно поглощать излучения из видимой области спектра.
Отражение света поверхностью частиц происходит по законам геометрической оптики. Оно возможно, размеры частиц превышают длину волны света. Поэтому грубодисперсными системы видны в обычные микроскопы и даже не вооруженным взглядом.
Коллоидные частицы имеют размеры от 0,01 до 0,1 мМ. То есть меньше длины волны, видимого света. Световые лучи не отражаются, а рассеиваются.
Светорассеивание – изменение направления, распространения излучения в результате эффекта дифракции на препятствие, размеры которых меньше длины волны. Видимым признаклм этого является мутность коллоидных растворов.
Эффект Тендаля. Заключается в том, что пучок плоскополяризованного света при прохождении через коллоидный расвор становится видимым сбоку в виде конуса. ФЭК
Причина эффекта в том, что размеры коллоидных частиц соответствуют размерам длины световых волн (особенно ближе к красному спектру), поэтому при прохождении светового луча через раствор часть световых волн отклоняется, встречаясь с коллоидными частицами.
Электрические поверхностные явления. Электрофорез, электроосмос.
Эти явления возникают, если в результате поверхностных явлений поверхность адсорбента приобретает электрический заряд, тогда со стороны контактной фазы, вдоль заряженной поверхности, возникает слой противо ионов, и возникает двойной электрический слой (ДЭС), определяющий многие специфические свойства дисперсных систем:
Появление ДЭС снижает поверхностное натяжение и тем самым способствует стабилизации систем, это называется электростатический фактор устойчивости.
Наличие ДЭС порождает электрокинетические явления – это движение дисперсной фазы относительно дисперсной среды или наоборот под воздействием внешних сил (электрофорез, электроосмос и др.)
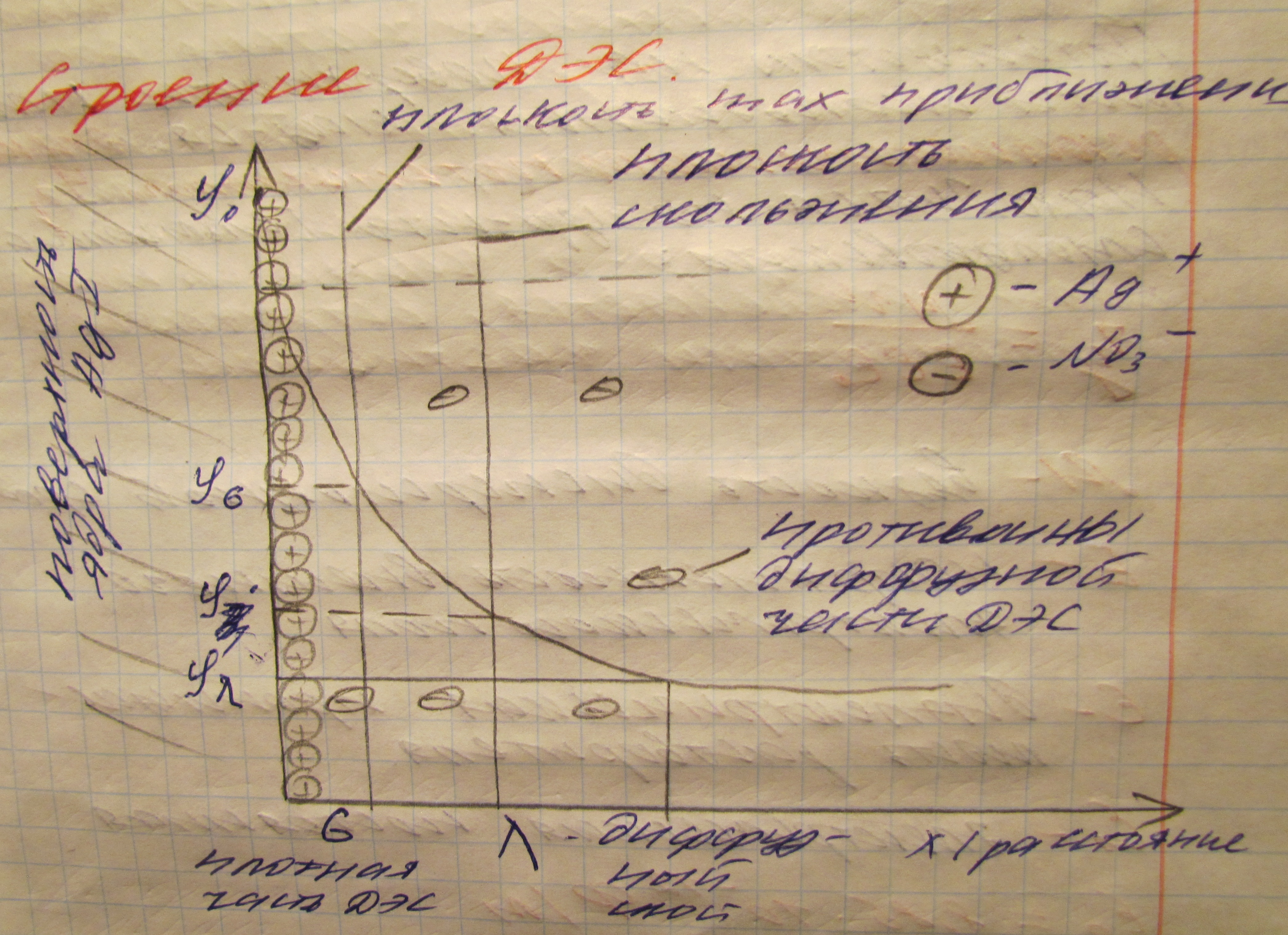
Двойной электрический слой. Строение дэс.
Механизмы возникновения ДЭС:
Адсорбционный: возникает за счет адсорбции на поверхности твердой фазы (осадка) противо иона.
Диссоциационный: ДЭС образуется за счет поверхностного диссоциация.
Коагуляция коллоидных растворов.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию. Коагуляция — естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую фазу и дисперсионную среду. Дисперсная система стремится достигнуть состояния минимальной энергии.
