
- •Пояснительная записка
- •Тематическое планирование
- •Раздел 1. Агрегатные состояния вещества
- •Раздел 2. Основы химической термодинамики
- •Раздел 3. Растворы
- •Раздел 4. Химическая кинетика. Катализ
- •Раздел 5. Адсорбция.
- •Раздел 6. Дисперсные системы. Коллоидные системы.
- •Раздел 7. Грубодисперсные системы.
- •Раздел 8. Высокомолекулярные соединения и их растворы.
- •Литература.
- •Задания для домашней контрольной работы и методические рекомендации по её выполнению
- •Требования, предъявляемые к выполнению и оформлению контрольной работы
- •Исправление контрольной работы на основе рецензии
- •Критерии оценки выполненной домашней контрольной работы
- •Вопросы и задачи для дкр
Раздел 3. Растворы
Общая характеристика. Растворы газов в жидкостях, твердых тел в жидкостях, жидкостей в жидкостях. Закон Генри. Влияние t°, р, концентрации на растворимость веществ. Взаимная растворимость жидкостей. Экстракция. Растворимость твердых тел в жидкостях. Теплота растворения. Диффузия и осмос, осмотическое давление, их сущность и значение. Закон Рауля. Криоскопия и эбуллиоскопия. Температура замерзания и кипения растворов.
Литература
[1] гл. 3 § 4, 5, 8-12.
Методические рекомендации
Уясните, что диффузия – это двусторонний процесс распределения веществ, а осмос – односторонний процесс проникновения молекул растворителя через полупроницаемую мембрану. Объединяет эти процессы тот факт, что в результате этих процессов происходит выравнивание концентраций веществ.
Четко усвойте методику расчета осмотического давления, температуру замерзания, кипения растворов и причину отличия их у растворителей и растворов.
При решении задач обращайте внимание на «ключевое слово» в условии, что поможет выбрать верную формулу для решения.
Задача 1.
Рассчитайте осмотическое давление раствора глюкозы, если 200 г ее растворили в мерной колбе при t = 25°С объемом 500 мл.
Д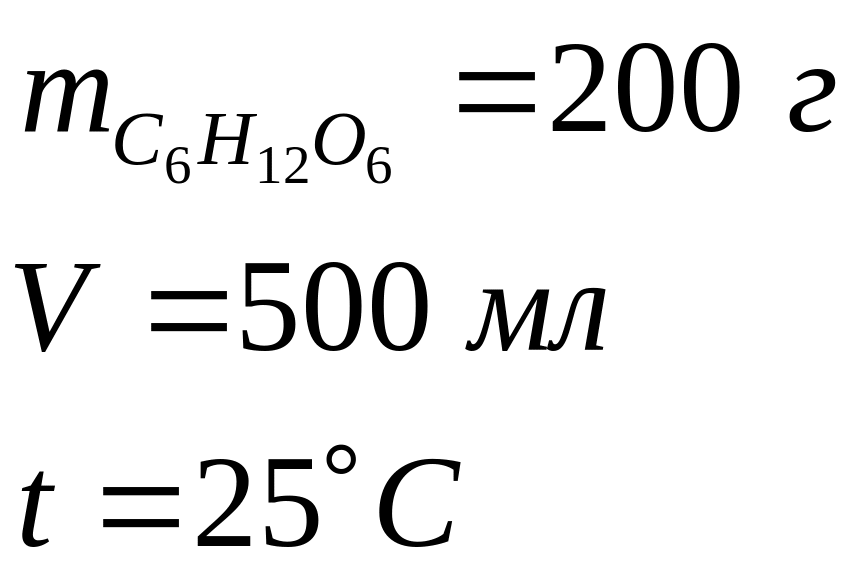 ано: Решение:
ано: Решение:
«
![]()
![]() Ключевое
слово» – осмотическое давление по-зволяет
верно выбрать для решения формулу
Вант-Гоффа:
Ключевое
слово» – осмотическое давление по-зволяет
верно выбрать для решения формулу
Вант-Гоффа:
πv = nRT, , т. е. ;

![]()
П![]() ри
решении необходимо соблюдать размерность
величин в системе Си.
ри
решении необходимо соблюдать размерность
величин в системе Си.
![]()
З![]() адача
2.
адача
2.
Рассчитайте tкип. и tзам. 10% раствора сахарозы.
(Кэб. = 0,516°С; Ккр. = 1,86°С).

Д![]() ано: Решение:
ано: Решение:
«![]()

![]() Ключевые
слова» – температура кипения и температура
замерзания предполагают использование
формулы:
Ключевые
слова» – температура кипения и температура
замерзания предполагают использование
формулы:
![]()
, откуда
т![]() .
к. раствор 10%, то m = 10 г, а
L = 100-
.
к. раствор 10%, то m = 10 г, а
L = 100-
-10=90 г.
![]()
![]()
![]()
Задача 3. Вычислить давление пара 5 %-ного водного раствора сахарозы при t = 50° С. Давление паров воды при этой температуре равно 92,51 мм рт. ст.
Д ано:
Решение:
ано:
Решение:
ωсахар. = 5 % «Ключевые слова» - давление паров говорят о необходимос-
t = 50° C ти для решения задачи использовать Формулу Рауля:
ρ о
= 92, 51 мм рт. ст.
о
= 92, 51 мм рт. ст. 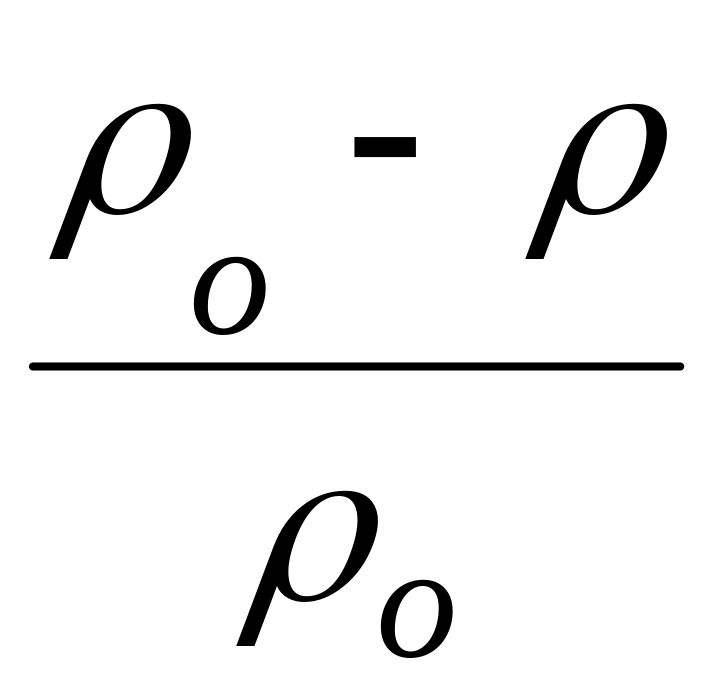 =
N,
где
=
N,
где
ρ - ? ρо – давление паров воды;
ρ – давление паров раствора;
N – мольная доля растворенного вещества.
Так
как ω = 5 %, то mсахар.
= 5 г, mH![]() O
= 100 – 5 = 95 г
O
= 100 – 5 = 95 г
N
=
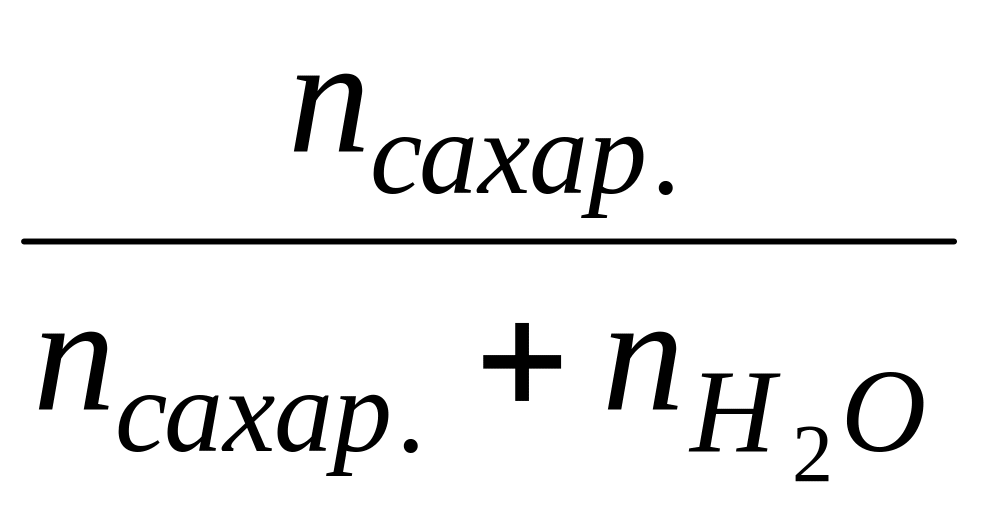 ;
при nсахар.<<
nH
;
при nсахар.<<
nH![]() O N
=
O N
=
![]()
М(сахар)
= 342 г/моль; n(cахар)
=
![]() =
0,015 (моль)
=
0,015 (моль)
М(H
O)
= 18 г/моль; n(H
O)
=
![]() =
5,278 (моль)
=
5,278 (моль)
N
=
![]()
В СИ давление выражается в Па, поэтому ρо = 92,51 мм рт. ст. = 12,3 · 103 Па, поэтому ρ = ρо(1 - N) = 12,3 · 103(1 – 0,0028) = 12,26 · 103 Па.
Задача 4. При температуре 20° С давление пара воды равно 2,314 · 103 Па. На сколько понизится давление пара при этой температуре, если в 1 литре воды растворить 50 г сахарозы?
Д ано: Решение:
ано: Решение:
t = 20° C Из формулы Рауля:
ρо
= 2,314 · 103
Па ρo
– ρ
= ∆ρ,
поэтому
![]() = N;
= N;
VH
O
= 1 л N
=
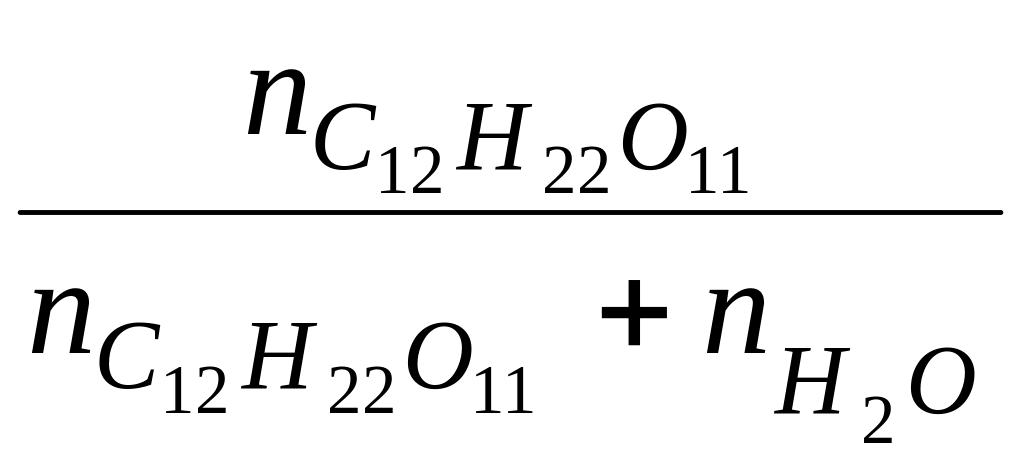 ;
;
m
C![]() H
H![]() O
O![]() =
50 г nC
H
O
=
=
50 г nC
H
O
=
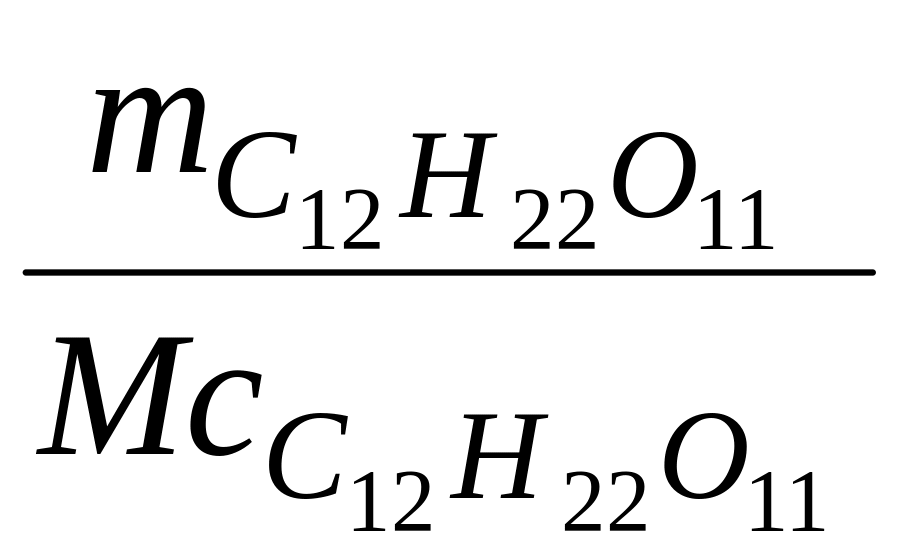 =
=
![]() = 0,146 моль;
= 0,146 моль;
∆ρ - ? mH O = VH O · ρH O = 1000 см3 · 1 г/см3 = 1000 г;
nH
O
=
![]() =
=
![]() = 55,56 моль;
= 55,56 моль;
N =
![]() = 0,0026;
= 0,0026;
∆ρ = 2,314 · 103 · 0,0026 = 6,016 Па.
Задача 5. Раствор, содержащий 4,5 г вещества в 50 г воды, кипит при температуре 100,26° С. Определить молярную массу растворенного вещества (Кэб = 0,52°).
Д ано: Решение:
ано: Решение:
Кэб
= 0,52 Кэб =
![]() ,
значит М =
,
значит М =
![]() ;
;
m = 4,5 г ∆tкип = tкип. р-ра - tкип. р-ля;
tкип = 100,26° С ∆tкип = 100,26° - 100 = 0,26°;
М
- ? М =
![]() = 180 (г/моль).
= 180 (г/моль).
Задача 6. Определить массу глюкозы, содержащейся в 5 л раствора при 25°С, если осмотическое давление такого раствора составляет 4,82 ат.
Д ано: Решение:
V = 5 л На основании формулы Вант- Гоффа:
t
= 25° C π
=
![]() ,
можем записать
,
можем записать
π
= 4,28 ат m
=
![]() .
.
m - ? Подставляем все величины в системе СИ:
π – в Па, V – в м3, температуру – в К.
m
=
![]() =
1,8 · 10-3
кг.
=
1,8 · 10-3
кг.
Задача 7. Рассчитать малярную массу неэлектролита, водный раствор которого, содержащий 0,730 г неэлектролита в 400 мл раствора при 20° С, имеет осмотическое давление 73967 Па.
Дано: Решение:
m = 0,730 г На основании формулы Вант-Гоффа:
V
= 400 мл М =
![]() .
.
t = 20° C Приводим все величины в СИ:
π = 73967 Па m = 0,73 · 10-3 кг
М - ? V = 4 · 10-4 м3
Т = 273 + 20 = 293 К
М =
![]() = 60 (кг/кмоль).
= 60 (кг/кмоль).
